Слайд 2
Немецкий химик Иоганн Вольфганг Дёберейнер родился
15 декабря 1780 г. в баварском городке Хоф в
семье извозчика. Бедственное материальное положение семьи не позволило ему получить среднее образование, поэтому Дёберейнер занимался самостоятельно и изредка брал уроки у приходского священника. Тем не менее Дёберейнер смог сдать экзамены на должность помощника аптекаря.
Чтобы получить право заведовать аптекой, в 1800–1803 гг. он изучал естественные науки в Страсбурге.
Вернувшись в Германию, в 1810 г. он при содействии И. В. Гёте был приглашен в Йенский университет на должность профессора. Дёберейнеру удалось установить первые закономерности в изменении свойств элементов.
Слайд 3
В 1829 г немецкий химик
Иоган Вольфганг Дёберейнер
сформулировал закон триад.
Слайд 4
Разбить все известные элементы на триады Дёберейнеру, естественно,
не удалось, тем не менее, закон триад явно указывал
на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
Слайд 5
Немецкий химик
Леопольд Гмелин
родился 2 августа 1788
г. в Гёттингене в семье известного химика и врача
Иоганна Фридриха Гмелина. Учился в Тюбингенском и Гёттингенском университетах; в 1812 получил степень доктора медицины.
С 1813 по 1851 работал в Гейдельбергском университете; с 1817 — профессор медицины и химии.
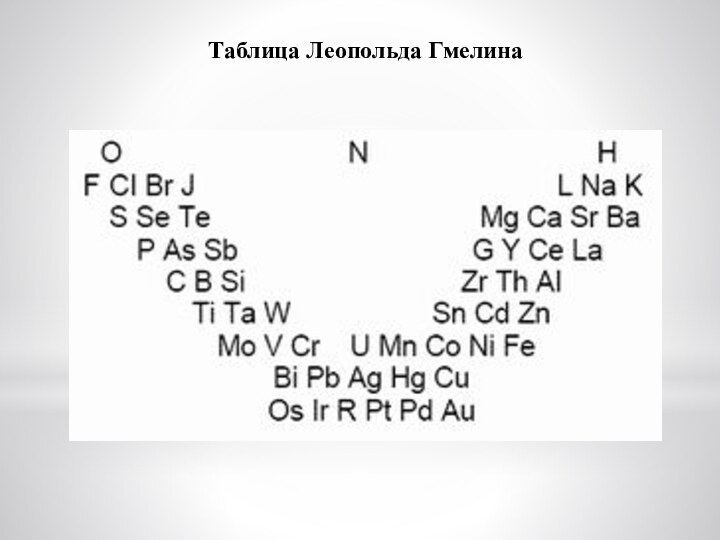
Слайд 6
В 1843 г Леопольд Гмелин привёл таблицу химически сходных
элементов, расставленных по группам в порядке возрастания "соединительных масс".
Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз.
Слайд 8
Джон Александр Рейна Ньюлендс родился в Лондоне 26
ноября 1837 г. Отец, шотландский священник Уильям Ньюлендс, не хотевший,
чтобы сын пошёл по его стопам, подготовил его к поступлению в в химический колледж. Мать, Мэри Сара Рейна, итальянка, привила сыну любовь к музыке. Получив образование в колледже, он в 1857 г. Ньюлендс становится ассистентом химика в Королевском сельскохозяйственном обществе. Однако под влиянием матери Ньюлендс уезжает на её родину, в Италию, где набирало силу освободительное движение во главе с Джузеппе Гарибальди. Там в начале 1860 г. Ньюлендс познакомился со Станислао Канниццаро – одним из реформаторов атомно-молекулярного учения. Общение с Канниццаро, по-видимому, привлекло внимание Ньюлендса к проблеме атомных весов элементов.
Слайд 9
Джон Александр Рейна Ньюлендс в1864 г. опубликовал таблицу элементов,
отражающую предложенный им закон октав. Ньюлендс показал, что в
ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
Слайд 11
Английский химик Уильям Одлинг родился 5 сентября 1829
г. в Саутуорке, близ Лондона. В 1846-1850 гг. он получил
медицинское образование в медицинской школе при госпитале Св. Варфоломея в Лондоне. В 1850 г. изучал химию в Париже у Шарля Жерара. С 1868 г. – профессор Королевского института, с 1872 г. – Оксфордского университета. Член Лондонского королевского общества с 1859 г., его почётный Секретарь (1856-1869), Вице-президент (1869-1872) и Президент (1873-1875).
Слайд 12
В 1864 году Уильям Одлинг, пересмотрев предложенную им
в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил
следующую таблицу, не сопровождаемую какими-либо пояснениями.
Слайд 14
Юлиус Лотар Мейер родился 19 августа 1830 года
в семье врача в маленьком городке Фареле в провинции
Ольденбург. Обладая слабым здоровьем, среднюю школу он смог закончить только к двадцати одному году. После школы по примеру своего отца Мейер стал изучать медицину, и в 1854 году получил степень доктора в Вюрцбургском университете.
Слайд 15
В 1870 г. Юлиус Лотар Мейер опубликовал свою первую
таблицу, в которую включены 42 элемента (из 63), размещённые
в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
Слайд 17
Дмитрий Иванович Менделеев родился 8 февраля 1834 г.
в г. Тобольске, в семье директора гимназии и попечителя
училищ. Мать - владелица небольшого стекольного производства. 1850 г. он поступил на отделение естественных наук физико-математического факультета Главного педагогического института в Петербурге. В 1855 г. Менделеев окончил институт с золотой медалью. В 1856 г. защитил в Петербургском университете магистерскую диссертацию, в 1857 г. был утверждён приват-доцентом этого университета и читал там курс органической химии. В 1876 г. Менделеев стал членом-корреспондентом Петербургской АН, но кандидатура Менделеева в академики была в 1880 г. отвергнута.
Слайд 18
В марте 1869 г. русский химик Дмитрий Иванович Менделеев
представил Русскому химическому обществу периодический закон химических элементов, изложенный
в нескольких основных положениях.
В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
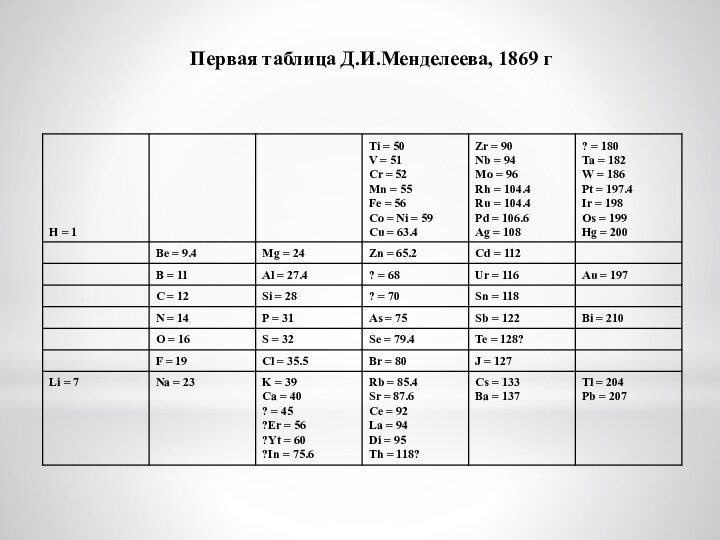
Слайд 19
Первая таблица Д.И.Менделеева, 1869 г
Слайд 20
В 1871 г. Менделеев в итоговой статье "Периодическая законность
химических элементов" дал формулировку Периодического закона:
«Свойства элементов, а
потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса».
Тогда же Менделеев придал своей периодической таблице классический вид.
Слайд 21
В конце 1870 г. Менделеев доложил РХО статью "Естественная
система элементов и применение её к указанию свойств неоткрытых
элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций).
Слайд 22
Распространённее других являются 3 формы таблицы Менделеева:
«короткая» (короткопериодная)
«длинная» (длиннопериодная)
«сверхдлинная».
В «сверхдлинном» варианте
каждый период занимает ровно одну строчку.
В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной.
В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Слайд 25
Вторая формулировка
Периодического закона
Свойства химических элементов и образованных
ими веществ находятся в периодической зависимости от зарядов их
атомных ядер.
Слайд 26
Третья формулировка
Периодического закона
Свойства химических элементов и образованных
ими веществ находятся в периодической зависимости от периодичности в
изменении конфигураций внешних электронных слове атомов химических элементов.
Слайд 27
ВОПРОС №2: Типы химической связи.
Слайд 28
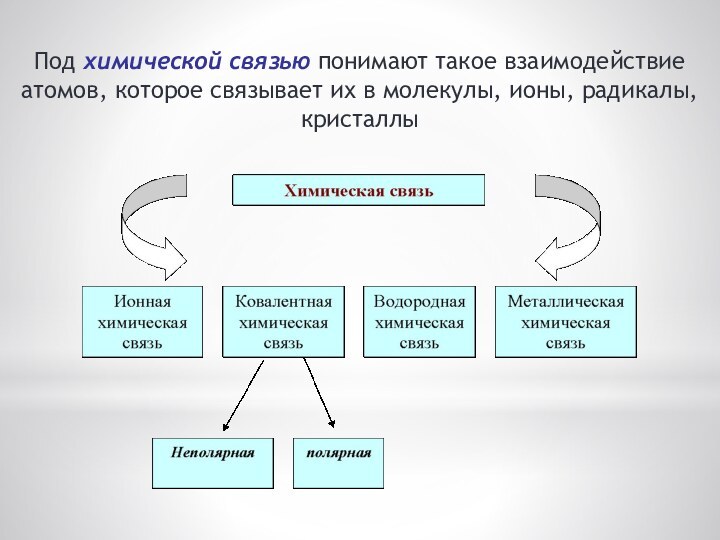
Под химической связью понимают такое взаимодействие атомов, которое
связывает их в молекулы, ионы, радикалы, кристаллы
Слайд 29
Ионная связь – это электростатическое притяжение между ионами;
Возникает
между атомами, имеющими большую разность электроотрицательности (более 2);
Образуется между
атомами наиболее активных металлов и неметаллов;
При образовании ионной связи атом металла отдает свои электроны атому неметалла, при этом каждый из атомов получает завершенный энергетический уровень. +
ПРИМЕР: Li _ 1 е Li катион
2 1 2
_
F + 1 е F анион
2 7 2 8
Слайд 30
Вещества с ионной связью при н.у. находятся в
твердом агрегатном состоянии и образуют кристаллы с ионной кристаллической
решеткой
В узлах ионной кристаллической решетки находятся ионы, между которыми присутствует ионная связь
Физические свойства: тугоплавкие, нелетучие, твердые, но хрупкие, многие растворимы, в растворах и расплавах проводят электрический ток (щелочи, соли и др.)
Ионная связь является крайним случаем ковалентной полярной связи
Слайд 31
Ковалентная связь – это связь между атомами, возникающая
за счет образования общих электронных пар.
По обменному механизму: каждый
атом предоставляет в общую электронную пару один неспаренный электрон:
Н Н
По донорно-акцепторному механизму: один атом предоставляет электронную пару (донар), а другой – пустую орбиталь (акцептор)
+ + +
Н + : NН 3 Н NН 3 или Н NН 3
Слайд 32
Число общих электронных пар равно числу связей между
двумя атомами, или кратности связи
Простая (одинарная связь) образуется за
счет перекрывания электронных облаков на линии, соединяющей центры атомов (ϭ-связь)
Н2 ϭ (s – s)
Сl2 ϭ (р – р)
НCl ϭ (s – р)
Двойная связь содержит ϭ и π – связи. π – связи образуются за счет бокового перекрывания р и d облаков:
Тройная связь содержит ϭ и две π – связи.
Полуторная связь (электронные облака «размазаны» между тремя и четырьмя атомами)
Н О N О
О
Слайд 33
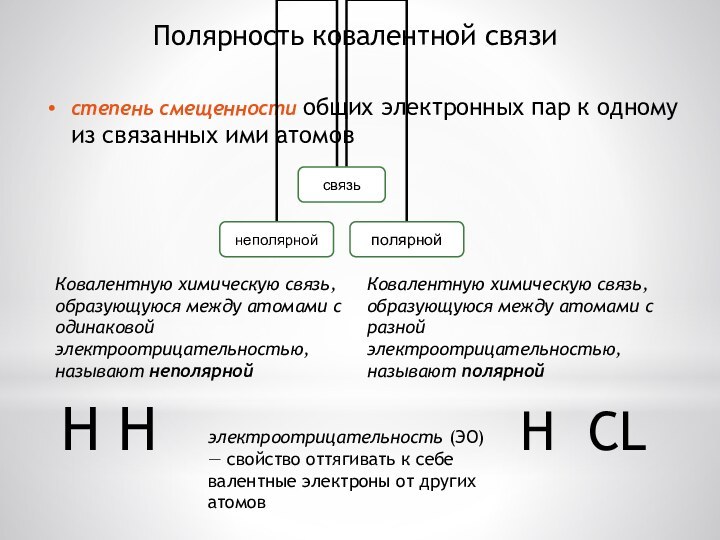
Полярность ковалентной связи
степень смещенности общих электронных пар к
одному из связанных ими атомов
электроотрицательность (ЭО) — свойство
оттягивать к себе валентные электроны от других атомов
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной
Ковалентную химическую связь, образующуюся между атомами с разной электроотрицательностью, называют полярной
H H
H СL
Слайд 34
Металлы образуют металлические кристаллические решетки, в узлах которых
находятся катион-атомы, а между ними «электронный газ», определяющий такие
физические свойства металлов, как металлический блеск, тепло и электропроводность.
Металлическая химическая связь осуществляется свободными электронами, общими для всего кристалла.
Слайд 36
ВОПРОС №3: Типы химических реакций, правила
протекания химических
реакций; современные
представления о скорости химических реакций.
Слайд 37
Химическая реакция - превращение
одного или нескольких исходных
веществ
(реагентов) в отличающиеся
от них по химическому составу
или
строению вещества (продукты
реакции), сопровождающееся
разрывом и/или образованием
химических связей.
Слайд 38
Условия которые должны выполняться, чтобы произошла химическая реакция:
1. Необходимо, чтобы реагирующие вещества соприкоснулись и чем больше
площадь их соприкосновения, тем быстрее произойдет химическая реакция.
2. Некоторые реакции идут без нагревания, и только для некоторых реакций оно необходимо.
3. Некоторые реакции протекают под действием электрического тока и света.
Слайд 40
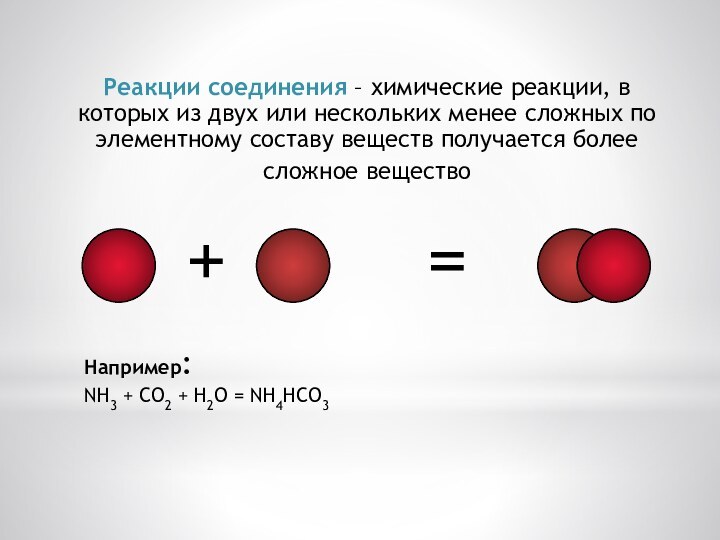
Реакции соединения – химические реакции, в которых из
двух или нескольких менее сложных по элементному составу веществ
получается более сложное вещество
Например:
NH3 + CO2 + H2O = NH4HCO3
Слайд 41
Реакция разложения - это реакции, в результате которых
сложное вещество разлагается на несколько других, более простых веществ.
Например:
2KMnO4?K2MnO4+ MnO2 + O2
Слайд 42
Реакция, протекающая между простыми и сложными веществами, при
которой атомы простого вещества замещают атомы одного из элементов
в сложном веществе, называется реакцией замещения.
Например:
Zn + 2HCl = ZnCl2 + H2
2Fe +3H2O = Fe2O3 +3H2
Слайд 43
Реакция, протекающая между двумя сложными веществами, при которой
атомы
или группы атомов одного вещества замещают атомы или
группы атомов другого
вещества, называется реакцией обмена.
Например:
CuO + H2SO4 = CuSO4 + H2O
Слайд 45
По тепловому эффекту
химические реакции бывают:
Слайд 46
По присутствию других веществ
химические реакции бывают:
Слайд 47
ВОПРОС №4: Химические системы: растворы,
дисперсные системы электрохимические
системы,
катализаторы и каталитические системы, полимеры.
Слайд 49
Растворы - однородные смеси переменного состава.
Растворы
Жидкие - воды озер,
рек, морей, нефть и др.
Твердые - сплавы
Газовые - воздух,
природные горючие газы и др., их чаще называют смесями
Слайд 50
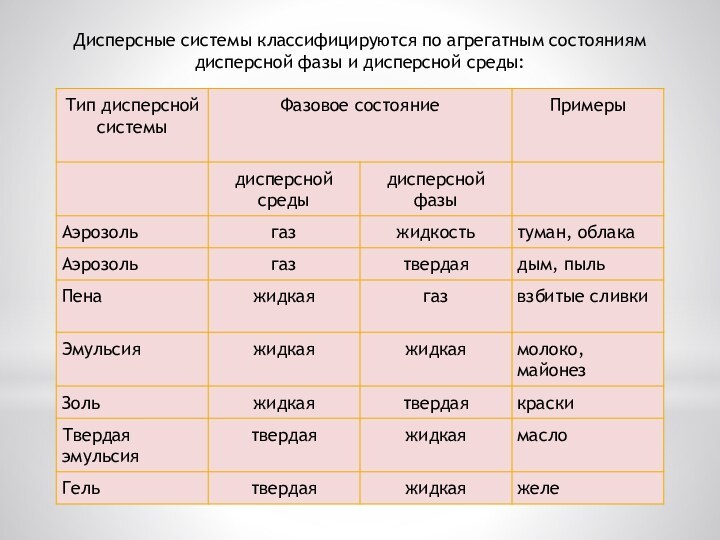
Дисперсными называют гетерогенные системы, в которых одно вещество
в виде очень мелких частиц равномерно распределено в объёме
другого
Дисперсные системы состоят как минимум из двух компонентов:
1. дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой;
2. дисперсной фазы, играющей роль растворённого вещества.
Слайд 51
Дисперсные системы классифицируются по агрегатным состояниям дисперсной фазы
и дисперсной среды:
Слайд 52
Полимеры - высокомолекулярные соединения, которые характеризуются молекулярной массой
от нескольких тысяч до многих миллионов. Молекулы полимеров, называемые
также макромолекулами, состоят из большего числа повторяющихся звеньев. Вследствие большой молекулярной массы макромолекул полимеры приобретают некоторые специфические свойства. Поэтому они выделены в особую группу химических соединений.
Полимеры бывают:
Неорганические
Органические (природные и синтетические)
Элементоорганические
Слайд 53
Электрохимические процессы –
это процессы взаимного превращения
двух
видов энергии.
Химической в электрическую –
химические источники тока (ХИТ)
Электрической в химическую –
электролиз
Слайд 54
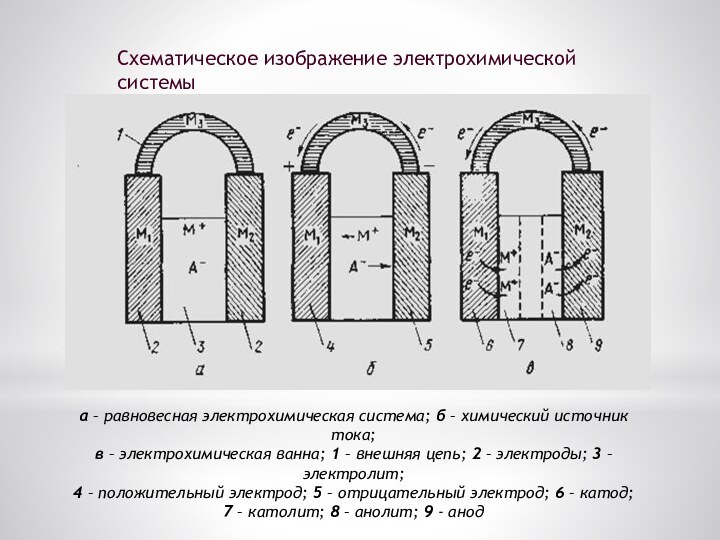
а – равновесная электрохимическая система; б – химический
источник тока;
в – электрохимическая ванна; 1 – внешняя
цепь; 2 – электроды; 3 – электролит;
4 – положительный электрод; 5 – отрицательный электрод; 6 – катод;
7 – католит; 8 – анолит; 9 - анод
Схематическое изображение электрохимической системы
Слайд 55
Катализ - процесс, заключающийся в изменении
скорости химических реакций в присутствии веществ, называемых катализаторами.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) - при котором она убывает.
Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты.
Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Слайд 56
ВОПРОС №5: Кислотно-основные и
окислительно-восстановительные свойства веществ.
Слайд 57
Любое вещество в определенных условиях может проявлять
свойства
кислоты и основания по отношению к какому-либо
другому веществу,
включая и растворитель.
Слайд 61
Окислительно-восстановительные свойства вещества связаны
с процессом отдачи и
приема электронов атомами, ионами или
молекулами.
Окислитель - это
вещество, которое в ходе реакции
принимает электроны, т. е. восстанавливается, восстановитель -
отдает электроны, т. е. окисляется.
Слайд 62
Окисление - процесс отдачи электронов атомом, молекулой или
ионом.
Атом превращается в положительно заряженный ион:
Zn0 – 2e → Zn2+
Отрицательно заряженный ион становится нейтральным атомом: 2Cl- -2e →Cl20
S2- -2e →S0
Величина положительно заряженного иона (атома) увеличивается соответственно числу отданных электронов:
Fe2+ -1e →Fe3+
Mn+2 -2e →Mn+4
Слайд 63
Восстановление - процесс присоединения электронов атомом,
молекулой или ионом.
Атом превращается в отрицательно заряженный ион
S0 + 2e → S2−
Br0 + e → Br −
Величина положительно заряженного иона (атома)
уменьшается соответственно числу присоединенных электронов:
Mn+7 + 5e → Mn+2
S+6 + 2e → S+4
− или он может перейти в нейтральный атом:
Н+ + е → Н0
Cu2+ + 2e → Cu0
Слайд 64
Восстановители - атомы, молекулы
или
ионы, отдающие электроны. Они в
процессе
ОВР окисляются.
Типичные восстановители:
● атомы металлов с большими атомными радиусами (I-А, II-А группы), а так же Fe, Al, Zn
● простые вещества-неметаллы: водород, углерод, бор;
● отрицательно заряженные ионы: Cl−, Br−, I−, S2−, N−3. Не являются восстановителем фторид- ионы F−.
● ионы металлов в низшей с.о.: Fe2+,Cu+,Mn2+,Cr3+;
● сложные ионы и молекулы, содержащие атомы с промежуточной с.о.: SO32−, NO2−; СО, MnO2 и др.
Слайд 65
Окислители - атомы, молекулы или ионы,
присоединяющие электроны. Они в процессе ОВР восстанавливаются.
Типичные
окислители:
● атомы неметаллов VII-А, VI-А, V-A группы в составе простых веществ
● ионы металлов в высшей с.о.:
Cu2+, Fe3+,Ag+ …
● сложные ионы и молекулы, содержащие атомы с высшей и высокой с.о.: SO42−, NO3−, MnO4−, СlО3−, Cr2O72-, SO3, MnO2 и др.
Слайд 66
Значение окислительно-восстановительных реакций (ОВР)
ОВР чрезвычайно распространены. С ними
связаны процессы обмена веществ в живых организмах, дыхание, гниение,
брожение, фотосинтез. ОВР обеспечивают круговорот веществ в природе. Их можно наблюдать при сгорании топлива, коррозии и выплавке металлов. С их помощью получают щелочи, кислоты и другие ценные химические вещества. ОВР лежат в основе преобразования энергии взаимодействующих химических веществ в эклектическую энергию в аккумуляторах гальванических элементах.
Слайд 67
ВОПРОС №6: Основные процессы, протекающие
в электрохимических системах,
процессы коррозии
и методы борьбы с коррозией.
Слайд 68
Электрохимические процессы
Химические источники тока
- аккумуляторы,
- топливные
элементы
Электрические методы получения различных материалов
- электролиз
- электрофорез
Электрохимия
в медицине
- диагностика
- методы лечения
Электрохимия и биохимия
Электрохимические методы анализа (ИСЭ)
Электрохимическая коррозия
Слайд 69
Коррозия металлов (от латинского corrodere - грызть) –
процессы, происходящие
в результате химического
воздействия окружающей среды, в результате которых
происходит
их разрушение.
Атомы железа под воздействием кислорода, воды и ионов водорода постепенно окисляются (окислителем является, как правило, кислород)
Сущность процесса коррозии
Слайд 70
Химическая
Коррозия бывает двух видов:
Электрохимическая
Слайд 71
Разрушение металла окислением его в окружающей среде при
контакте с газами и электролитами без возникновения электрического тока
в системе
Химическая коррозия
Пример: 4Fe + 3O2 + 2H2О = 2Fe2O3
Слайд 72
Разрушение металла в среде электролита с возникновением внутри
системы электрического тока
Электрохимическая коррозия
Пример: Zn2 + 2ОН = Zn(ОН)2
Слайд 73
Всегда требуется наличие контакта двух металлов и электролита,
как, например, при ржавлении железа во влажной атмосфере
Электрохимическая коррозия
Слайд 74
Коррозия приводит ежегодно к миллиардным убыткам. Основной ущерб
заключается в огромной стоимости изделий, разрушаемых коррозией. Ежегодные потери
от неё в промышленно развитых странах огромны. Истинные убытки от неё нельзя определить, оценив только прямые потери (стоимость разрушившейся конструкции, замены оборудования, затраты на мероприятия по защите от коррозии). Больший ущерб составляют косвенные потери (простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов).
Борьба с коррозией