Слайд 2
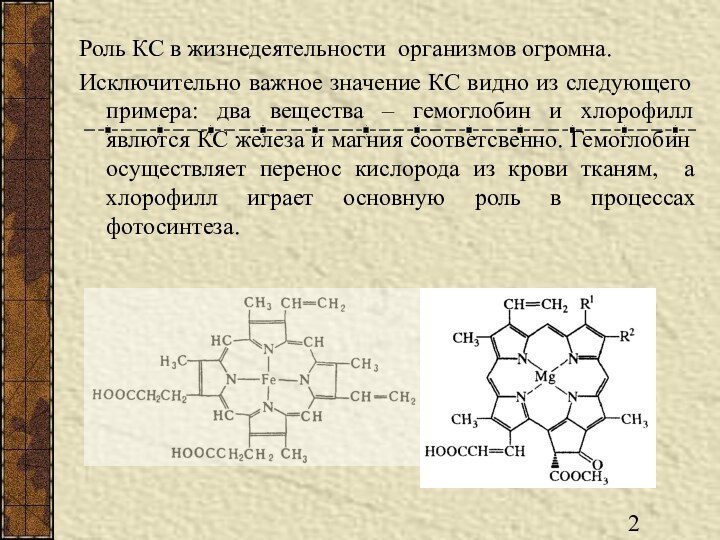
Роль КС в жизнедеятельности организмов огромна.
Исключительно важное
значение КС видно из следующего примера: два вещества –
гемоглобин и хлорофилл явлются КС железа и магния соответсвенно. Гемоглобин осуществляет перенос кислорода из крови тканям, а хлорофилл играет основную роль в процессах фотосинтеза.
Слайд 3
Использование КС в медицине и фармации связано в
осовном применением КС в методах качественного и количественного анализа
– в комплексонометрии.
Широкое применение методы компдексонометрии получили после открытия органических веществ, относящихся к классу аминокарбоновых кислот, которые оказались прекрасными комплексообразователями. Эти соединения были названы комплексонами, а методы объёмного анализа, основанные на их применении, - комплексонометрией.
К наиболее известным комплексонам относятся:
- нитрилотриуксусная кислота (комплексон 1):
N(СН2СООН)3
Слайд 4
- этилендиаминтетрауксусная кислота (комплексон II):
(HOOCCH2)2 N (CH2)2N(CH2COOH)2
- двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА, комплексом III, трилон Б).
На практике обычно применяют хорошо растворимую в воде двунатриевую соль этилендиаминтетрауксусной кислоты (трилон Б). Состав её отвечает формуле Na2C10H14N2. 2H2O (М = 372,24 а.е.м.) или
Слайд 5
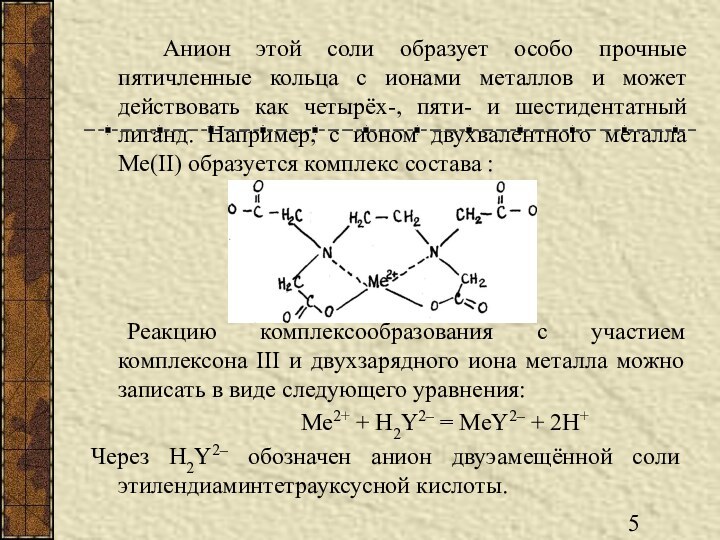
Анион этой соли образует особо прочные пятичленные кольца
с ионами металлов и может действовать как четырёх-, пяти-
и шестидентатный лиганд. Например, с ионом двухвалентного металла Me(II) образуется комплекс состава :
Реакцию комплексообразования с участием комплексона III и двухзарядного иона металла можно записать в виде следующего уравнения:
Me2+ + H2Y2– = MeY2– + 2H+
Через H2Y2– обозначен анион двуэамещённой соли этилендиаминтетрауксусной кислоты.
Слайд 6
Полнота протекания реакции увеличивается при повышении рН раствора
(свзывании ионов Н+ ). В некоторых случаях, однако, при
повышении рН может образоваться гидроксид металла. Поэтому при работе с комплексонами требуется создание оптимального значения рН раствора, зависящего от прочности комплекса и растворимости соответствующего гидроксида.
Титрование большинства катионов проводят при рН 5 - 6 (в присутствии буферной смеси CH3COOH + CH3COONH4) или при рН 8 - 10 (буферная смесь NH4OH + NH4Cl).
Слайд 7
При комплексонометрическом титровании точку эквивалентности устанавливают с помощью
металлохромных индикаторов (металлоиндикаторов). Это сложные органические соединения» образующие окрашенные
комплексы с ионами определяемых металлов, менее устойчивые, чем комплексы тех же ионов с ЭДТА. При добавлении к таким комплексным соединениям металла с индикатором (MeInd) трилона Б (H2Y– ) образуется более прочный комплекс этого металла с последним (MeY2–), а индикатор высвобождается и придаёт раствору соответствующую окраску:
[MeInd] + H2Y2– = [MeY]2– + 2H+ + Ind2–
Слайд 8
Известно много металлоиндикаторов. Некоторые из них универсальны (эриохром
чёрный Т, мурексид), другие специфичны (роданид, сульфосалициловая кислота). Например,
индикатором на ионы магния и цинка может служить эриохром чёрный Т. Это вещество при рН = 7 – 11 образует в растворе анионы синего цвета, которые сокращённо можно записать в виде Ind2–
С ионом магния анион индикатора образует комплекс красного цвета:
Mg2+ + Ind2– + 2H+ = [MeInd]
Слайд 9
Пока индикатор связан в комплекс с магнием, раствор
имеет красный цвет. Однако этот комплекс (КНЕСТ. = 1.10–7)
менее прочен, чем комплекс магния с трилоном Б (КНЕCT. = 2,0.10–9 ). При титровании раствора, содержащего соли магния, трилон Б реагирует сначала со свободными ионами магния, а затем происходит разрушение комплекса [MeInd] и переход окраски в точке эквивалентности из красной в синюю:
[MeInd] + H2Y2– = [MeY]2– + 2H+ + Ind2–
Слайд 10
Если раствор содержит одновременно ионы магния и кальция,
то комплексон III реагирует сначала с Са, так как
ионы кальция образуют более прочный комплекс (Кнест = 2,0.10–11), чем ионы магния. Поэтому с индикатором эриохром чёрный Т можно определять суммарное содержание магния и кальция. Одним из часто применяемых индикаторов на ион кальция является мурексид. Раствор этого индикатора при рН 10 имеет синюю окраску, а комплекс индикатора с кальцием красного цвета.
Рабочими растворами в комплексонометрии служат растворы комплексонов. Комплексом III (трилон Б) обычно применяют в виде 0,05 N или 0,1 N растворов.
Слайд 11
Раствор точной концентрации может быть приготовлен непосредственно из
навески вещества. Чаще, однако, готовят раствор приблизительной концентрации и
устанавливают его концентрацию по стандартному раствору сульфата магния (MgSO4 • 7H2O) .
Для поддержания заданной величины рН раствора в комплексонометрии часто применяют аммиачно-аммонийный буферный раствор, который готовят смешиванием 100 мл 20%-ного раствора хлорида аммония со 100 мл 20%-нoго раствора аммиака с последующим разбавлением смеси водой до одного литра. Этот буферный раствор поддерживает рН в пределах от 9 до 10.
Слайд 12
В настоящее время разработаны кемплексонометрические методы определения более
80 химических элементов. Широкое распространение получила комплексонометрия в медико-биологических
исследованиях. Этот метод необходим для определения в живых организмах кальция, магния и многих микроэлементов. Комплексонометрия применяется в анализе лекарственного сырья, питьевых, минеральных и сточных вод.
В биологии и медицине комплексоны используются не только в аналитических целях, но и в качестве стабилизаторов при хранении крови, так как комплексоны связывают ионы металлов, катализирующие реакции окисления. Комплексоны применяются также для выведения из организма ионов токсичных металлов (Рb2+, Cd2+, Hg2+ и др.) радиоактивных изотопов и продуктов их распада.