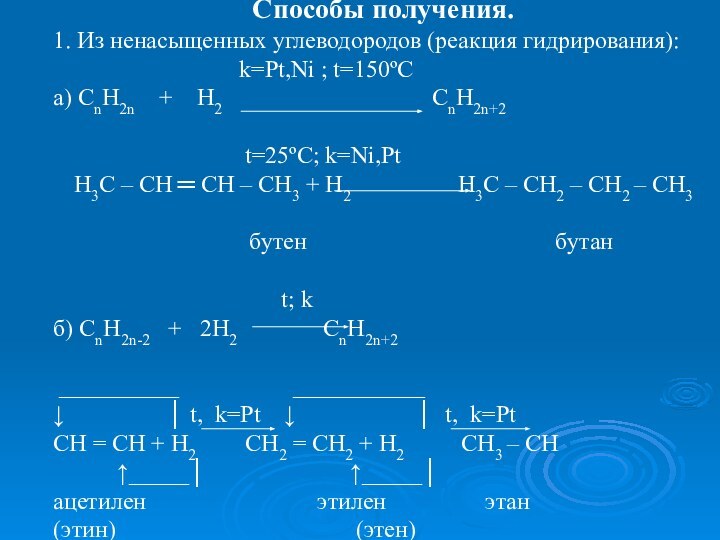
k=Pt,Ni ; t=150ºC
а) CnH2n + H2 CnH2n+2
t=25ºC; k=Ni,Pt
Н3С – СН ═ СН – СН3 + Н2 Н3С – СН2 – СН2 – СН3
бутен бутан
t; k
б) СnH2n-2 + 2H2 CnH2n+2
__________ ___________
↓ │ t, k=Pt ↓ │ t, k=Pt
CH = CH + H2 CH2 = CH2 + H2 CH3 – CH
↑_____│ ↑_____│
ацетилен этилен этан
(этин) (этен)