- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Получение солей
Содержание
- 2. Свойства солейНекоторые физические свойства: все соли –
- 3. По растворимости в воде1) растворимые. Это соли
- 4. 2) малорастворимыеAgCl,CuCl,Hg2Cl2,PbCl2
- 5. 3) Нерастворимые все сульфиды, карбонаты, сульфиты, силикаты,
- 6. Химические свойства средних солей1. Соль1+кислота1соль2+кислота2Ряд кислот: HNO3,
- 7. Закончить уравненияNa2SiO3+HCl …; Na2CO3+ H2SO4 …; CuS+ H2SO4(p)…
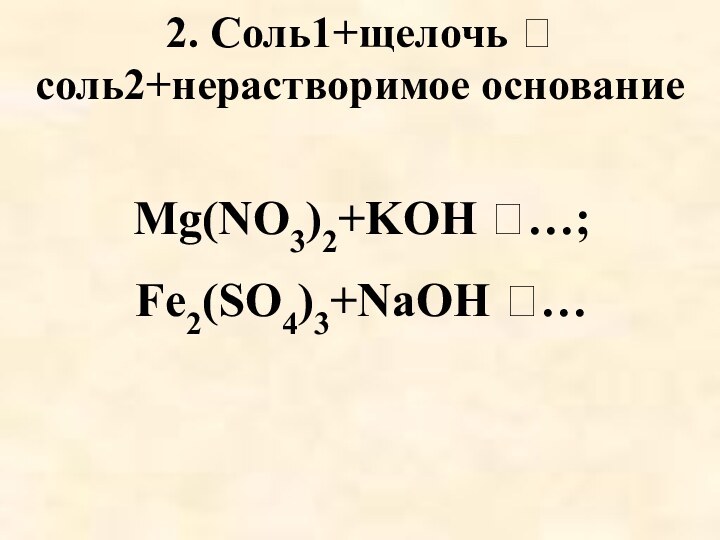
- 8. 2. Соль1+щелочь соль2+нерастворимое основание Mg(NO3)2+KOH …; Fe2(SO4)3+NaOH …
- 9. 3. соль1+металл1 соль2+металл2CuSO4+Zn …; Hg(NO3)2+Cu …Каждый левостоящий металл вытесняет из соли правостоящий.
- 10. 4. Соль1+соль2 соль3+соль4AgNO3+NaCl …; CuSO4+BaCl2 …
- 11. Получение солей Средние соли.Металл+неметалл: 2Fe+3Cl22FeCl3
- 12. 2. Металл+кислота соль +водород: Mg+2HCl MgCl2+H2
- 13. 3. Металл+сольZn+CuSO4 Cu+ZnSO4
- 14. 4. Основной оксид+ кислотный оксидCaO+CO2 CaCO3
- 15. 5. Основной оксид+кислотаCuO+H2SO4 CuSO4+H2O
- 16. 6. Основание+кислотный оксидBa(OH)2+N2O5 Ba(NO3)2+2H2O
- 17. 7. Основание+кислота.Fe(OH)3+3HCl FeCl3+3H2O
- 18. 8. Щелочь+соль 2NaOH+Mg(NO3)2 2NaNO3+Mg(OH)2
- 19. 9. Соль+кислота CaCO3+2HCl CaCl2+CO2+H2O
- 20. 10. Соль1+соль2 Na2SO4+AgNO3 2NaNO3+Ag2SO4
- 21. При написании уравнений реакций следует помнить1) Реакция
- 22. продолжение2) Водород из кислот (кроме азотной и
- 23. продолжение3) Каждый левостоящий металл (в ряду напряжений) может вытеснять правостоящий из раствора его соли
- 24. Получение кислых солейНеполная нейтрализация кислоты основанием .
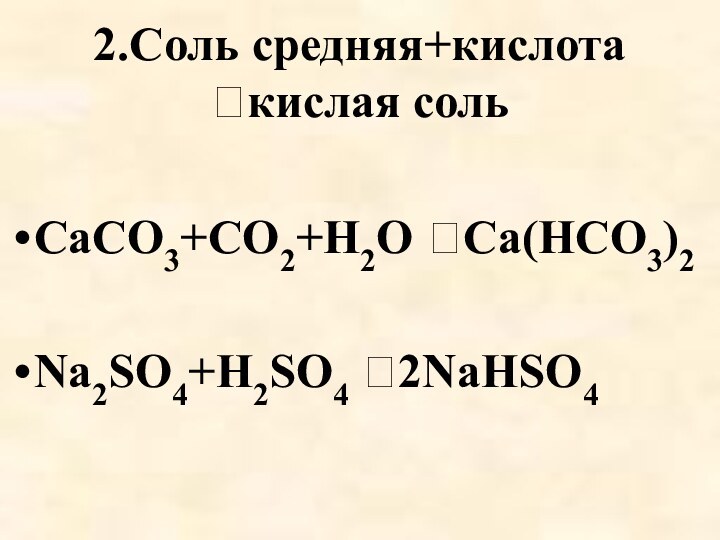
- 25. 2.Соль средняя+кислота кислая сольCaCO3+CO2+H2O Ca(HCO3)2Na2SO4+H2SO4 2NaHSO4
- 26. Получение основных солейНеполная нейтрализация основания кислотой (избыток основания+недостаток кислоты основная соль).Fe(OH)3+HCl Fe(OH)2ClFe(OH)3+2HCl FeOHCl+2H2O
- 27. 2. Средняя соль1+щелочь основная соль+средняя соль2 FeCl2+KOH FeOHCl+KCl
- 28. 3. Средняя соль+одноименное основание основная соль CaSO4+Cа(OH)2 (CaOH)2SO4
- 29. Взаимосвязь средних, кислых, основных солейКислая соль+основаниесредняя соль+водаNaHSO3+NaOHNa2SO4+H2OKH2PO4+2KOHK3PO4+2H2O
- 30. Основная соль+кислота средняя соль+вода CaOHNO3+HNO3Ca(NO3)2+H2OCr(OH)2Cl+2HClCrCl3+2H2O
- 31. Осуществить цепочку превращенийFeFeOFeSO4Fe(OH)2Fe(OH)ClFeCl22Fe+O22FeO; 2) FeO+H2SO4FeSO4+H2O;
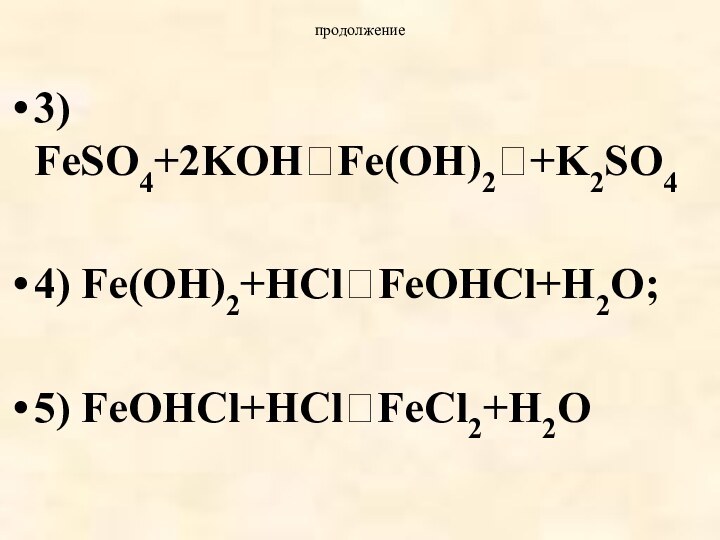
- 32. продолжение3) FeSO4+2KOHFe(OH)2+K2SO44) Fe(OH)2+HClFeOHCl+H2O; 5) FeOHCl+HClFeCl2+H2O
- 33. Скачать презентацию
- 34. Похожие презентации
Свойства солейНекоторые физические свойства: все соли – твердые кристаллические вещества.Соли имеют различную окраску. Каждая индивидуальная соль характеризуется строго определенными физическими константами (например температура плавления)






























Слайд 3
По растворимости в воде
1) растворимые.
Это соли щелочных
металлов, соли аммония, нитраты и ацетаты, сульфиды бария и
магния
Слайд 5
3) Нерастворимые
все сульфиды, карбонаты, сульфиты, силикаты, фосфаты
(кроме солей аммония, щелочных металлов, сульфидов магния и бария)
Слайд 6
Химические свойства средних солей
1. Соль1+кислота1соль2+кислота2
Ряд кислот: HNO3, H2SO4,
HCl, H3PO4, H2SO3, H2CO3,H2S, H2SiO3
каждая предыдущая кислота вытесняет
из соли следующую





























