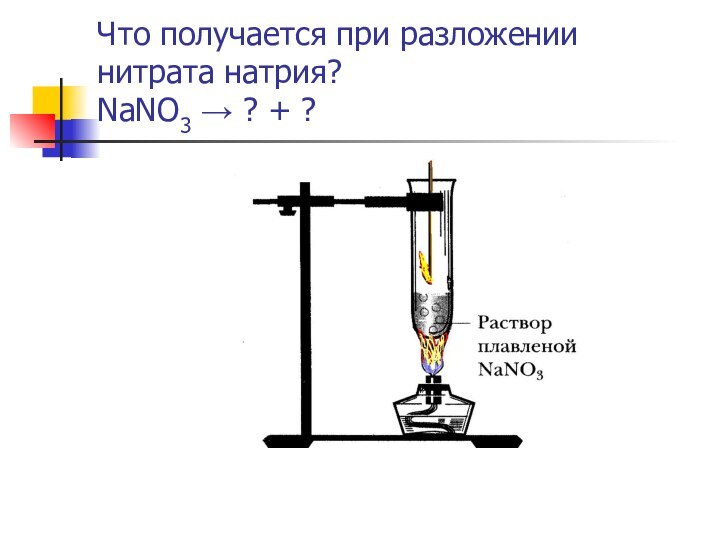
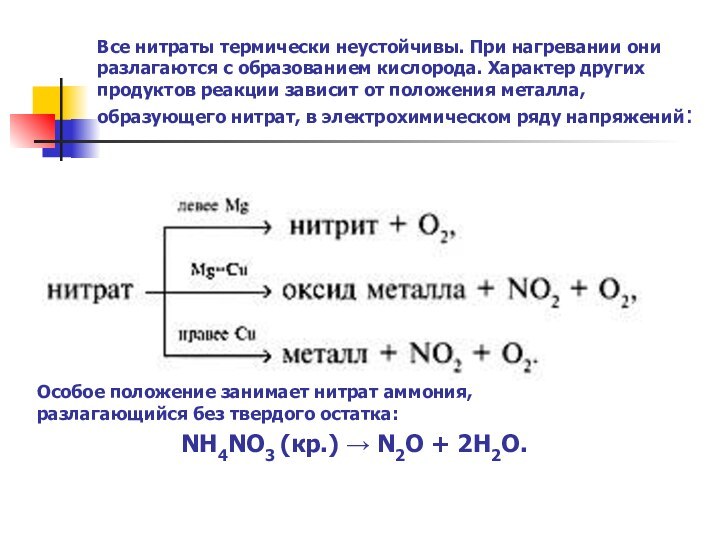
какие свойства окислительные или и восстановительные характерны для них;
определять:
степень окисления химических элементов в формулах солей; типы химических реакций, в которых они могут участвовать;характеризовать: общие химические свойства солей азотной кислоты;