инертного газа!
Нужно отдать электрон – ты донор, как правило,
металлНужен электрон – ты акцептор, как правило, неметалл
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

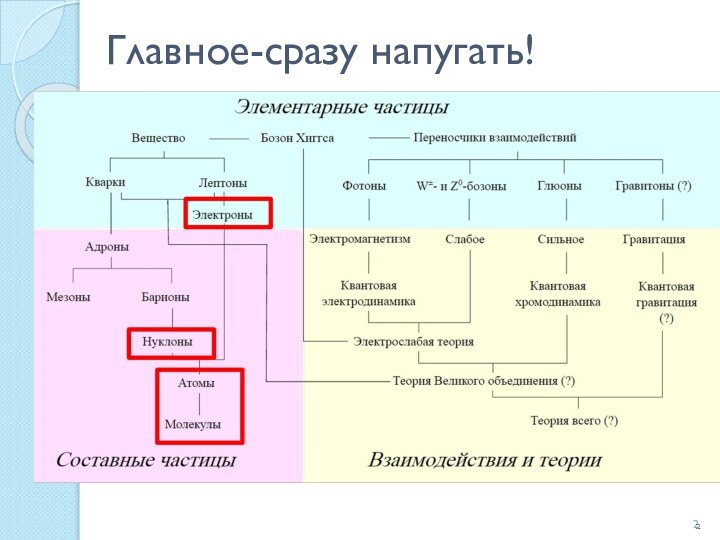




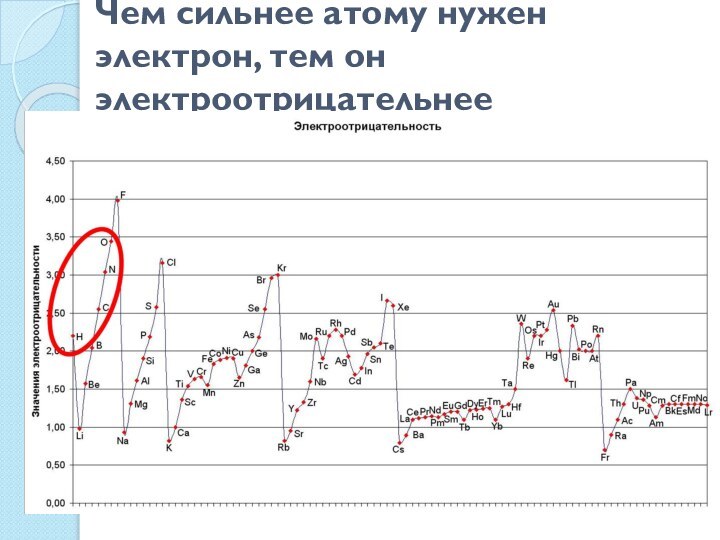

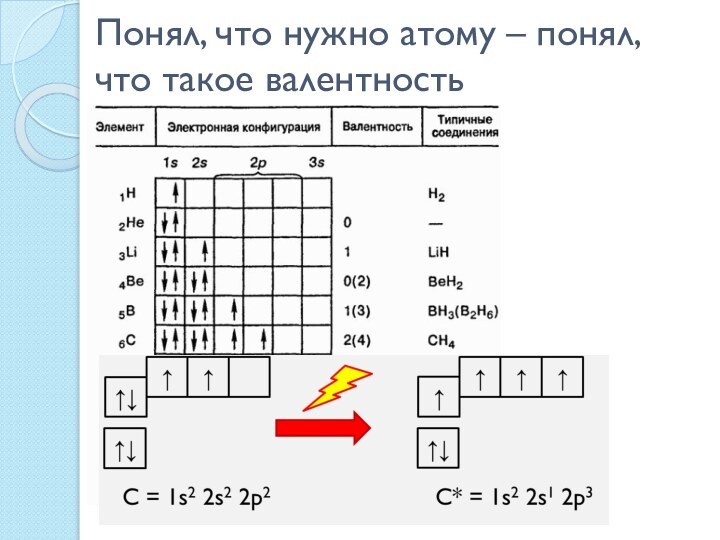













Аммиак
NH3+H2O ↔ NH4OH ↔ NH4+ + HO-