- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему галогены 9 класс
Содержание
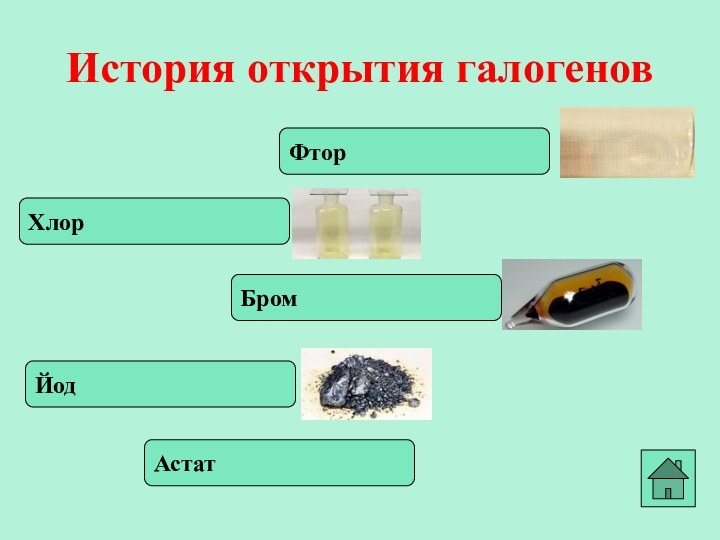
- 2. Объединены под общим названием галогенные вещества. Фтор, хлор, бром, йод, астат.
- 3. ФторИстория открытия галогеновХлорБромЙодАстат
- 5. В 1774
- 6. В 1825
- 7. В 1811
- 8. В
- 9. Существуют только в связанном состоянии.
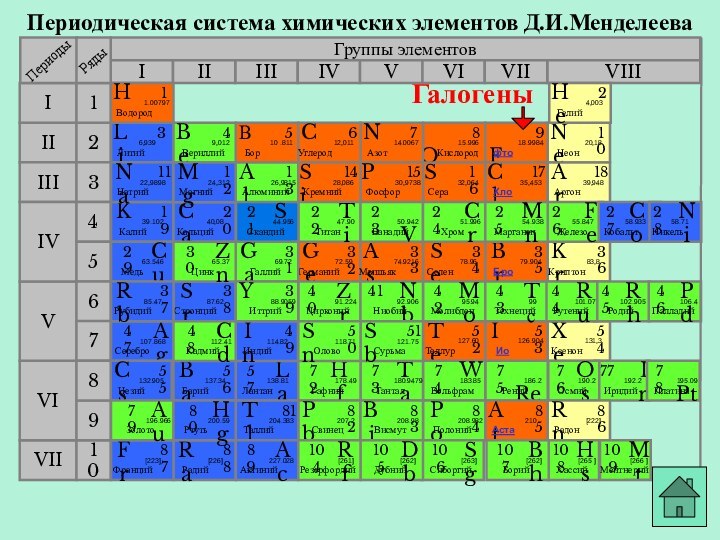
- 10. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456710 Fфтор918.9984BrБром3579.904IИод53126.904ClХлор1735,453AtАстат8521098Галогены
- 11. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798F 19 9 0 10
- 12. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798Cl 35 17 0 10
- 13. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798Br 80 35 0 10
- 14. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798I 127 53 0 10
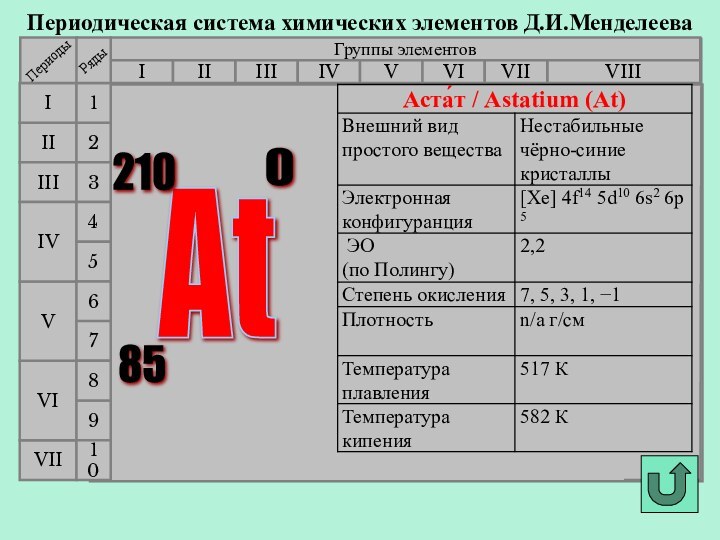
- 15. Периодическая система химических элементов Д.И.МенделееваГруппы элементовIIIIIIVIIIIVVVIVIIIIIIIIVIIVIVIV213456798At 210 85 0 10
- 16. Химические свойства 45 F2 -наиболее реакционноспособен
- 17. Химические свойства 45 F2 -наиболее реакционноспособен
- 18. Химические свойства Cl2 - сильно реакционноспособен
- 19. Химические свойства Cl2 - сильно реакционноспособен
- 20. Химические свойства Br2 - реакционноспособен
- 21. Химические свойства Br2 - реакционноспособен
- 22. Химические свойства I2 - химически наименее
- 23. Химические свойства I2 - химически наименее
- 24. Биологические значение галогенов И их применение.
- 25. Фтор содержится в зубной пасте, которая защищает от кариеса.
- 26. Хлор попадает в организм в виде NaCl
- 27. Бром. Его соединения регулируют процессы нервной системы.
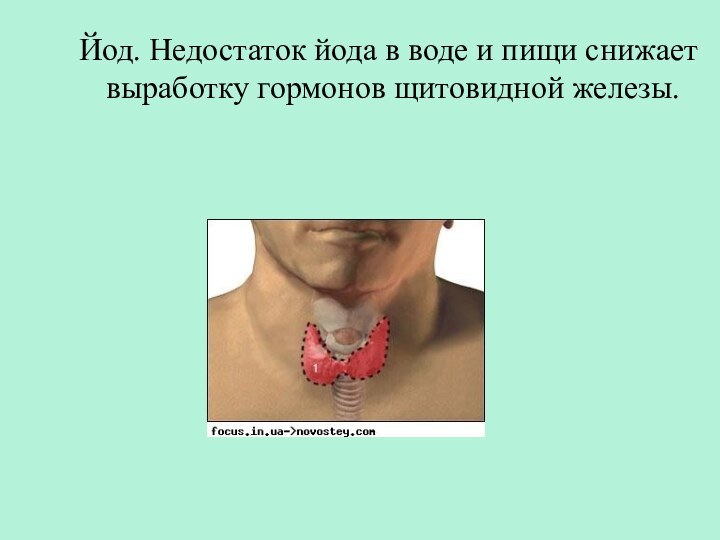
- 28. Йод. Недостаток йода в воде и пищи снижает выработку гормонов щитовидной железы.
- 29. Йод поступает в организм вместе с пищей:
- 30. Применение фтораТефлон ФреонОкислитель ракетного топливаЗаменитель кровиФториды
- 31. Применение хлораОтбеливателиПроизводство HClПолучение
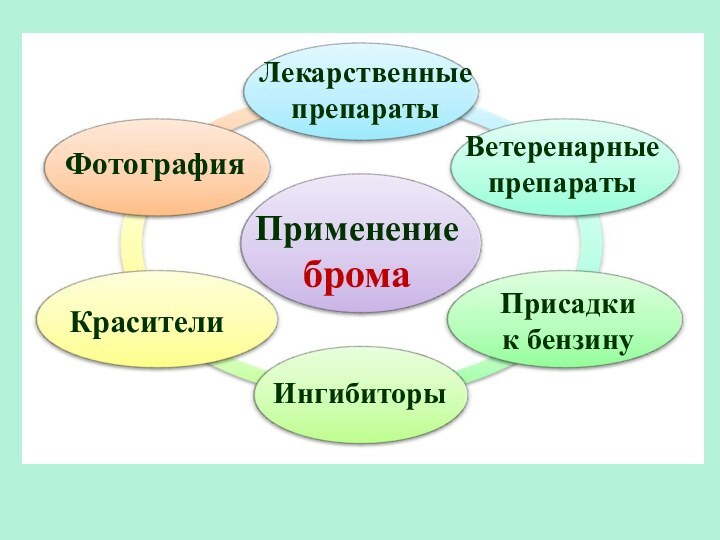
- 32. Применение бромаЛекарственные препаратыКрасители ФотографияВетеренарные препаратыИнгибиторыПрисадки
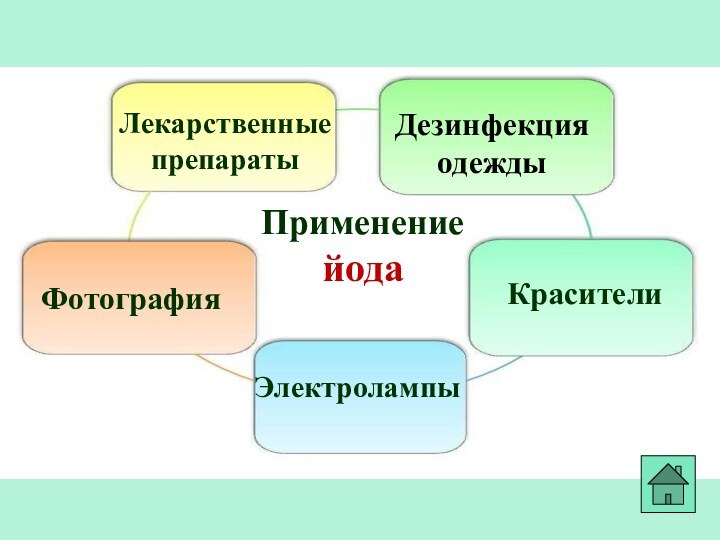
- 33. Применение йодаЛекарственные препаратыФотографияКрасителиДезинфекция одеждыЭлектролампы
- 34. В промышленности фтор и хлор получают электролизом
- 35. Физические свойства галогенов Заполни пропускиФтор -
- 36. Химические свойства галогенов Поставь коэффициенты
- 37. Скачать презентацию
- 38. Похожие презентации




























Слайд 4 В
1886 году французский химик А. Муассан, используя электролиз жидкого
фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.История открытия фтора
Анри Муассан
(1852 – 1907)
Слайд 5 В 1774 году
шведский ученый К. Шееле открыл хлор, который принял за
сложное вещество и назвал "дефлогистированной соляной кислотой".В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
История открытия хлора
Карл Вильгельм Шееле
(1742 – 1786)
Слайд 6 В 1825 году
французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую
жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный").История открытия брома
Антуан Жером Балар
(1802 – 1876)
Слайд 7 В 1811 году
французский химик Бернар Куртуа открыл иод путём перегонки
маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне.В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).
История открытия йода
Бернар Куртуа (1777 – 1838 )
Слайд 8 В 1869
г Д.И.Мендеелеев предсказал его существование и возможность открытия в
будущем (как «эка-иод»).Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211At они облучали висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
История открытия астата
Слайд 10
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
F
фтор
9
18.9984
Br
Бром
35
79.904
I
Иод
53
126.904
Cl
Хлор
17
35,453
At
Астат
85
210
9
8
Галогены
Слайд 11
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
F
19
9
0
10
Слайд 12
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Cl
35
17
0
10
Слайд 13
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Br
80
35
0
10
Слайд 14
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
I
127
53
0
10
Слайд 15
Периодическая система химических элементов Д.И.Менделеева
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
At
210
85
0
10
Слайд 16 Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут
на холоду, при нагревании – даже с участием Au,
Pt.
С простыми веществами:
С металлами С неметаллами
Na + F2 → H2 + F2 →
Mo + F2 → Xe + F2 →
Со сложными веществами:
H2O + F2 →
KCl + F2 →
KBr + F2 →
KI + F2 →
Проверить
Слайд 17 Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут
на холоду, при нагревании – даже с участием Au,
Pt.
С простыми веществами:
С металлами С неметаллами
2Na + F2 → 2NaF H2 + F2 → 2HF
Mo + 3F2 → MoF6 Xe + 2F2 → XeF4
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI + F2 → I2 + 2КF
Слайд 18 Химические свойства Cl2 - сильно реакционноспособен (искл. C,
O2, N2 и некот. др.)
С простыми веществами:
С металлами С неметаллами
Fe + Cl2 → H2 + Cl2 →
Cu + Cl2 → P + Cl2 →
Со сложными веществами:
H2O + Cl2 →
NaOH + Cl2 →
KBr + Cl2 →
KI + Cl2 →
Проверить
Горение железа в хлоре
Слайд 19 Химические свойства Cl2 - сильно реакционноспособен (искл. C,
O2, N2 и некот. др.)
С простыми веществами:
С металлами С неметаллами
2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
Слайд 20
Химические свойства
Br2 - реакционноспособен
С простыми веществами:
С металлами С неметаллами
Al + Br2 → H2 + Br2 →
Cu + Br2 → P + Br2 →
Со сложными веществами:
Br2 + H2O →
KI + Br2 →
Проверить
Слайд 21
Химические свойства
Br2 - реакционноспособен
С простыми веществами:
С металлами С неметаллами
2Al + 3Br2 → 2AlBr3 H2 + Br2 → 2HCl
Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO бромная вода
2KI + Br2 → I2 + 2КCl
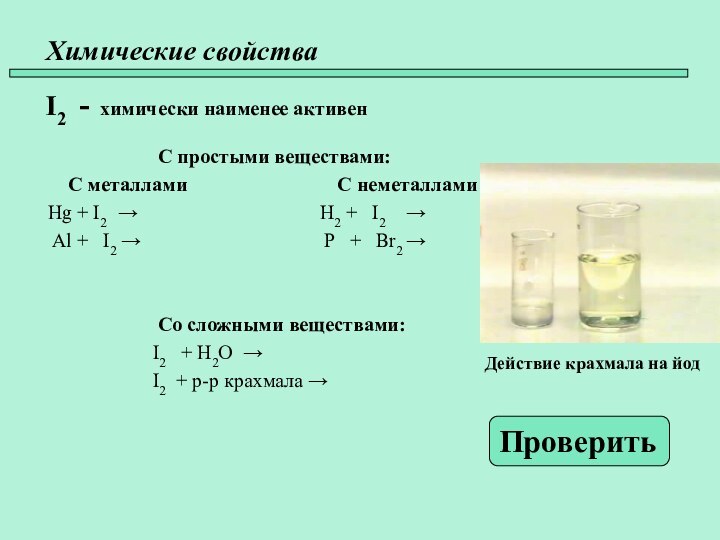
Слайд 22
Химические свойства
I2 - химически наименее активен
С простыми веществами:
С металлами С неметаллами
Hg + I2 → H2 + I2 →
Al + I2 → P + Br2 →
Со сложными веществами:
I2 + H2O →
I2 + р-р крахмала →
Проверить
Действие крахмала на йод
Слайд 23
Химические свойства
I2 - химически наименее активен
С простыми веществами:
С металлами С неметаллами
Hg + I2 → HgI2 H2 + I2 → 2HCl (tº)
2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO
I2 + р-р крахмала → темно-синее окрашивание
Слайд 26 Хлор попадает в организм в виде NaCl стимулирует
обмен веществ, рост волос, придаёт силу и бодрость
Слайд 27 Бром. Его соединения регулируют процессы нервной системы. Бром
активно накапливают растения, в том числе водоросли. Главным поставщиком
брома является море.Слайд 29 Йод поступает в организм вместе с пищей: хлебом,
яйцом, молоком, водой, с морской капустой и с воздухом.
.
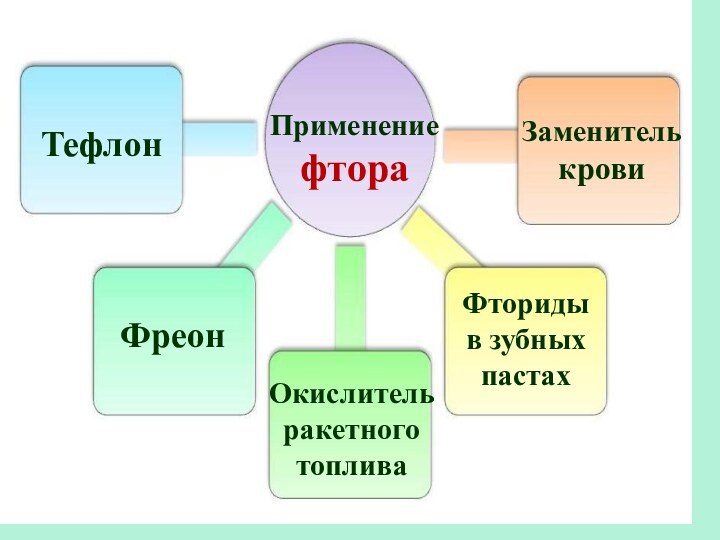
Слайд 30
Применение фтора
Тефлон
Фреон
Окислитель ракетного топлива
Заменитель крови
Фториды
в зубных пастах
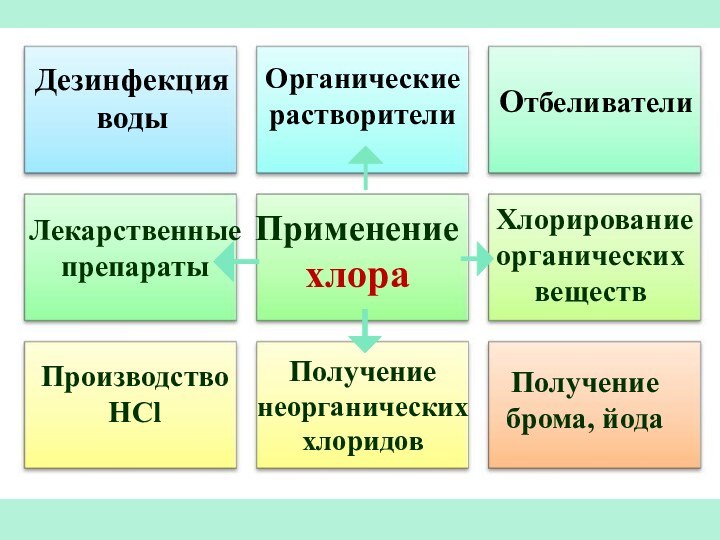
Слайд 31
Применение хлора
Отбеливатели
Производство
HCl
Получение
брома, йода
Дезинфекция воды
Органические растворители
Лекарственные препараты
Хлорирование органических
веществПолучение неорганических хлоридов
Слайд 32
Применение брома
Лекарственные препараты
Красители
Фотография
Ветеренарные препараты
Ингибиторы
Присадки
к бензину
Слайд 34 В промышленности фтор и хлор получают электролизом расплавов
и растворов их солей. Бор и йод получают в
промышленности по реакции вытеснения их хлором.
Слайд 35
Физические свойства галогенов
Заполни пропуски
Фтор -
, в воде , так как интенсивно с ней взаимодействует. Хлор - , раствор хлора в воде практически бесцветен - . Бром - . Йод - с с металлическим блеском. Кристаллический йод легко - переходит из твердого в газообразное состояние. Астат похож на , но имеет более ярко выраженный металлический характер. Все галогены обладают запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые .
черно-фиолетовые кристаллы
не растворим
светло-желтый газ
хлорная вода
желто-зеленый газ
бурая жидкость
йод
резким
отравления
Слайд 36
Химические свойства галогенов
Поставь коэффициенты
Na +
Cl2 = NaCl S +
F2 = SF6 Fe + Br2= FeBr3 P + Cl2 = PCl5 NaI + Cl2 = NaCl + I2 F2 + H2O = HF + O2 NaBr + Cl2 = NaCl + Br2 KOH + Cl2 = KCl + KClO3 + H2O2
2
2
4
2
3
5
3
2
2
2
2
2
2
3
2
3
5
2
6