- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку химии Великий закон 11 класс
Содержание
- 2. Великий законПериодический закон и периодическая система химических элементов в свете учения о строении атома
- 3. ЦельРассмотреть на примере открытия Периодического закона основные
- 4. Проблемные вопросыВсе учёные, которые занимались поисками естественной
- 5. В 1906 г. Нобелевский комитет в
- 6. В 1882 году Лондонское Королевское общество присудило
- 7. «В честь величайшего русского химика группа американских
- 8. Где предел числа элементов?
- 9. Предпосылки открытия Периодического закона
- 10. Работы предшественников Д.И. МенделееваКлассификация БерцелиусаТриады ДеберейнераОктавы НьюлендсаСпираль – ось Кривая Майера
- 12. Открытие Менделеевым Периодического закона Известные
- 14. «Свойства химических элементов и образованных ими
- 15. Периодическая система и строение атомаКаждое обозначение в
- 16. «Периодическому закону будущее не грозит разрушением, а
- 17. Как оправдались предсказания Менделеева.
- 18. Названия элементов Так как открытие элементов
- 19. Ru - рутений № 44 открыт в
- 20. Предел числа элементов Наметить предел
- 21. Скачать презентацию
- 22. Похожие презентации
Великий законПериодический закон и периодическая система химических элементов в свете учения о строении атома



















Слайд 2
Великий закон
Периодический закон и периодическая система химических элементов
в свете учения о строении атома
Слайд 3
Цель
Рассмотреть на примере открытия Периодического закона основные этапы
становления научной теории: предпосылки, формулирование обобщения, её дальнейшее развитие.
Слайд 4
Проблемные вопросы
Все учёные, которые занимались поисками естественной классификации
химических элементов, находились в равных условиях, имели одни и
те же предпосылки. Почему же ни одному из них, кроме Д. И. Менделеева не удалось открыть Периодический закон? Предпосылки открытия Периодического закона
Слайд 5
В 1906 г. Нобелевский комитет в Стокгольме
рассматривал две кандидатуры на соискание одноимённой премии: Анри Муассана,
которого выдвинула Академия наук Франции, и Д.И. Менделеева, которого выдвинула Академия наук Германии. Кому и почему была вручена Нобелевская премия?Слайд 6 В 1882 году Лондонское Королевское общество присудило Д.И.
Менделееву медаль Деви «за открытие периодических соотношений атомных весов»,
а пятью годами позже, в 1887 г., это же общество вручает эту же медаль своему соотечественнику Дж. Ньюлендсу «за открытие периодического закона химических элементов». Чем объяснить такую нелогичность в решениях Лондонского Королевского общества?
Слайд 7
«В честь величайшего русского химика группа американских химиков
во главе с Т. Сиборгом в 1955 г. получила
новый, 101 элемент, которому единодушно присвоила название «менделевий».Есть ли ещё в периодической системе элементы, связанные своими названиями с нашей Родиной – Россией?
Слайд 9
Предпосылки открытия Периодического закона
- Накопление фактологического материала
- Участие Д.И. Менделеева в Международном химическом конгрессе в г. Калсруэ (1860), где утвердились идеи атомистики и понятие «атомный вес», которое сейчас известно под названием «относительная атомная масса (Аr)»
Слайд 10
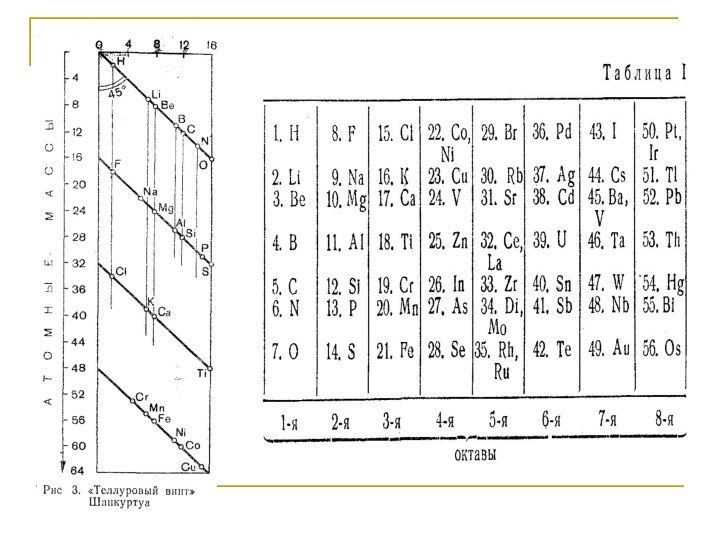
Работы предшественников Д.И. Менделеева
Классификация Берцелиуса
Триады Деберейнера
Октавы Ньюлендса
Спираль –
ось Кривая Майера
Слайд 12
Открытие Менделеевым Периодического закона
Известные в
то время 63 химических элемента расположены по возрастанию их
атомных весов, свойства изменяются сходным образом, а именно:металлические свойства ослабевали,
неметаллические свойства усиливались,
степень окисления элементов в высших оксидах увеличивалась с +1 до +7 (+8),
с.о. элементов в гидроксидах, в твёрдых солеподобных соединениях металлов с водородом возрастала с +1 до +3, а затем возрастала в летучих водородных соединениях с -4 до -1,
оксиды от основных через амфотерные сменялись кислотными,
гидроксиды от щелочей через амфотерные сменялись кислотами.
Слайд 14
«Свойства химических элементов и образованных ими веществ
находятся в периодической зависимости от их относительных атомных масс»
(1 марта 1869г.)Современная формулировка ПЗ:
«Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер»
Слайд 15
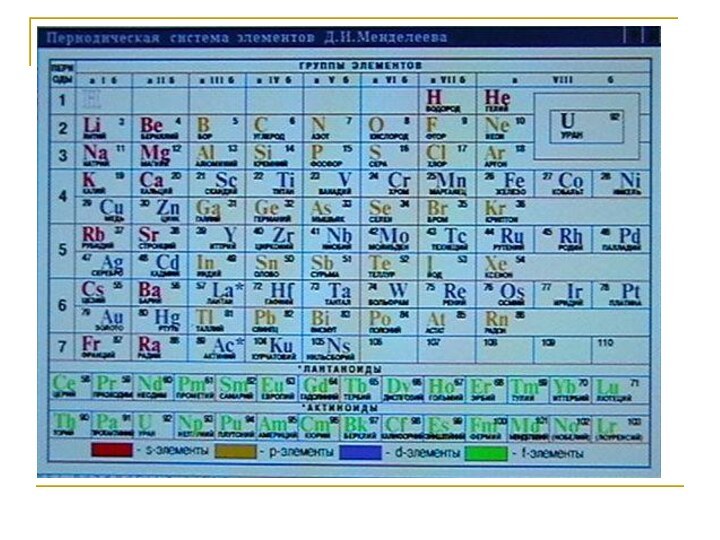
Периодическая система и строение атома
Каждое обозначение в ПС
отражает какую либо особенность или закономерность в строении атома:
№
элемента – заряд ядра атома, число электронов, протонов,№ периода – количество электронных слоёв (уровней),
№ группы – число электронов на внешнем слое.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические - усиливаются, т.к.
увеличиваются заряды атомных ядер, растёт число электронов на внешнем слое, радиус атома уменьшается, число энергетических уровней постоянно
В пределах одной и той же группы( в главной подгруппе) металлические свойства усиливаются, неметаллические ослабевают, т. к.
- увеличивается заряд ядра атома, растёт число энергетических уровней, увеличивается радиус атома, число электронов на внешнем слое постоянно
Слайд 16 «Периодическому закону будущее не грозит разрушением, а только
надстройки и развитие обещает..»
(10 июля 1905г.) ПЗ и ПС позволили:
установить взаимную связь между элементами и объединить их по свойствам;
расположить элементы в естественной последовательности;
вскрыть периодичность, т.е. повторяемость общих свойств отдельных элементов и их соединений;
исправить и уточнить Аr отдельных элементов (у Ве с 13 на 9);
предсказать и описать свойства, указать путь открытия ещё неоткрытых элементов.
Слайд 17
Как оправдались предсказания Менделеева.
Не
прошло и шести лет, как весь мир облетело известие:
в 1875 г. молодой французский учёный П. Лекок де Буабодран выделил из минерала, добытого в Пиренейских горах, новый элемент. В честь своей родины, которая в древности называлась Галлией, Буабодран назвал новый элемент галлием. Он подробно описал его плотность, температуру плавления, соединение с кислородом, и даже соли. Каково же было его удивление, когда он через Парижскую академию наук он получил письмо с русской маркой, в котором сообщалось: в описании свойств всё верно, за исключением плотности. Менделеев, не видя галлия, оказался прав.Через 4 года, в 1879 г. Шведский химик Л. Нильсон нашёл новый элемент – скандий. Когда изучили его свойства, стало совершенно очевидно, что это давно известный, по предсказаниям Менделеева, экабор.
А через 16 лет после предсказания Менделеева немецкий химик К. Винклер открыл новый элемент и назвал его германием. Винклер не искал германия по приметам, опубликованным Менделеевым, он наткнулся на него случайно и отметил, что германий соответствует экасилицию Менделеева.
Слайд 18
Названия элементов
Так как открытие элементов происходило
на протяжении многих веков стихийно, то ждать какого-то единообразия
в названиях не приходилось. Право давать название элементу обычно принадлежало автору открытия.Все существующие названия элементов можно разбить на следующие группы:
1) названия в честь учёных,
2) названия географического происхождения ( по названиям материков, стран, областей, островов, городов, рек)
3) названия астрономического происхождения, по названию планет,
4) названия мифологического происхождения в честь богов и героев,
5) названия по их обнаруженным свойствам,
6) названия по рудам и веществам, из которых получены или которые образуют,
7) названия, связанные с историей открытия,
8) древние названия, не выясненные или спорные.
Слайд 19 Ru - рутений № 44 открыт в 1844
г. русским учёным К.К. Клауссом, назван в честь России.
Md
– менделевий № 101 искусственно получен американским учёным Г. Сиборгом и др. в 1955, назван в честь Д.И. Менделеева.Db – дубний № 104 искусственно получен в г. Дубне группой советских учёных под руководством И.И. Звары, назван в честь г. Дубны и Дубнинской лаборатории