- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Применение аммиака
Содержание
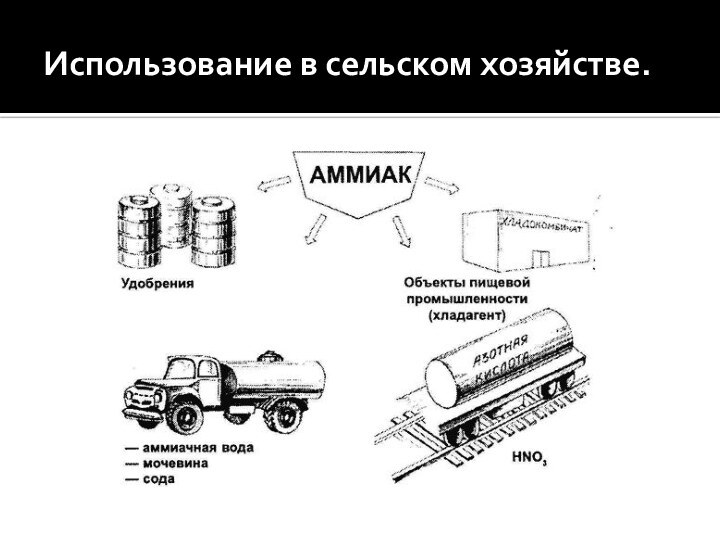
- 2. Использование в сельском хозяйстве.
- 3. Использование Мировое производство аммиака составило в 1980
- 4. Как можно получить аммиакАммиак можно получить нагреванием
- 5. Строение молекулы аммиакаМолекула аммиака имеет форму тригональной
- 6. Жидкий аммиакЖидкий аммиак, хотя и в незначительной
- 7. ПроизводствоНа производство одной тонны аммиака расходуется в
- 8. Скачать презентацию
- 9. Похожие презентации
Использование в сельском хозяйстве.






Слайд 4
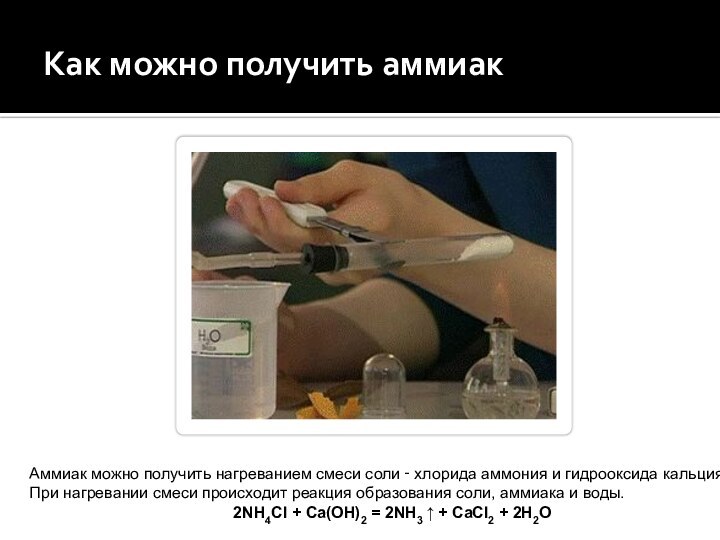
Как можно получить аммиак
Аммиак можно получить нагреванием смеси
соли ‑ хлорида аммония и гидрооксида кальция.
При нагревании
смеси происходит реакция образования соли, аммиака и воды.2NH4Cl + Ca(OH)2 = 2NH3 ↑ + CaCl2 + 2H2O
Слайд 5
Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды
с атомом азота в вершине.
Три неспаренных p-электрона атома азота
участвуют в образовании полярных ковалентных связейс 1s
электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является
неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион
Аммония NH4+.
Слайд 6
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени,
диссоциирует на ионы (автопротолиз), в чём проявлется его сходство
с водой:Растворенный в NH3 металл постепенно реагирует с образованием амида:
Слайд 7
Производство
На производство одной тонны аммиака расходуется в среднем
1200 нм³ природного
газа, в Европе — 900 нм³.
Белорусский «Гродно Азот»
расходует 1200 нм³ природного газа на тонну аммиака, послемодернизации ожидается снижение расхода до 876 нм³.
Украинские производители потребляют от 750 нм³ до 1170 нм³ природного газа на тонну
аммиака.
По технологии UHDE заявляется потребление 6,7 — 7,4 Гкал энергоресурсов на тонну аммиака.
Для осушения аммиака его пропускают через смесь извести с едким натром.
+