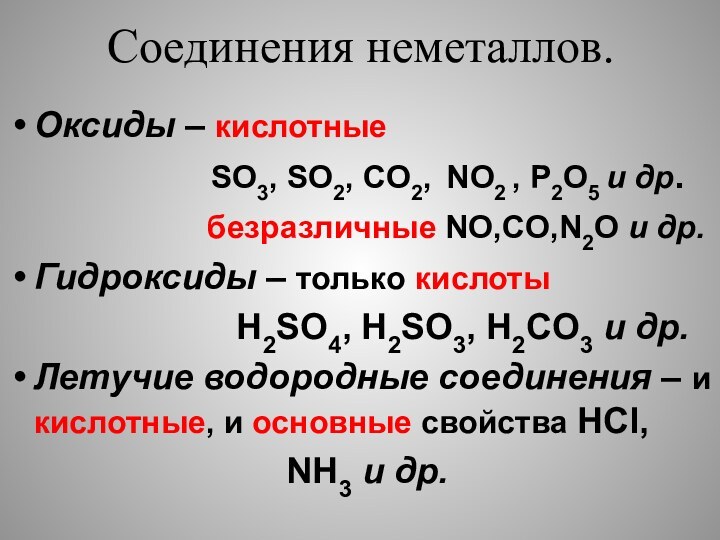
свойства как окислительные ( принимают электроны), так и восстановительные
(отдают электроны).Исключения : фтор – только окислитель,
инертные газы – могут быть только восстановителями.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть