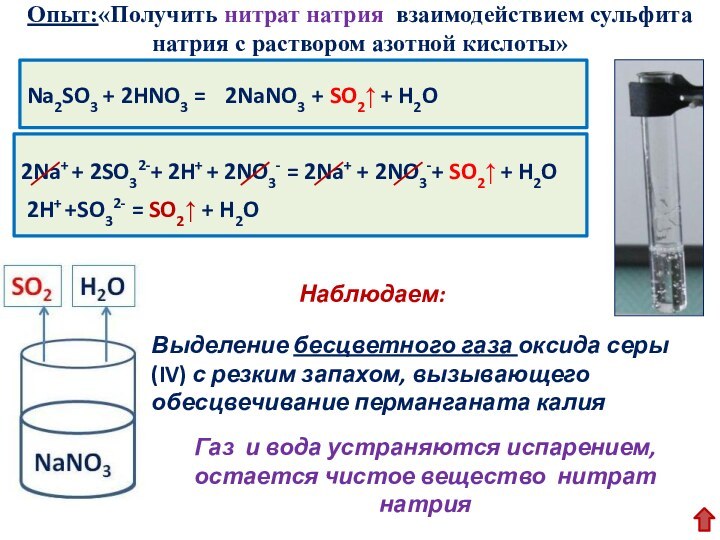
протекают до конца, а какие не протекают и почему.
Для
получения веществ проведём реакции ионного обменаПолучение осадка
Получение растворимых солей, кислот, оснований
Получение газообразного вещества
Получение слабого электролита
Вывод
Оборудование Источники