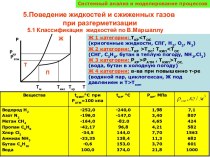
некоторых веществ. Добавляемые вещества не участвуют в реакции и
не расходуются в ходе ее протекания, но оказывают существенное влияние на скорость реакции. Эти вещества изменяют механизм реакции (в том числе состав активированного комплекса) и понижают энергию активации, что обеспечивает ускорение химических реакций. Вещества – ускорители реакций называют катализаторами, а само явление такого ускорения реакции – катализом.Многие реакции в отсутствие катализаторов протекают очень медленно или не протекают совсем. Одной из таких реакций является разложение пероксида водорода:
2Н2О2 = 2Н2О + О2.
Если опустить в сосуд с водным раствором пероксида водорода кусочек твердого диоксида марганца, то начнется бурное выделение кислорода. После удаления диоксида марганца реакция практически прекращается. Путем взвешивания нетрудно убедиться, что диоксид марганца в данном процессе не расходуется – он лишь катализирует реакцию.