- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочноземельные металлы
Содержание
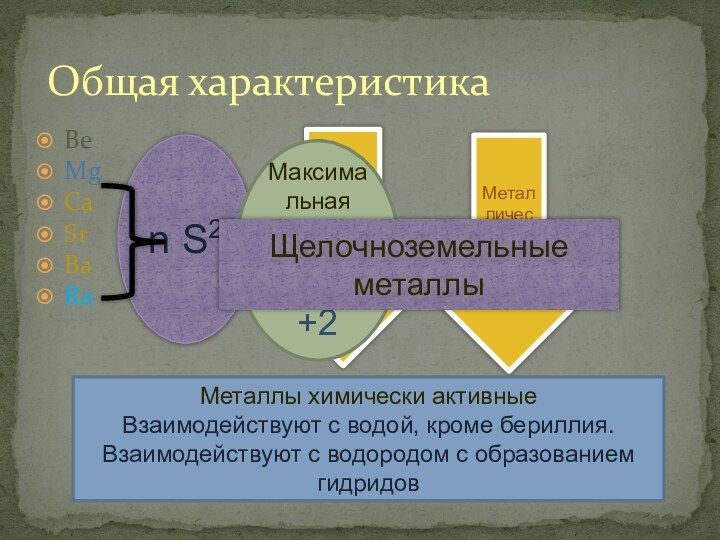
- 2. BeMgCaSrBaRaОбщая характеристикаРадиус атомаМеталлические свойстваn S2Максимальная степень окисления
- 3. Бериллий сходствует с алюминием и магнием…Получил своё
- 4. Распространение в природеБерилл 3Be * Al2O3 *6SiO2ХризобериллBeAl2O4ИзумрудАквамаринАлександритаквамариналександритизумрудКажется,
- 5. В виде простого вещества бериллий получили в
- 6. BeF2+Mg=Be+MgF2
- 7. BeМеталл светло-серого цвета, покрытый тончайшей оксидной плёнкойТугоплав-кий
- 8. Обладая высокой химической активностью бериллий вступает в
- 9. Магний был открыт при анализе воды из
- 10. Впервые магний был получен в 1808г Гемфри
- 11. Физические свойстваМягкий и пластичный При комнатной температуре покрыт тончайшей оксидной плёнкойТемпература плавления 650 СMg
- 12. Распространение в природеВходит в состав минераловмагнезит MgCO3Доломит
- 13. Горение на воздухе
- 14. ПрименениеMgТвёрдые и прочные сплавы с алюминием магналий-
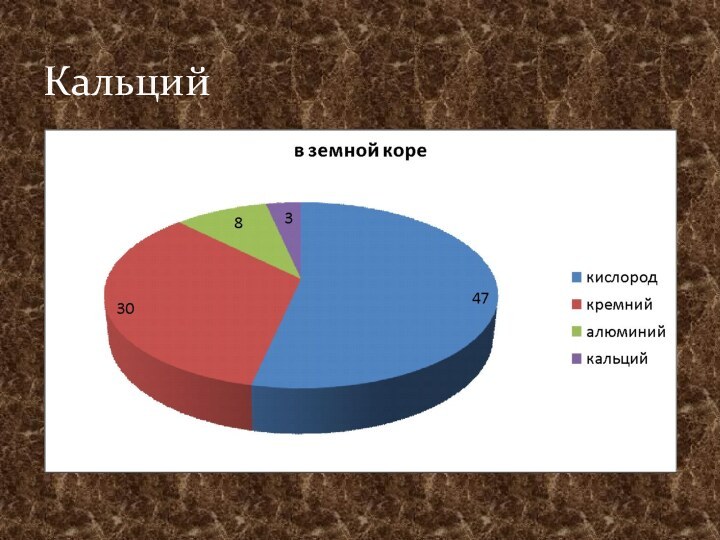
- 15. Кальций
- 16. Распространение в природеГипс CaSO4 2H2OФлюорит CaF2апатит Ca5(PO4)3(OH) мел, мрамор, известняк CaCO3
- 17. Получение Металлический кальций был получен в 1808
- 18. Физические свойстваCaЛёгкий, беловато-серый,Пластичный металлИз –за достаточной твёрдости невозможно резать ножом, как щелочные металлыТемпература плавления С
- 19. С простыми веществами Ca+H2=CaH2 Ca+Cl2=CaCl2Ca+N2=Ca3N
- 20. Со сложными веществамиCa+NH3=Ca(NH2)2 +H2Ca+H2O=Ca(OH)2+H2Ca+HCl=CaCl2+H2 любая кислота кроме азотнойХимические свойства
- 21. Стронций и барийСтронций встречается в природе в
- 22. Соединения кальция, стронция и бария применяют в
- 23. Скачать презентацию
- 24. Похожие презентации














Слайд 2
Be
Mg
Ca
Sr
Ba
Ra
Общая характеристика
Радиус атома
Металлические свойства
n S2
Максимальная степень окисления
+2
Щелочноземельные
металлы
водородом с образованием гидридовСлайд 3 Бериллий сходствует с алюминием и магнием…Получил своё название
потому, что находится в минерале берилле. Металл называют также
глицием от греческого слова «сладкий», потому что соли его имеют сладковатый вкус. Д.И.МенделеевБериллий
Слайд 4
Распространение в природе
Берилл
3Be * Al2O3 *6SiO2
Хризоберилл
BeAl2O4
Изумруд
Аквамарин
Александрит
аквамарин
александрит
изумруд
Кажется, что
если вглядеться в аквамарин, то увидишь тихое море с
водой цвета звёздК.Г.Паустовский
Такой цвет ему придаёт небольшая примесь двухвалентного железа
«Изумруд капризный, как женщина
Встречается совсем не там, где его ищут»
Благодаря насыщенному зелёному цвету и твёрдости очень популярен у ювелиров, чудесная окраска вызвана наличием ионов хрома или ванадия. Зелёный минерал образует кристаллы в форме шестигранных призм
Александрит впервые найденный на Урале в 1830 году в день совершеннолетия царевича Александра II был назван его именем
Александрит редкий камень. Его производят и искусственным путём, однако идёт он не на продажу, а на использование в аэрокосмической отрасли
Слайд 5 В виде простого вещества бериллий получили в 1828году
немецкий учёный Фридрих Вёлер и французский химик Антуан Бюсси.
Они действовали калием на безводный хлорид бериллияBeCl2+2K=Be+2KCl
Получение
Слайд 6 BeF2+Mg=Be+MgF2
В настоящее время бериллий получают, восстанавливая
его фторид магнием, либо электролизом расплава смеси хлоридов бериллия и натрия.
Слайд 7
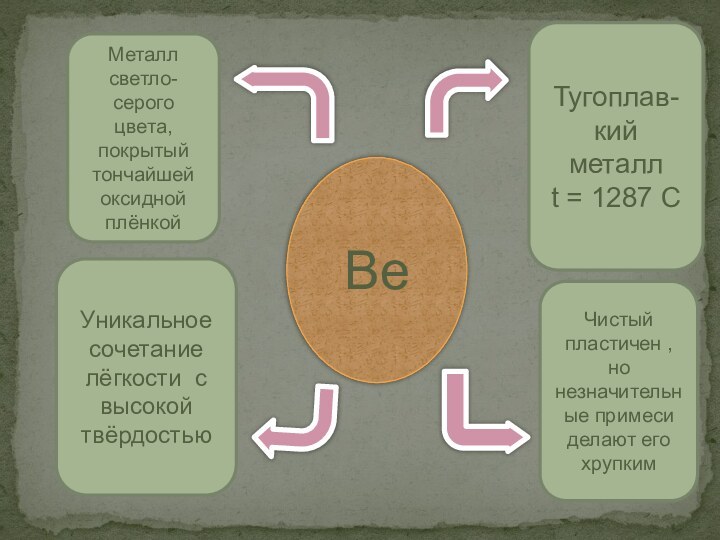
Be
Металл светло-серого цвета, покрытый тончайшей оксидной плёнкой
Тугоплав-
кий металл
t
= 1287 C
Уникальное сочетание лёгкости с высокой твёрдостью
Чистый пластичен
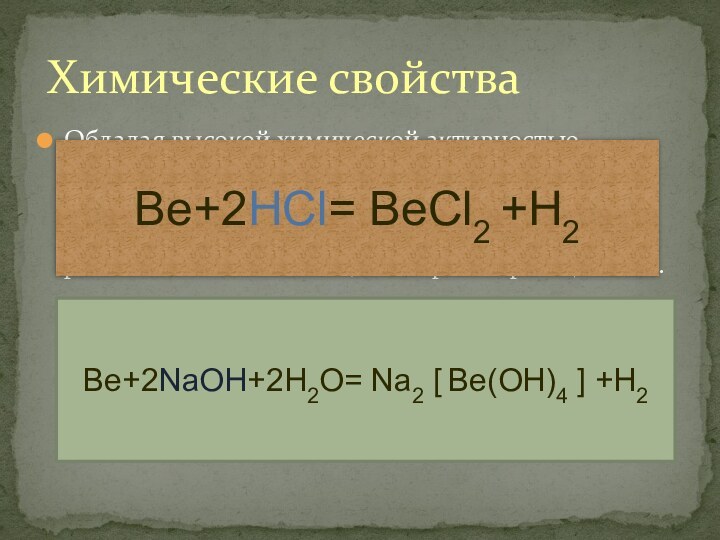
, но незначительные примеси делают его хрупкимСлайд 8 Обладая высокой химической активностью бериллий вступает в реакции
с галогенами, серой и азотом. Вода на него не
действует, зато подобно алюминию он легко растворяется как в разбавленных кислотах , так в растворах щелочей.Химические свойства
Be+2HCl= BeCl2 +H2
Be+2NaOH+2H2O= Na2 Be(OH)4 +H2
Слайд 9 Магний был открыт при анализе воды из минерального
источника вблизи города Эпсом в Англии. Горькая на вкус
она привлекла внимание исследователей, при упаривании такой воды на стенках сосуда образовывалась белая корка вещества, соль MgSO4 7H2OМагний
Слайд 10 Впервые магний был получен в 1808г Гемфри Деви
при электролизе влажной магнезии . По его предложению элемент
назвали MagniumПоучение
Слайд 11
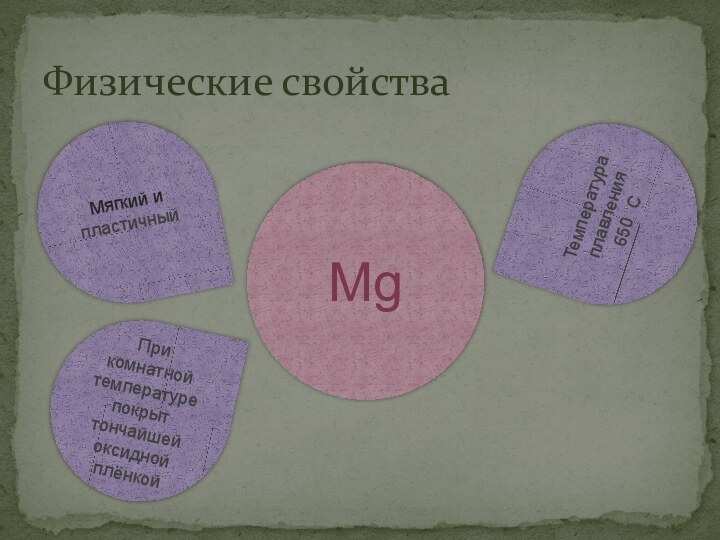
Физические свойства
Мягкий и пластичный
При комнатной температуре покрыт
тончайшей оксидной плёнкой
Температура плавления 650 С
Mg
Слайд 12
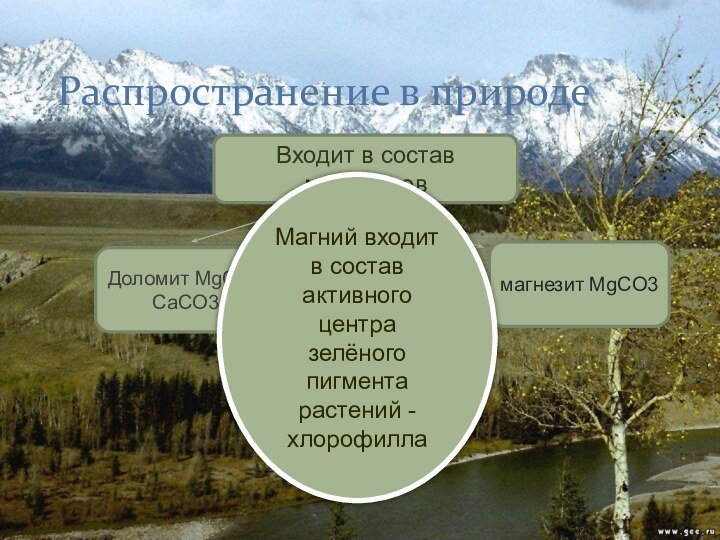
Распространение в природе
Входит в состав минералов
магнезит MgCO3
Доломит MgCO3
CaCO3
Магний входит в состав активного центра зелёного пигмента
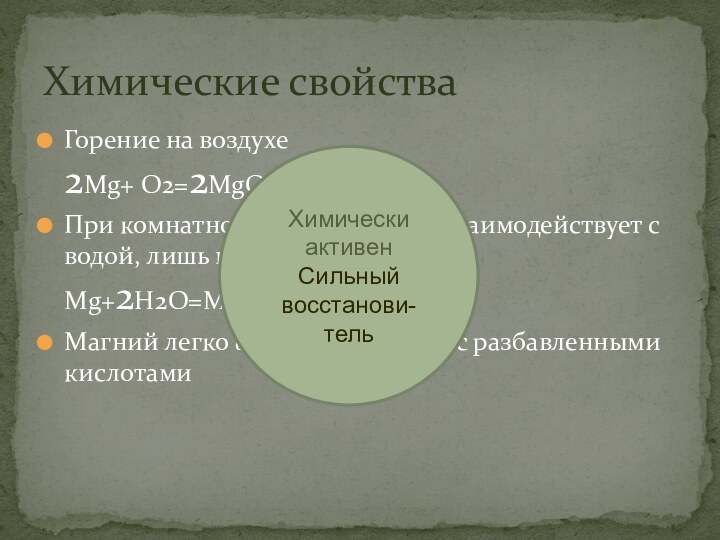
растений -хлорофиллаСлайд 13 Горение на воздухе
2Mg+ O2=2MgO
При комнатной температуре не взаимодействует с водой, лишь при кипячении Mg+2H2O=Mg(OH)2 +H2
Магний легко взаимодействует с разбавленными кислотами
Химические свойства
Химически активен
Сильный восстанови-
тель
Слайд 14
Применение
Mg
Твёрдые и прочные сплавы с алюминием магналий- 30
Mg
Электрон –включает цинк, марганец, медь
Автомобильная , авиационная и ракетная
промышленностьВ медицине
Оксид магния -для понижения кислотности желудка
Сульфат магния - слабительное
Слайд 16
Распространение в природе
Гипс CaSO4 2H2O
Флюорит CaF2
апатит Ca5(PO4)3(OH)
мел,
мрамор, известняк CaCO3
Слайд 17
Получение
Металлический кальций был получен в 1808 году
при электролизе смеси влажной гашёной извести с оксидом ртути
Электролиз
расплавов солей CaCl2 =Ca+Cl2Алюмотермия CaO +Al=CaAlO+Ca
Слайд 18
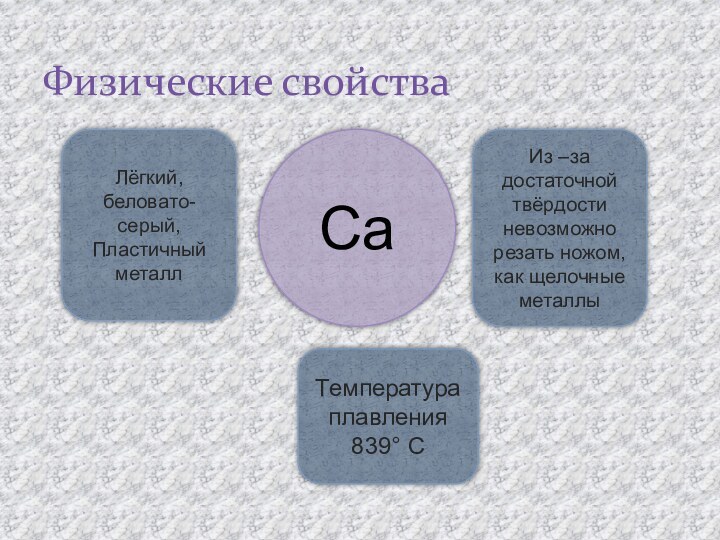
Физические свойства
Ca
Лёгкий, беловато-серый,
Пластичный металл
Из –за достаточной твёрдости невозможно
резать ножом, как щелочные металлы
Температура плавления С
Слайд 19
С простыми веществами
Ca+H2=CaH2
Ca+Cl2=CaCl2
Ca+N2=Ca3N
Химические свойства
Кирпично-красное пламя
Ca+O2=CaO
Слайд 20
Со сложными веществами
Ca+NH3=Ca(NH2)2 +H2
Ca+H2O=Ca(OH)2+H2
Ca+HCl=CaCl2+H2 любая кислота кроме азотной
Химические
свойства
Слайд 21
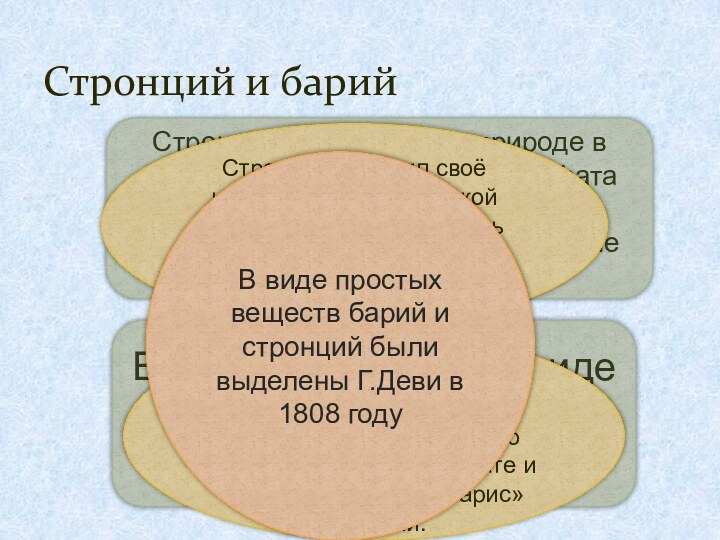
Стронций и барий
Стронций встречается в природе в виде
минерала целестина-сульфата стронция образующего красивые розово-красные или бледно-голубые кристаллы
Барий
встречается в виде барита (тяжёлого шпата)BaSO4
Стронций получил своё название от шотландской деревни Стронциан, близь которой был найден редкий минерал стронцианит
Впервые барий был обнаружен шведским химиком Карлом Вильгельмом Шееле и его учеником в тяжёлом шпате и получил название «барис» тяжёлый.
В виде простых веществ барий и стронций были выделены Г.Деви в 1808 году
Слайд 22 Соединения кальция, стронция и бария применяют в разных
отраслях промышленности и строительстве.
Соединения стронция(нитрат, карбонат ,хлорид, оксалат) используют
в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов.Применение
BaSO4
Используют в производстве белой краски литопон, обладающей высокой кроющей способностью
Добавка в производстве бумаги дорогих сортов- денежных знаков и документов
Изготовление защитных материалов для рентгеновских установок, в медицине