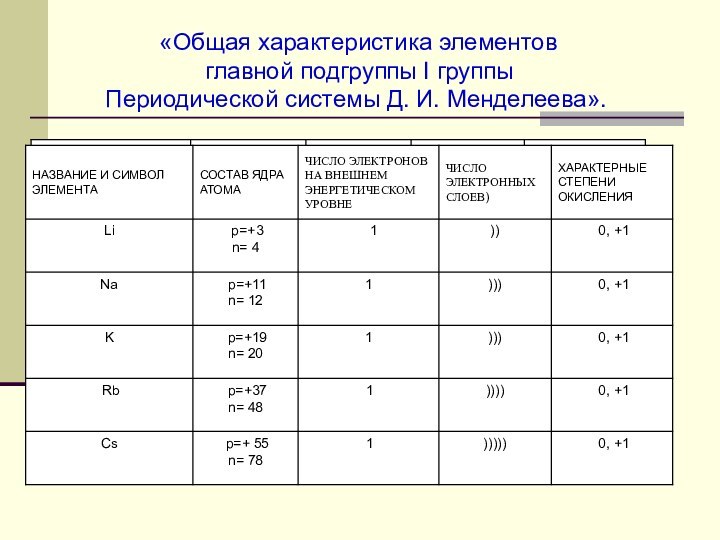
I группы.
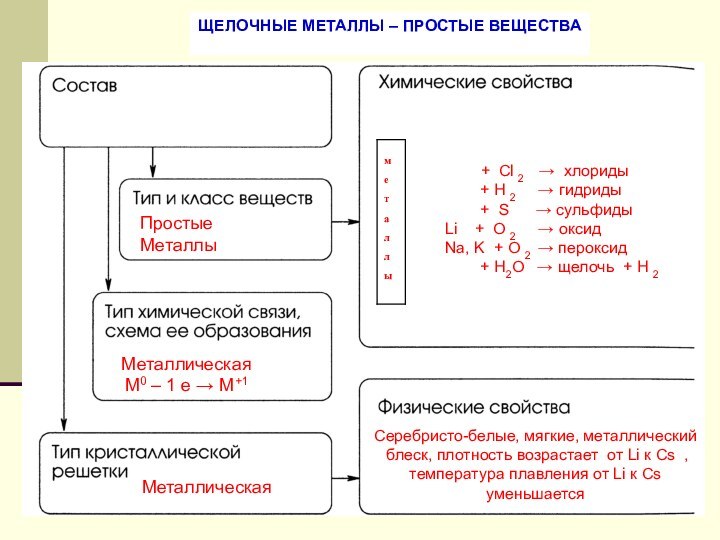
Щелочные металлы – простые вещества.
Химические свойства щелочных металлов.
Соединения
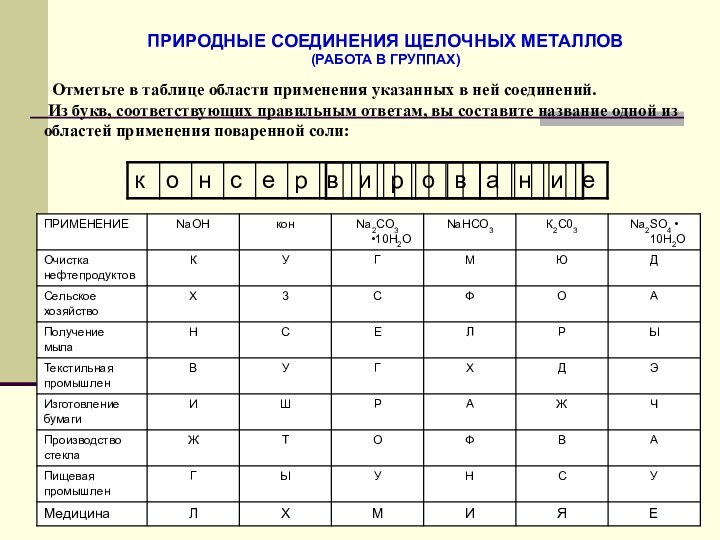
щелочных металлов.Природные соединения и применение щелочных металлов и их соединений.
История открытия