электронное строение, сравнить физические и химические свойства.
Узнать о важнейших
соединениях металлов и их тривиальных названиях. Определить области применения этих соединений.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





















Кристаллы хлорида натрия – минерал галит
Карбонат калия-поташ
Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия
K+ - внеклеточный ион, поддерживает работу сердца и мышц.
Большое количество калия содержится в кураге, сое, фасоли, зеленом горошке, черносливе, изюме.
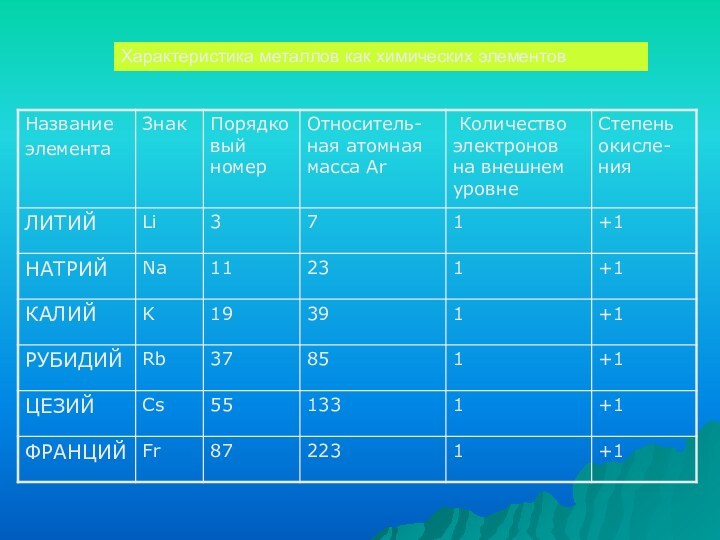
Fr
K
Na
Li
Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Используют для очистки нефтепродуктов, производства бумаги, мыла, волокон, стекла, удобрений. Применяют в медицине и фармакологии.