- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочные металлы и галогены
Содержание
- 2. Тема урока: Щелочные металлы, инертные элементы и галогены
- 3. Цель урока: познакомить учащихся с физическими
- 4. Щелочные металлы:Li, Na, K, Rb, Cs, Fr.Щелочные
- 5. История открытия щелочных металлов В 1807г. в
- 6. Физические свойства. Литий, натрий, калий, рубидий
- 7. Задание №1 Используя таблицу 2 на странице 122 учебника , дайте характеристику физических свойств щелочных металлов.
- 8. Химические свойства щелочных металловКак щелочные металлы реагируют с водой…Как натрий реагирует с калием…Составить уравнения химических реакций.
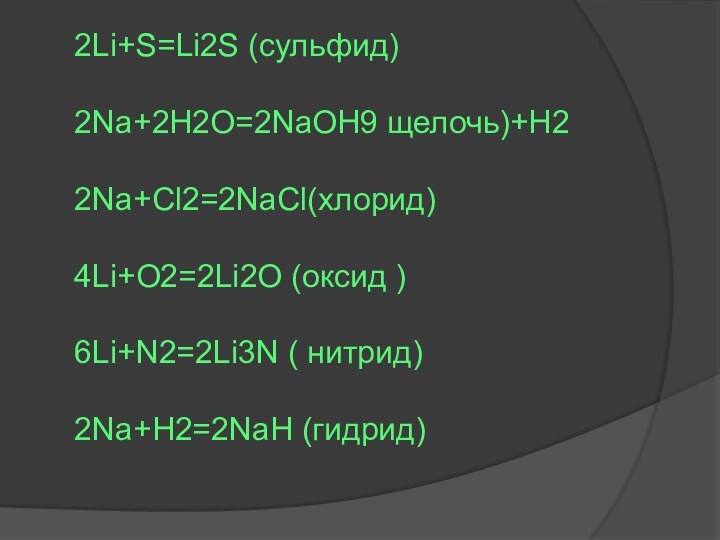
- 9. 2Li+S=Li2S (сульфид)2Na+2H2O=2NaOH9 щелочь)+H22Na+Cl2=2NaCl(хлорид)4Li+O2=2Li2O (оксид )6Li+N2=2Li3N ( нитрид)2Na+H2=2NaH (гидрид)
- 10. Типичные основные оксиды.Реагируют 1.с водойLi2O + H2O
- 11. Сильные основания (щелочи) основность увеличивается в ряду
- 12. Суточная потребность и основные источники поступления: составляет
- 13. Лучшими натуральными источниками калия являются цитрусовые, томаты,
- 14. ЗНАЧЕНИЕ Na ДЛЯ ОРГАНИЗМА Суточная потребность составляет
- 15. Функции:
- 16. ГАЛОГЕНЫ-химические элементы главной подгруппы VII группы таблицы
- 17. К галогенам относятся фтор F, хлор Cl,
- 18. Фтор - зеленовато-жёлтый газ, очень ядовит, попытка
- 19. ХИМИЧЕСКИЕ СВОЙСТВАОбщая формула галогенов – Г2Взаимодействие галогенов
- 20. Взаимодействие галогенов с водородомФтор реагирует с водородом
- 21. Скачать презентацию
- 22. Похожие презентации
Тема урока: Щелочные металлы, инертные элементы и галогены




















Слайд 4
Щелочные металлы:
Li, Na, K, Rb, Cs, Fr.
Щелочные металлы
– это химические элементы с резко выраженными металлическими свойствами.
Щелоччые
металлы находятся в 1 группе главной подгруппы.Всегда в соединениях одноваленты.
Слайд 5
История открытия щелочных металлов
В 1807г. в Англии
Г.Деви открыл натрий и калий: “натрун” - сода, “алкали”
- щелочь.В 1817г. в Швеции А.Арфедсон открыл литий: “литос” - камень.
В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий “темно-красный” и цезий “небесно-голубой”.
В 1939г. во Франции Маргарита Перей открыла радиоактивный элемент франций, который назвал в честь своей страны.
Слайд 6
Физические свойства.
Литий, натрий, калий, рубидий в
свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Обратить
внимание на их мягкость, все металлы очень мягкие и пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу. Плотность металлов возрастает от лития к цезию, а температуры плавления – уменьшаются.
Слайд 7
Задание №1
Используя таблицу 2 на странице 122
учебника , дайте характеристику физических свойств щелочных металлов.
Слайд 8
Химические свойства щелочных металлов
Как щелочные металлы реагируют с
водой…
Как натрий реагирует с калием…
Составить уравнения химических реакций.
Слайд 9
2Li+S=Li2S (сульфид)
2Na+2H2O=2NaOH9 щелочь)+H2
2Na+Cl2=2NaCl(хлорид)
4Li+O2=2Li2O (оксид )
6Li+N2=2Li3N ( нитрид)
2Na+H2=2NaH (гидрид)
Слайд 10
Типичные основные оксиды.
Реагируют
1.с водой
Li2O + H2O =
2LiOH(гидроксид лития)
2 .с кислотными оксидами
Na2O + SO3 =Na2SO4
3.
с кислотами:K2O + 2HNO3 = 2KNO3 + H2O
Слайд 11 Сильные основания (щелочи) основность увеличивается в ряду (LiOH
– NaOH – KOH – RbOH –CsOH); реагируют с
кислотными оксидами: 2NaOH + CO2 = Na2CO3 + H2O - кислотами: LiOH + HCl = LiCl + H2О с солями: NaOH+CuCl2=2NaCl+Cu(OH)2
Слайд 12
Суточная потребность и основные источники поступления: составляет 0,25%
от массы тела.
Общее содержание калия в организме человека составляет
примерно 250г. Суточная потребность в калия составляет 1,5-2 г.ЗНАЧЕНИЕ К ДЛЯ ОРГАНИЗМА
Слайд 13 Лучшими натуральными источниками калия являются цитрусовые, томаты, все
зеленые овощи с листьями, листья мяты, семечки подсолнуха, бананы,
картофель.Калий в виде хлористого калия выделяется в основном почками, в количестве 4,5г - этим обусловлено его мочегонное действие. С солями калия всегда выделяется много воды. В меньшей степени калий выделяется кишечником и незначительное количество - с потом.
Слайд 14
ЗНАЧЕНИЕ Na ДЛЯ ОРГАНИЗМА
Суточная потребность составляет 0.08
% от массы тела. Нормы суточного потребления не существует,
но считается, что потребность взрослого человека составляет около 9-16 грамм хлорида натрия в сутки. При физических нагрузках, в жаркое время года (повышенной температуры окружающей среды), у шахтеров, спортсменов которые участвуют в беге на длительные дистанции суточная потребность возрастает до 20 грамм поваренной соли в сутки.Слайд 15 Функции: 1.регулирует состояние водно-солевого обмена; 2. участвует в
регуляции работы ферментов; 3. Проведение нервного импульса 4.Калий и натрий оба
важны для нормального роста и состояния организма. Они являются антагонистами на клеточном уровне, т.е. повышение содержания натрия приводит к уменьшению калия в клетке.
Слайд 16
ГАЛОГЕНЫ-
химические элементы главной подгруппы VII группы таблицы Менделеева.
Реагируют
почти со всеми простыми веществами, кроме некоторых неметаллов. Все
галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенов-ионов F−, Сl−, Вr−, I− уменьшается.
Слайд 17
К галогенам относятся фтор F, хлор Cl, бром
Br, иод I , астат At. Пока не синтезированный
117-й элемент, унунсептий Uus, также находится формально в группе галогенов, однако по химическим свойствам может существенно отличаться от них, как и астат. Представляют собой:Слайд 18 Фтор - зеленовато-жёлтый газ, очень ядовит, попытка получить
в свободном виде в больших количествах чревата последствиями.
Хлор -
зеленоватый газ. Тяжёлый, также очень ядовитый с резким запахом.Бром - красно-бурая жидкость. Ядовита. Поражает обонятельный нерв. Очень летуч, поэтому содержится в запаянных ампулах
Иод - фиолетово-чёрные кристаллы. Очень легко возгоняется. Ядовит.
Астат - очень радиоактивен, поэтому о нём мало известно.
Слайд 19
ХИМИЧЕСКИЕ СВОЙСТВА
Общая формула галогенов – Г2
Взаимодействие галогенов с
металлами, образуется соли
F—реагирует при обычных условиях, при нагревании и
с золотом , серебром, платиной.Al u Zn—в атмосфере фтора воспламеняются
Zn +F2 =ZnF2
2Al +3 F2 = 2Al F3
Слайд 20
Взаимодействие галогенов с водородом
Фтор реагирует с водородом без
нагревания, идет в темноте, хлор –на свету, бром- при
нагревании, йод- при более сильном нагревании.H2 + F2 =2НF фтороводород
H2 + Cl2 =2НCl хлороводород
H2 + Br2 =2НBr бромоводород