- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сложные вопросы ЕГЭ по химии
Содержание
- 2. «Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки».
- 3. С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
- 4. Необходимые навыкиРасстановка степеней окисленияЗадавать себе главный вопрос:
- 5. Последовательность расстановки коэффициентов в уравненииСначала проставьте коэффициенты,
- 6. Возможные ошибкиРасстановка степеней окисления:а) степени окисления в
- 7. 2. Выбор продуктов без учёта переноса электронов
- 8. .
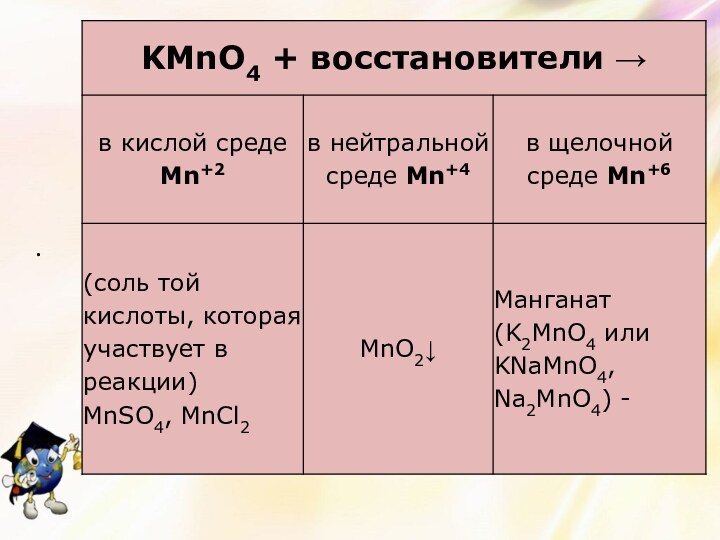
- 9. Повышение степеней окисления марганца
- 10. Дихромат и хромат как окислители.
- 11. Повышение степеней окисления хрома
- 12. Азотная кислота с металлами. — не выделяется водород, образуются продукты восстановления азота
- 13. ДиспропорционированиеРеакции диспропорционирования — это реакции, в которых
- 14. Серная кислота с металлами— разбавленная серная кислота
- 15. Диспропорционирование оксида азота (IV) и солей.
- 16. С 2. Взаимосвязь различных классов неорганических веществ Изменения в КИМ 2012 года
- 17. Задание С2 предложено в двух форматах. В
- 18. С2.1. (прежний формат) – 4 балла.
- 19. 1 или 2 реакции обычно «лежат на
- 20. Типичные окислители и восстановители в порядке ослабления окислительных и восстановительных свойств
- 21. Даны четыре вещества: оксид азота (IV), иодоводород,
- 22. С 3. Генетическая связь между основными классами органических веществ
- 23. Общие свойства классов органических веществОбщие способы получения органических веществСпецифические свойства некоторых конкретных веществОбязательный минимум знаний
- 24. Большинство превращений Углеводородов в кислородсодержащие соединения происходит
- 25. Основные превращения бензола и его производныхОбратите внимание,
- 26. Получение азотсодержащих органических веществ
- 27. Взаимопревращения азотсодержащих соединенийНеобходимо помнить,что взаимодействие аминов с
- 28. Окислительно-восстановительные свойства кислородсодержащих соединенийОкислителями спиртовчаще всего являютсяоксид
- 29. Получение производных карбоновых кислотСектор 1 – химические
- 30. Генетическая связь между производными карбоновых кислот
- 31. Типичные ошибки при выполнении задания СЗ: незнание
- 32. С 4. Расчёты по уравнениям реакций
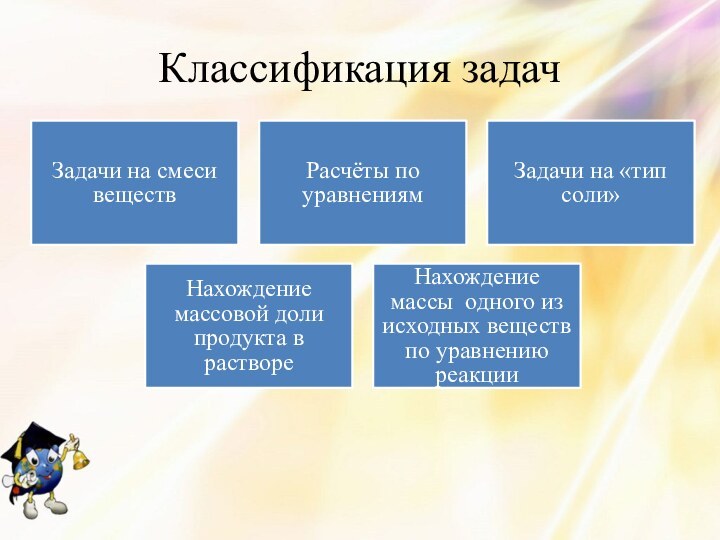
- 33. Классификация задач
- 34. Расчёты по уравнениям реакций.Газ, выделившийся при взаимодействии
- 35. II. Задачи на смеси веществНа нейтрализацию 7,6
- 36. III. Определение состава продукта реакции (задачи на
- 37. IV. Нахождение массовой доли одного из продуктов
- 38. Нахождение массы одного из исходных веществ по
- 39. Наиболее часто учащимися допускаются ошибки: - при
- 40. С 5. Вывод молекулярной формулы вещества
- 41. Вывод формул
- 43. Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.
- 44. 2. При монохлорировании углеводорода, содержащего 83,
- 45. 3. На нейтрализацию 18,5 г предельной одноосновной
- 46. 4. Одно и то же количество алкена
- 47. 5. При сгорании вторичного амина симметричного строения
- 48. Спасибо за внимание
- 49. Скачать презентацию
- 50. Похожие презентации
«Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки».













































Слайд 3 С1. Используя метод электронного баланса, составьте уравнение реакции.
Определите окислитель и восстановитель.
Слайд 4
Необходимые навыки
Расстановка степеней окисления
Задавать себе главный вопрос: кто
в этой реакции отдаёт электроны, а кто их принимает?
Определите,
в какой среде (кислой, нейтральной или щелочной) протекает реакция. если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая.Проверьте, чтобы в реакции был и окислитель, и восстановитель
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Слайд 5
Последовательность расстановки коэффициентов в уравнении
Сначала проставьте коэффициенты, полученные
из электронного баланса
Если какое-либо вещество выступает и в роли
среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставленыПредпоследним уравнивается водород
по кислороду мы только проверяем
Слайд 6
Возможные ошибки
Расстановка степеней окисления:
а) степени окисления в водородных
соединениях неметаллов: фосфин РН3 — степень окисления у фосфора
— отрицательная;б) в органических веществах — проверьте ещё раз, всё ли окружение атома С учтено в) аммиак и соли аммония — в них азот всегда имеет степень окисления −3
в) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления +1, +3, +5, +7;
г) двойные оксиды: Fe3O4, Pb3O4 — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Слайд 7 2. Выбор продуктов без учёта переноса электронов —
то есть, например, в реакции есть только окислитель без
восстановителя или наоборот3. Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
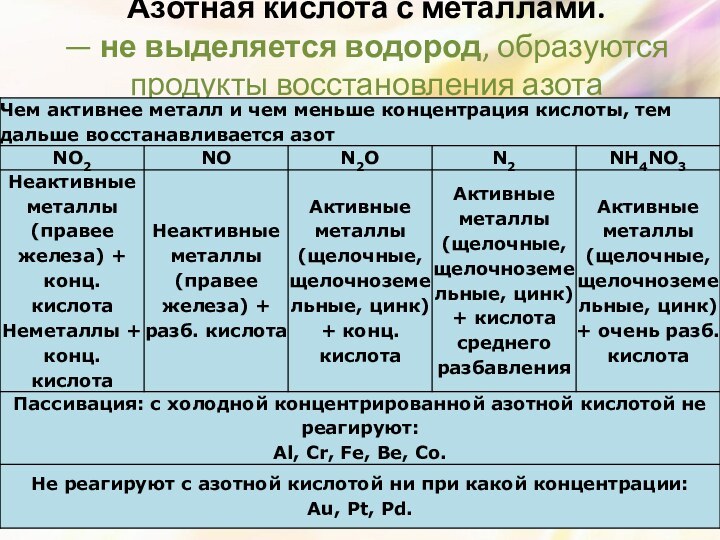
Слайд 12 Азотная кислота с металлами. — не выделяется водород, образуются
продукты восстановления азота
Слайд 13
Диспропорционирование
Реакции диспропорционирования — это реакции, в которых один
и тот же элемент является и окислителем, и восстановителем,
одновременно и повышая, и понижая свою степень окисления:
Слайд 14
Серная кислота с металлами
— разбавленная серная кислота реагирует
как обычная минеральная кислота с металлами левее Н в
ряду напряжений, при этом выделяется водород; — при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Слайд 17
Задание С2 предложено в двух форматах.
В одних
вариантах КИМ оно будет предложено в прежнем формате
а
в других в новом, когда условие задания представляет собой описание конкретного химического эксперимента, ход которого экзаменуемый должен будет отразить посредством уравнений соответствующих реакций.Слайд 18 С2.1. (прежний формат) – 4 балла. Даны вещества:
оксид азота (IV), медь, раствор гидроксида калия и концентрированная
серная кислота. Напишите уравнения четырех возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.С2.2.(В новом формате) – 4 балла. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
Слайд 19 1 или 2 реакции обычно «лежат на поверхности»,
демонстрируя либо кислотные, либо основные свойства вещества
В наборе из
четырех веществ, как правило, встречаются типичные окислители и восстановители. В этом случае как минимум одна представляют собой ОВРДля написания реакций между окислителем и восстановителем необходимо:
1. предположить, до какого возможного значения повысится степень окисления атома-восстановителя и в каком продукте реакции он будет ее проявлять;
2. предположить, до какого возможного значения понизится степень окисления атома-окислителя и в каком продукте реакции он будет ее проявлять.
Обязательный минимум знаний
Слайд 20 Типичные окислители и восстановители в порядке ослабления окислительных
и восстановительных свойств
Слайд 21 Даны четыре вещества: оксид азота (IV), иодоводород, раствор
гидроксида калия, кислород.
1. кислота + щёлочь
а) есть 2 окислителя:
NО2 и О2 б) восстановитель: НI
2. 4HI + О2 = 2I2 + 2Н2О
3. NО2 + 2HI = NO + I2 + Н2О
Диспропорционирование в растворах щёлочи
4.2NО2 + 2NaOH = NaNО2 + NaNО3 + Н2О
Слайд 23
Общие свойства классов органических веществ
Общие способы получения органических
веществ
Специфические свойства некоторых конкретных веществ
Обязательный минимум знаний
Слайд 24
Большинство превращений
Углеводородов в кислородсодержащие
соединения происходит через
галогенпроизводные
при последующем действии на них щелочей
Взаимопревращения углеводородов
и
кислородсодержащих
органических веществ
Слайд 25
Основные превращения бензола и его производных
Обратите внимание, что
у бензойной кислоты и нитробензола реакции замещения идут в
мета-положениях, а у большинства других производных бензола – в орто и пара-положениях.
Слайд 27
Взаимопревращения азотсодержащих соединений
Необходимо помнить,
что взаимодействие
аминов с галогеналканами
происходит
с увеличением числа
радикалов у атома азота.
Так можно из
превичныхаминов получать соли вторичных, а затем из них получать вторичные амины.
Слайд 28
Окислительно-восстановительные свойства кислородсодержащих соединений
Окислителями спиртов
чаще всего являются
оксид меди
(II) или
перманганат калия,
а окислителями
альдегидов и кетонов -
гидроксид меди (II),
аммиачный раствор
оксида серебра и
другие окислители
Восстановителем
является водород
Слайд 29
Получение производных карбоновых кислот
Сектор 1 – химические реакции
с разрывом связей О-Н
(получение солей)
Сектор 2 – химические
реакции с заменой гидроксогруппы
на галоген, аминогруппу или получение ангидридов
Сектор 3 – получение нитрилов
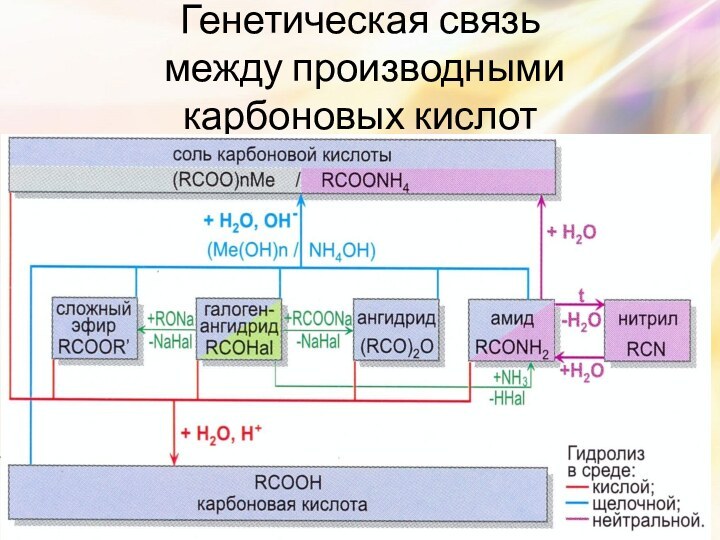
Слайд 31
Типичные ошибки при выполнении задания СЗ:
незнание условий
протекания химических реакций, генетической связи классов органических соединений;
незнание механизмов,
сущности и условий реакций с участием органических веществ, свойств и формул органических соединений;неумение предсказать свойства органического соединения на основе представлений о взаимном влиянии атомов в молекуле;
незнание окислительно-восстановительных реакций (например, с перманганатом калия).
Слайд 34
Расчёты по уравнениям реакций.
Газ, выделившийся при взаимодействии 110
мл 18 % -ного раствора HCl (ρ = 1,1
г/мл) и 50 г 1,56 % - ного раствора Na2S пропустили через 64 г 10,5% - ного раствора нитрата свинца. Определите массу соли, выпавшей в осадок.
Слайд 35
II. Задачи на смеси веществ
На нейтрализацию 7,6 г
смеси муравьиной и уксусной кислот израсходовано 35 мл 20%-ного
раствора гидроксида калия (плотность 1,20 г/мл). рассчитайте массу уксусной кислоты и её массовую долю в исходной смеси кислот.Слайд 36 III. Определение состава продукта реакции (задачи на «тип
соли»)
Аммиак объёмом 4,48 л (н.у) пропустили через 200 г
4,9%-ного раствора ортофосфорной кислоты. Назовите соль, образующуюся в результате реакции, и определите её массу.Слайд 37 IV. Нахождение массовой доли одного из продуктов реакции
в растворе по уравнению материального баланса
Оксид, образовавшийся при сжигании
18,6 г фосфора в 44,8 л (н.у.) кислорода, растворили в 100 мл дистиллированной воды. Рассчитайте массовую долю ортофосфорной кислоты в полученном растворе. Слайд 38 Нахождение массы одного из исходных веществ по уравнению
материального баланса
Какую массу гидрида лития нужно растворить в 200
мл воды, чтобы получить раствор с массовой долей гидроксида 10%? Какой цвет приобретёт метилоранж при добавлении его в полученный раствор? Запишите уравнение реакции и результаты промежуточных вычислений.
Слайд 39
Наиболее часто учащимися допускаются ошибки:
- при определении массы
раствора без учета массы выделившегося газа или осадка;
при определении
массовой доли растворенного вещества в растворе, полученного при смешивании растворов с различной массовой долей растворенного вещества;при определении количеств веществ, вступающих в реакцию.
Слайд 43 Установите молекулярную формулу предельного третичного амина, содержащего 23,73%
азота по массе.
Слайд 44
2. При монохлорировании углеводорода, содержащего 83, 72
% углерода образовалось два изомерных хлорпроизводных – первичное и
третичное.Установите строение углеводорода, дайте ему название и составьте структурные формулы продуктов хлорирования.
Слайд 45
3. На нейтрализацию 18,5 г предельной одноосновной
карбоновой
кислоты потребовался раствор, содержащий
10 г гидроксида натрия. Определите
формулу кислоты.
Слайд 46
4. Одно и то же количество алкена при
взаимодействии
с хлором образует 2,26 г дихлорпроизводного, а при
взаимодействии с бромом -4,04 г дибромпроизводного.
Определите состав алкена.
Слайд 47
5. При сгорании вторичного амина симметричного
строения образовалось
44,8 мл углекислого газа, 5,6 мл
азота (при н.у.)
и 49,5 мг воды. Определите молекулярную формулу амина.