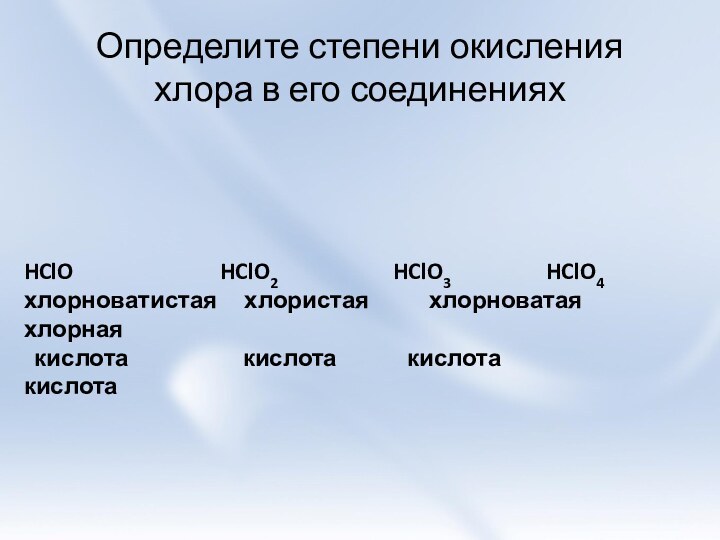
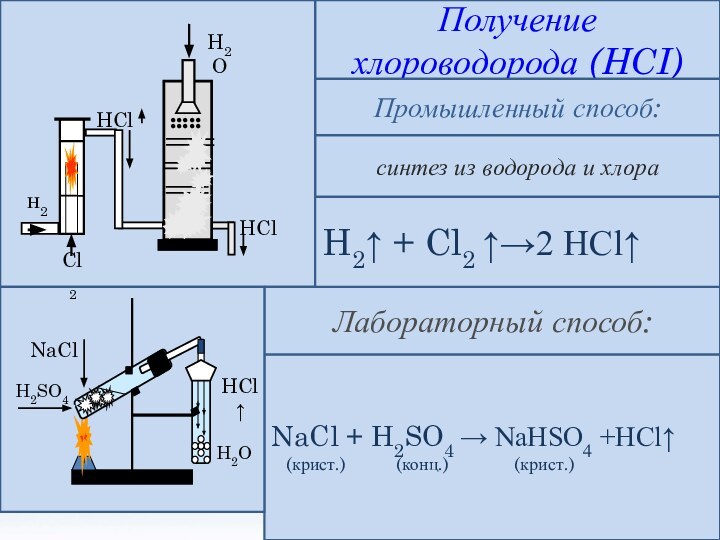
и её свойства.
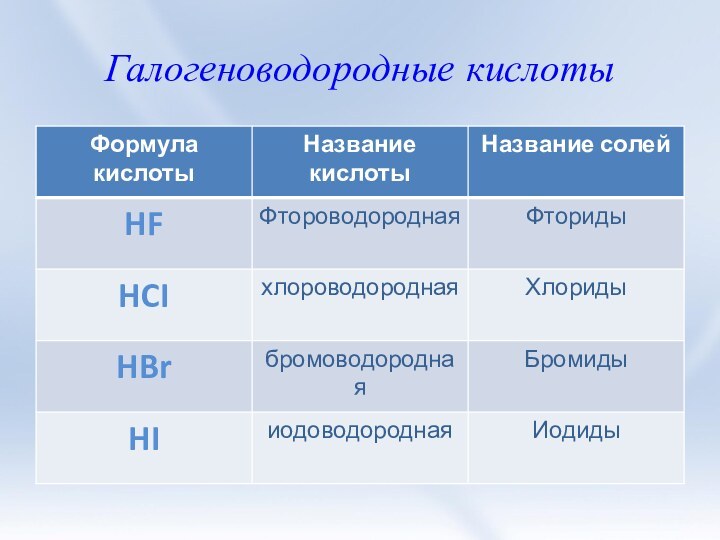
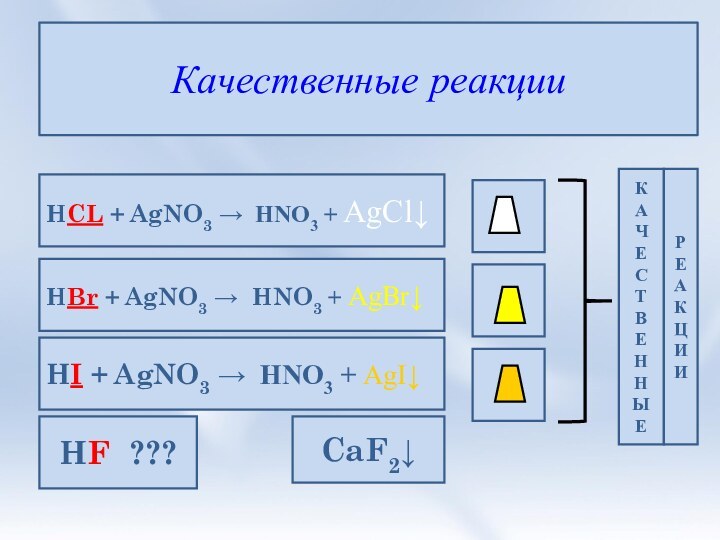
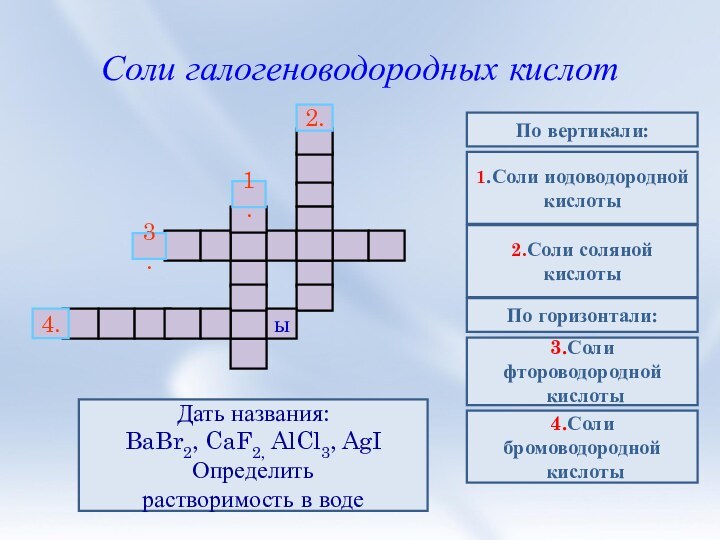
3. Соли галогеноводородных кислот. Галогениды. Качественные
реакции на галогенид-ионы.4. Природные соединения галогенов.
5. Рефлексия.
6. Подведение итогов.
7. Домашнее задание.