Слайд 2
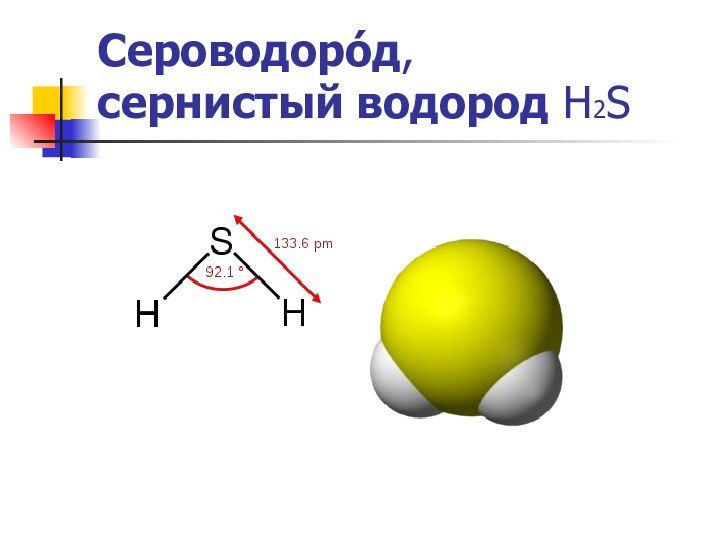
Сероводоро́д,
сернистый водород Н2S
Слайд 3
Сероводоро́д,
сернистый водород Н2S
Общие
Систематическое наименование сероводород / hydrogen
sulphide
Химическая формула H2S
Отн. молек. МассаОтн. молек. Масса 34.082 а. е. м.
Молярная массаМолярная
масса34.082 г/моль
Физические свойства
СостояниеСостояние (ст. усл.)бесцветный газ
Плотность1.5392 г/л г/см³
Термические свойства
Температура плавления-82.30 °C
Температура кипения-60.28 °C
Химические свойства pKa6.89, 19±2
Растворимость в воде0.25 (40 °C) г/100 мл
КлассификацияРег. номер CAS7782-79-8
Слайд 4
Сероводоро́д,
сернистый водород Н2S
Бесцветный газ с неприятным запахом
(тухлого яйца) и сладковатым вкусом. Плохо растворим в воде,
хорошо — в этаноле. При больших концентрациях разъедает металл. Взрывчатая смесь с воздухом 4,5 - 45%.
В природе встречается очень редко в виде смешанных веществ нефти и газа. Имеет очень неприятный запах, вреден для лёгких и всего организма. Сейчас сероводород используют в лечебных целях, например, в сероводородных ваннах
Слайд 5
Сероводоро́д Н2S
Физические свойства
Термически неустойчив (при температурах
больше 400 °C разлагается на простые вещества Термически неустойчив
(при температурах больше 400 °C разлагается на простые вещества — S Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2), ядовитый (вдыхание воздуха с его примесью вызывает головокружение, головную боль, тошноту, а со значительным содержанием приводит к коме, судорогам, отёку лёгких и даже к летальному исходу), газ, тяжелее воздуха с неприятным запахом тухлых яиц.
Молекула Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10-29 Кл·м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водныйS — газ. Насыщенный водный растворS — газ. Насыщенный водный раствор (сероводородная вода) H2S является очень слабой сероводородной кислотой.
Слайд 6
Сероводоро́д Н2S
Химические свойства
В воде сероводород мало растворим, водный
раствор H2S является очень слабой кислотой:
H2S → HS− +
H+
Ka = 6.9×10−7 моль/л; pKa = 6.89.
С основаниями реагирует:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе он горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42-, например:
3H2S + 4HClO3 = 3H2SO4 + 4HCl
2H2S + SO2 = 2Н2О + 3S
H2S + I2 = 2HI + S
Слайд 7
Сероводоро́д Н2S
Химические свойства
Сульфиды
Соли сероводородной кислоты называют сульфидами.

В воде хорошо растворимы только сульфиды щелочных металлов, бария
и аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления (Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пиритМногие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопиритМногие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Получение
Взаимодействие разбавленных кислот на сульфиды:
Взаимодействие сульфида алюминияВзаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода):
Слайд 8
Применеие сероводорода Н2S
Сероводород из-за своей токсичности находит ограниченное

применение.
В аналитической химии сероводород и сероводородная водаВ аналитической химии
сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металловВ аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезеИспользуют в органическом синтезе для получения тиофенаИспользуют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моряВ последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Слайд 10
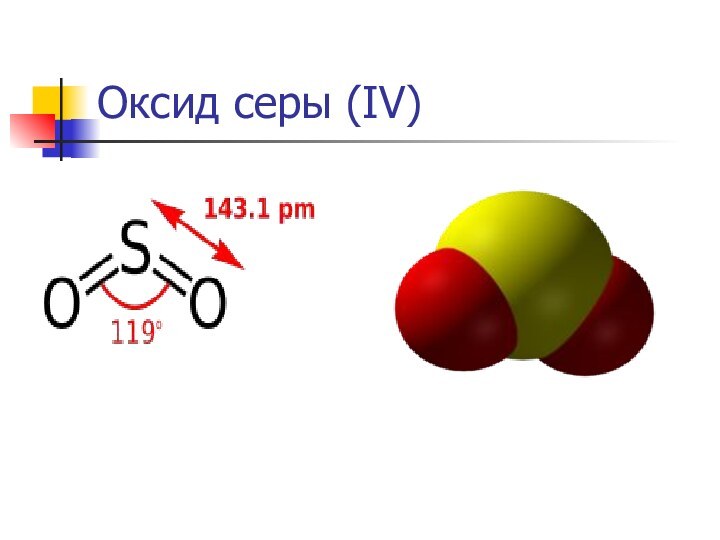
Оксид серы (IV)
Общие свойства
Систематическое наименование Оксид серы(IV)
Химическая
формула SO2
Относительная молекулярная массаОтносительная молекулярная масса 64.054 а. е. м.
Молярная массаМолярная масса
64.054 г/моль
Физические свойства
Состояние (норм. условия )бесцветный газ,
Плотность 2,927 г/л (г/см³)
Термические свойства
Температура плавления−75,5 °C
Температура кипения−10,01 °C
Химические свойства
Растворимость в воде11,5 г/100 мл
Классификация Рег. номер CAS[7446-09-5]
Слайд 11
Химические свойства
оксида серы (IV)
Относится к кислотным оксидам.
Растворяется в воде с образованием сернистой кислоты (при обычных
условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°С),
Слайд 12
Химические свойства
оксида серы (IV)
Данная реакция является качественной
реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового
раствора).
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Слайд 13
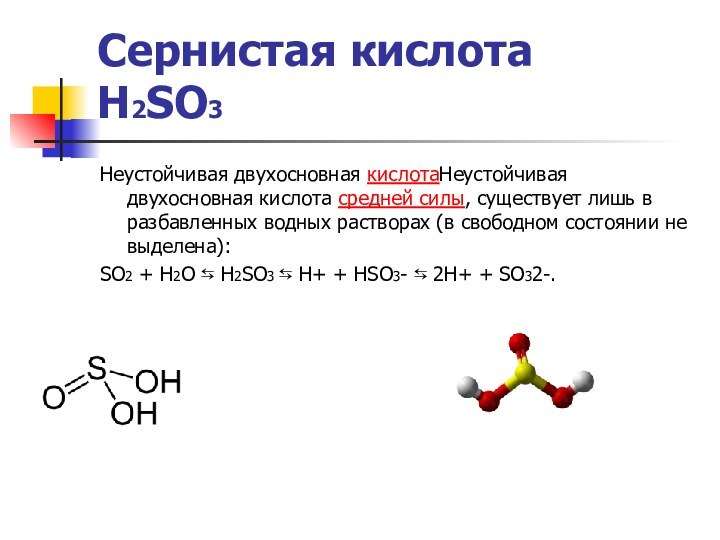
Сернистая кислота
H2SO3
Неустойчивая двухосновная кислотаНеустойчивая двухосновная кислота средней
силы, существует лишь в разбавленных водных растворах (в свободном
состоянии не выделена):
SO2 + H2O ⇆ H2SO3 ⇆ H+ + HSO3- ⇆ 2H+ + SO32-.
Слайд 14
Химические свойства
Сернистой кислоты H2SO3
Кислота средней силы:
H2SO3
H+ + HSO3-, KI = 2·10-2
HSO3-
H+ + SO32-, KII = 6·10-8
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спичкивсегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислотаДвухосновная кислота, образует два ряда солей: кислые — гидросульфитыДвухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфитыи средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Слайд 15
Применение
Сернистой кислоты H2SO3
Сернистая кислота и её

соли применяют как восстановители, для беления шерстиСернистая кислота и
её соли применяют как восстановители, для беления шерсти, шелкаСернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора).
Сернистую кислоту применяют при консервировании плодов и овощей.
Гидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозуГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнинГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
Слайд 17
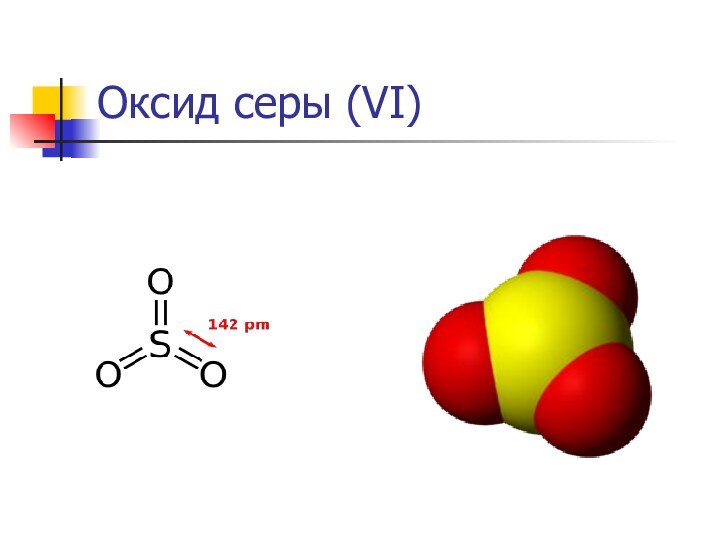
Оксид серы (VI)
Общие свойства
Систематическое наименование Оксид серы(VI)
Химическая формула
SO3
Отн. молек. МассаОтн. молек. Масса 80.06 а. е. м.
Молярная массаМолярная масса 80.06 г/моль
Физические
свойства
СостояниеСостояние (ст. усл.) бесцветный газ
Плотность1.92 г/см³
Термические свойства
Температура плавления16,9 °C
Температура кипения45 °C
Энтальпия образованияЭнтальпия образования (ст. усл.)−397.77 кДж/моль Классификация Рег. номер CAS[7446-11-9]
Слайд 18
Оксид серы (VI)
Физические свойства
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись
се́ры, се́рный га́з)
SO3 — высший оксид серы,
тип химической связи: ковалентная полярная
В обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Слайд 19
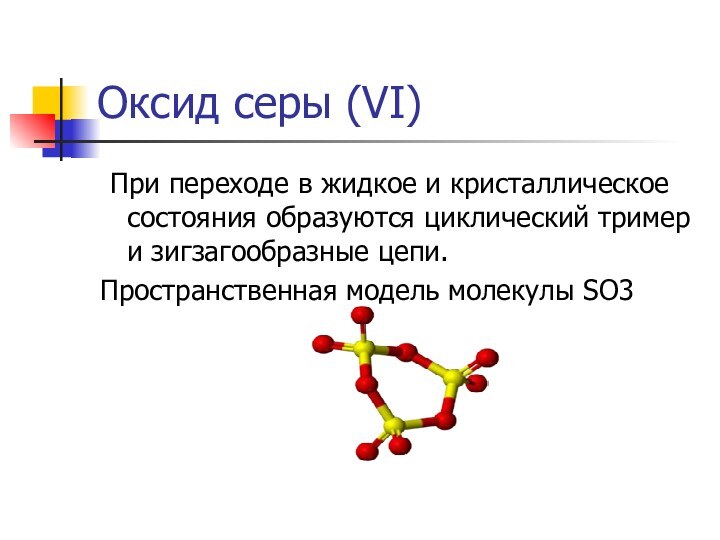
Оксид серы (VI)
При переходе в жидкое и
кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Пространственная модель
молекулы SO3
Слайд 20
Получение оксида серы (VI)
Получают, окисляя оксид серы(IV)Получают, окисляя
оксид серы(IV) кислородомПолучают, окисляя оксид серы(IV) кислородом воздуха при
нагревании, в присутствии катализатораПолучают, окисляя оксид серы(IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt, Pt или Na2VO3):
2SO2 + O2 → 2SO3 + Q.
Можно получить термическим разложением сульфатов:
Fe2(SO4)3 → Fe2O3 + 3SO3,
или взаимодействием SO2 с озоном:
SO2 + O3 → SO3 + O2↑.
Для окисления SO2 используют также NO2:
SO2 + NO2 → SO3 + NO↑.
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Слайд 21
Оксид серы (VI)
Химические свойства
1. Кислотно-основные: SO3 — типичный
кислотный оксид — типичный кислотный оксид, ангидрид — типичный
кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика.
При взаимодействии с водой образует серную кислоту:
SO3 + H2OO → H2SO4.
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
H2SO4 (100 %) + SO3 → H2S2O7.
Слайд 22
Оксид серы (VI)
Химические свойства
2. Окислительно-восстановительные: SO3 характеризуется сильными
окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
5SO3 + 2P
+ 2P→ P2O5 + 5SO2
3SO3 + H2SS → 4SO2 + H2O
2SO3 + 2KI + 2KI → SO2 + I2 + K2SO4.
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
SO3 + HCl + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
SO3 + Cl2 + 2SCl2 → 3SOCl2
Слайд 24
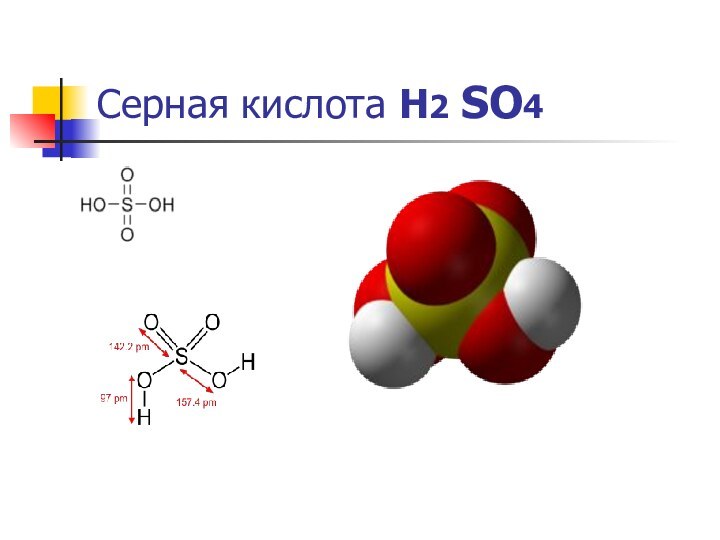
Серная кислота Н2 SO4
Общие свойства
Систематическое наименование серная кислота
Химическая
формула H2SO4
Отн. молек. МассаОтн. молек. Масса 62.03 а. е. м.
Молярная массаМолярная масса98.078 г/моль
Физические
свойства
СостояниеСостояние (ст. усл.)бесцветная маслянистая жидкость без запаха
Плотность1,8356 г/см³
Термические свойства
Температура плавления10,38 °C
Температура кипения279,6 °C
Химические свойства
Растворимость в водесмешивается во всех соотношениях г/100 мл
Классификация
Рег. номер CAS7664-93-
Слайд 25
Физические свойства
серной кислоты Н2 SO4
Се́рная кислота́ H2SO4 —
сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6).
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха.
В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Если молярное отношение SO3:H2O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3 в серной кислоте (олеум).
Слайд 26
Химические свойства
серной кислоты Н2 SO4
Серная кислота -

сильная двухосновная кислота, диссоциация ее протекает по двум ступеням:
H2SO4 = H+ + HSO4- - первая ступень
HSO4- =H+ + SO42- - вторая ступень
В концентрированных растворах диссоциация серной кислоты по второй ступени незначительна.
Серная кислота - сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична), отнимает воду
1. от кристаллогидратов:
CuSO4*5H2O голубой ------------------------> CuSO4 белый + 5H2O
2. углеводов (обугливает дерево и бумагу):
C12H22O11 --------------------------> 12C + 11H2O
3. спиртов:
C2H5OH -----------------------------> CH2=CH2 + H2O
В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты (неокислитель) - при этом восстанавливаются ионы Н+, например:
Fe + H2SO4 разб.= FeSO4 + H2
Разбавленная H2SO4 не взаимодействует с металлами, стоящими в ряду напряжений правее водорода.
Концентрированная серная кислота - кислота-окислитель, при этом восстанавливается сера (+6).
Она окисляет металлы, стоящие в ряду напряжений правее водорода:
Cu + 2H2SO4конц. = CuSO4 + SO2 + 2H2O
Слайд 27
Химические свойства
серной кислоты Н2 SO4
Серная кислота проявляет
все свойства сильных кислот:
а) взаимодействует с основными оксидами:
CuO +
H2SO4 = CuSO4 + H2O
б) с основаниями:
2NaOH + H2SO4= Na2SO4 + 2H2O
в) вытесняет другие кислоты из их солей, например те, которые слабее нее:
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
или более летучие (обладающие температурами кипения ниже, чем у серной кислоты):
NaNO3твердый + H2SO4 конц.= NaHSO4 + HNO3- при нагревании
и металлы,стоящие левее водорода, при этом сера восстанавливается до степени окисления +4, 0 и -2:
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Слайд 28
Химические свойства
серной кислоты Н2 SO4
Железо, алюминий, хром
концентрированной серной кислотой пассивируются, однако при сильном нагревании реакция
начинается, например:
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Концентрированная серная кислота окисляет неметаллы, например:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
S +2H2SO4 = 3SO2 + 2H2O
Концентрированная серная кислота окисляет также сложные вещества, например HI и HBr:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
соли железа (2):
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + 2H2O + SO2
Слайд 29
Задания для самостоятельной работы:
Напишите уравнения взаимодействия разбавленной серной
кислоты с
металлами;
основными оксидами;
амфотерными оксидами;
основаниями;
амфотерными
гидроксидами.
Слайд 30
Соли серной кислоты
Серная кислота как двухосновная кислота образует
два ряда солей - кислые - гидросульфаты и средние
- сульфаты. В безводном состоянии выделены только гидросульфаты щелочных металлов. Средние сульфаты (безводные) - как правило, бесцветные кристаллические вещества, склонные к образованию кристаллогидратов (часто окрашеных), например:
Na2SO4*10H2O - глауберова соль (мирабилит) - бесцветная
MgSO4*7H2O - горькая (английская) соль - бесцветная
CuSO4*5H2O - медный купорос - голубой
FeSO4*7H2O - железный купорос - голубовато-зеленый
CaSO4*2H2O - гипс - белый
Сульфаты при нагревании разлагаются (кроме сульфатов щелочных металлов, которые термически устойчивы), например CaSO4 - при 1400oС:
2CaSO4 = 2CaO + 2SO2 + O2
Сульфаты переходных металлов разлагаются при более низких температурах, например Fe2(SO4)3 - при 700-800oС:
Fe2(SO4)3 = Fe2O3 + 3SO3
Слайд 31
Производство серной кислоты
Сырьём

для получения серной кислоты служат сераСырьём для получения серной
кислоты служат сера, сульфидыСырьём для получения серной кислоты служат сера, сульфиды металловСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводородСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфатыСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железаСырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций, сульфаты железа, кальция и др.
Основные этапы получения серной кислоты:
Обжиг сырья с получением SO2
Окисление SO2 в SO3
АбсорбцияАбсорбция SO3
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный — с оксидами азота.
Слайд 32
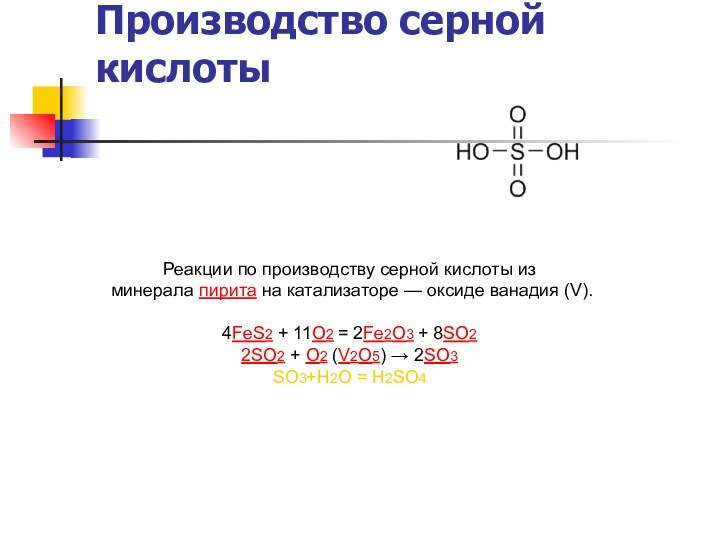
Производство серной кислоты
Реакции по производству серной кислоты из
минерала пирита на катализаторе — оксиде ванадия (V).
4FeS2 +
11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 (V2O5) → 2SO3
SO3+Н2О = Н2SO4
Слайд 33
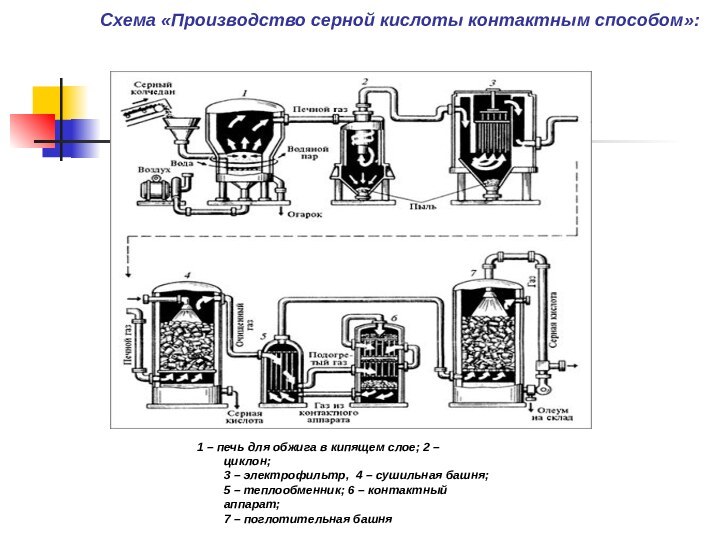
Схема «Производство серной кислоты контактным способом»:
Слайд 34
Применение серной кислоты
В производстве минеральных удобрений;
как электролит
в свинцовых аккумуляторах;
для получения различных минеральных кислот и
солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе в реакциях:
дегидратации (получение диэтилового эфира, сложных эфиров);
гидратации (этанолгидратации (этанол из этилена);
сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
алкилирования (получение изооктанаалкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Слайд 35
Исторические сведения
о серной кислоте
Серная кислота известна с древности.

Первое упоминание о кислых газах, получаемых при прокаливании квасцовСерная
кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купоросаСерная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
Позже, в IX веке персидский алхимик Ар-РазиПозже, в IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитрыВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пиритаВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортахВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянной лабораторной посуды перешли к большим промышленным свинцовым камерам.
Слайд 36
Дополнительные сведения
о серной кислоте
Мельчайшие капельки

серной кислоты могут образовываться в средних и верхних слоях
атмосферы в результате реакции водяного пара Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1] Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1]. Взрыв вулкана Пинатубо Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1]. Взрыв вулкана Пинатубо в 1991 году Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994 [2].
Слайд 37
В печь, где жар-огонь горит (поз. 1),
Вносят раздробленный
Серный
колчедан, пирит (FeS2).
Вот он, раскаленный,
Серой струйкой пылевой
Сверху вниз несется.
Воздух
мощною струей
Снизу подается.
Мощный стал противоток,
Смерч тут настоящий,
И, как огненный цветок,
Слой частиц кипящий,
В вихре раскаленных масс
Кислород с пиритом
Превратился в легкий газ
В том процессе скрытом.
Газ содержит пыль и грязь,
От оксида серы (SO2)
Производство серной кислоты
контактным способом
Их циклон отделит враз (поз. 2):
В нем для них барьеры.
Два цилиндра в нем, и вот,
Сверху вниз обычно,
По спирали газ идет.
Пыль из газа упадет,
Но не вся, частично.
Смесь в электрофильтр подав (поз. 3),
Где сплошные сетки
И под током провода,
Пыль, как птицу в клетку,
Ловят каждый раз подряд,
Ведь частички пыли
Обретают здесь заряд,
Подчиняясь силе
Электрических полей.
Минус-знак поймала
Пыль, прилипнув массой всей
К сетке из металла.
В бункер или просто в ров
Опадает сразу.
Но очистить от паров
Еще надо газы.