активности на уроке химии, путем применения наглядных средств обучения
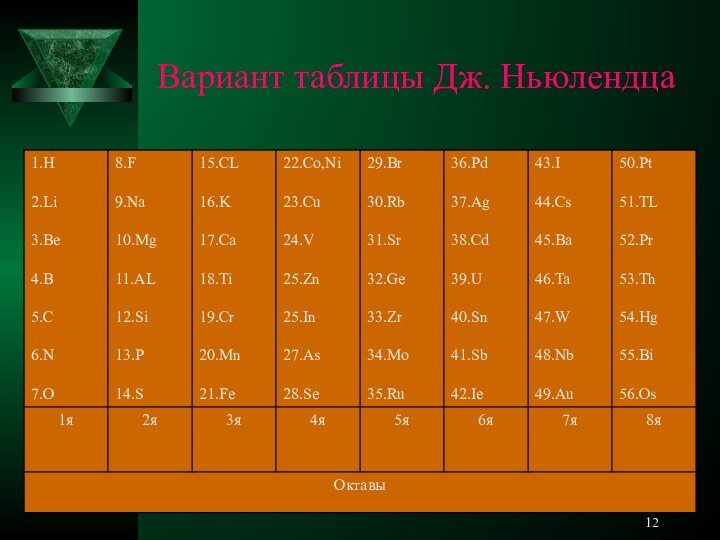
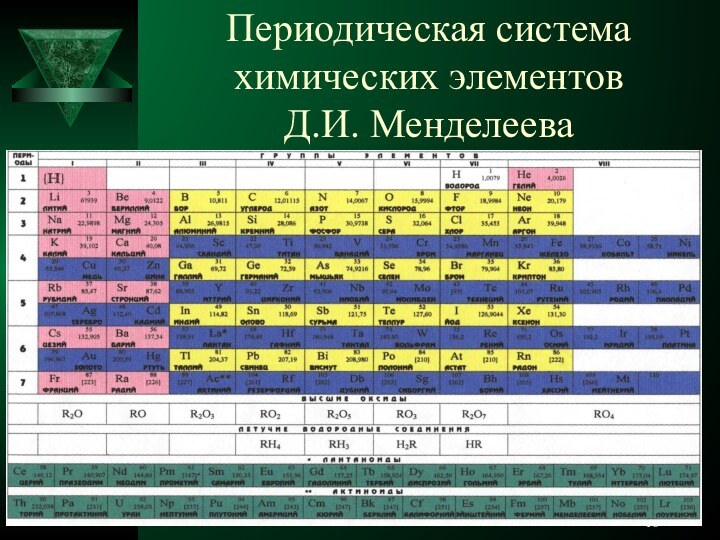
с элементами дидактических игр».Образовательная цель: «Изучить принцип построения, явление периодичности, периодический закон и периодическую систему, структуру периодической системы на основе учения о строении атома».
Развивающая цель:
«Развивать у студентов мышление на основе исторических фактах связывая с современными данными».
Воспитательная цель: «Воспитывать у студентов национальную гордость и патриотизм к своей Родине, при изучении периодического закона и периодической системы Д. И. Менделеева».