- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение атома
Содержание
- 2. Атом какого химического элемента имеет приведенную ниже
- 3. Атом какого химического элемента имеет приведенную ниже
- 4. Сколько электронов находится на внешнем уровне элемента
- 5. Сколько электронов находится на внешнем уровне элемента
- 6. Элементу не хватает 3 электронов до
- 7. Элементу не хватает 3 электронов до
- 8. В атоме элемента число электронов на
- 9. В атоме элемента число электронов на
- 10. Атом элемента содержит на внешнем
- 11. Атом элемента содержит на внешнем
- 12. В атоме элемента два энергетических
- 13. В атоме элемента два энергетических
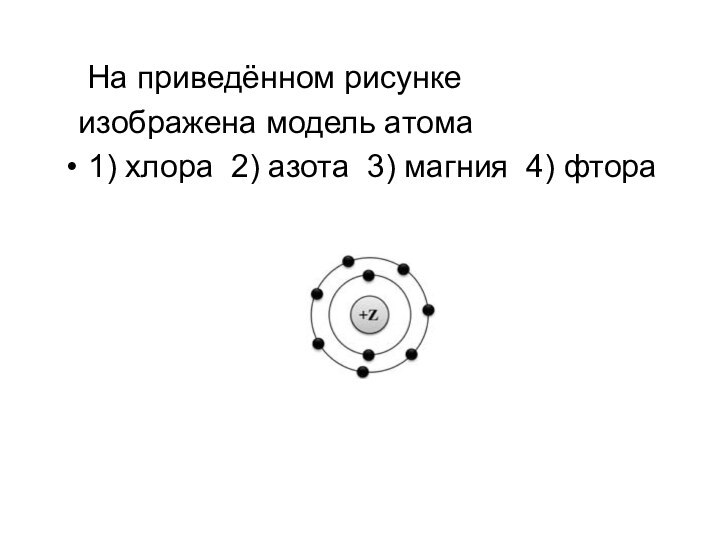
- 14. На приведённом рисунке изображена модель атома1) хлора 2) азота 3) магния 4) фтора
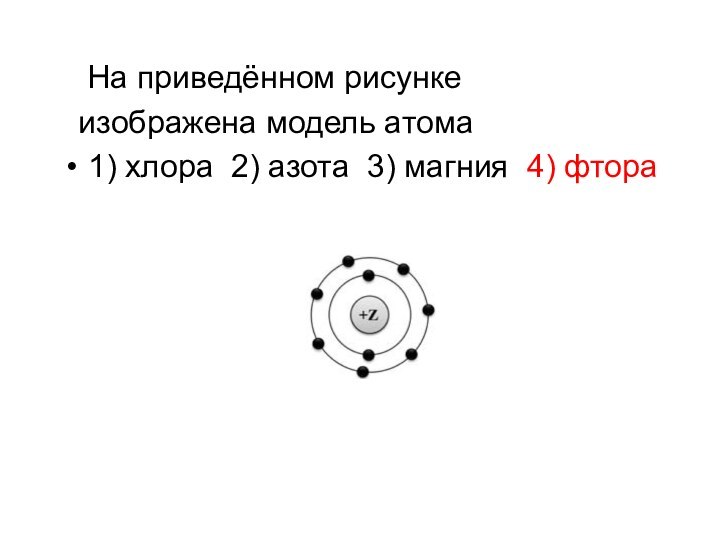
- 15. На приведённом рисунке изображена модель атома1) хлора 2) азота 3) магния 4) фтора
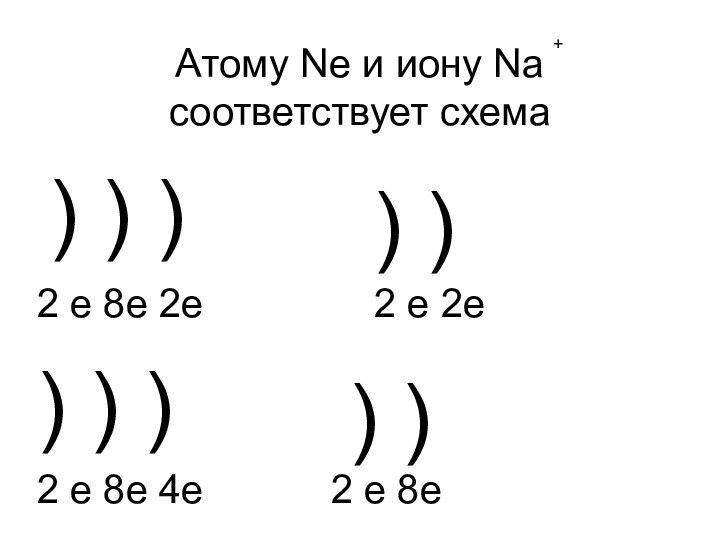
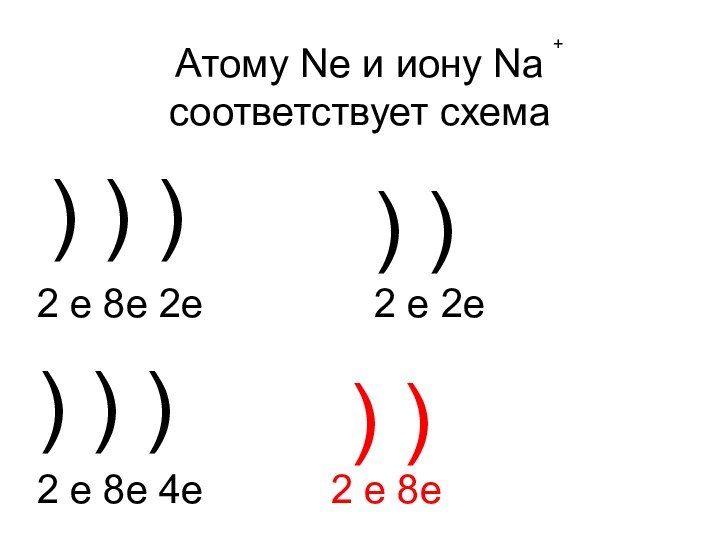
- 16. Атому Ne и иону Na соответствует схема+)
- 17. Атому Ne и иону Na соответствует схема+)
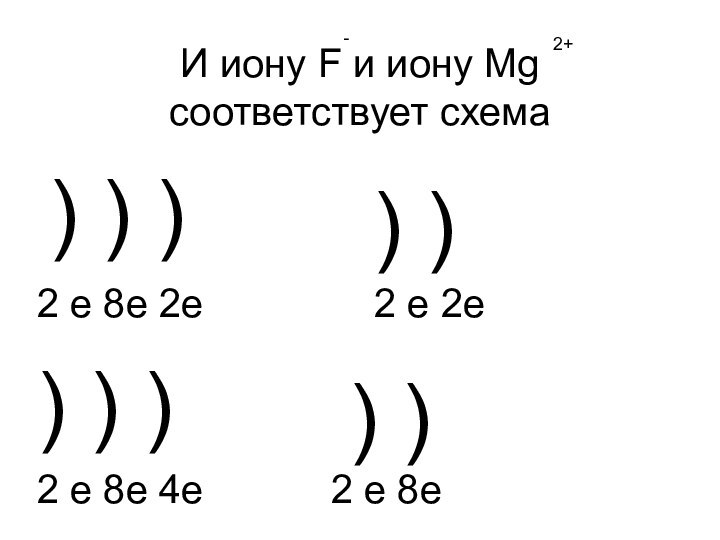
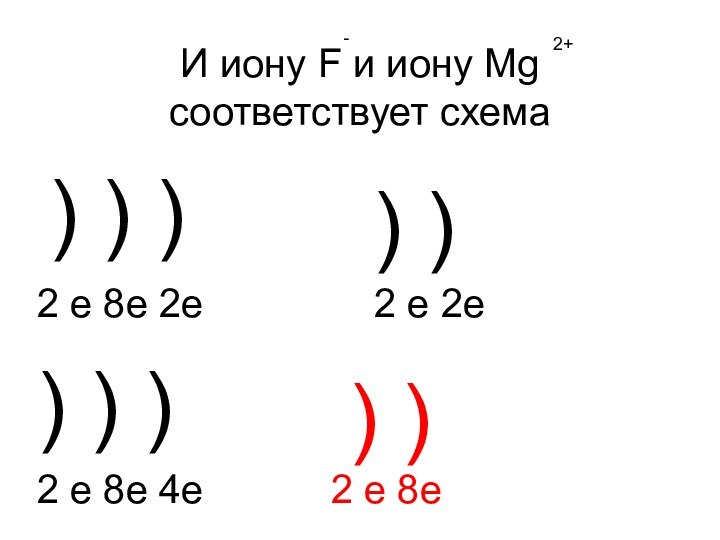
- 18. И иону F и иону Mg соответствует
- 19. И иону F и иону Mg соответствует
- 20. CsFЧисло внешних электронов одинаковоУвеличивается радиус атома Увеличивается
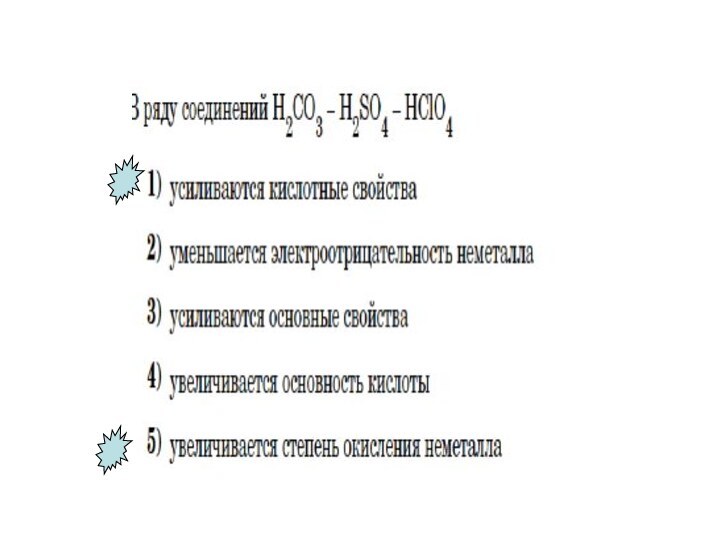
- 21. Усиливаются кислотные свойства при растворении их в
- 22. От кислотных к оснóвным меняются свойства оксидов в ряду 1)
- 23. От кислотных к оснóвным меняются свойства оксидов в ряду 1)
- 24. В ряду O – S
- 25. В ряду O – S
- 26. В каком ряду химических элементов увеличивается радиус
- 27. В каком ряду химических элементов увеличивается радиус
- 28. В каком ряду химических элементов усиливаются неметаллические
- 29. В каком ряду химических элементов усиливаются неметаллические
- 30. Валентность элемента в водородном соединении уменьшается
- 31. Валентность элемента в водородном соединении уменьшается
- 32. Валентность элемента в высшем оксиде растёт в
- 33. Валентность элемента в высшем оксиде растёт в
- 34. В ряду F – Cl – Br
- 35. В ряду F – Cl – Br
- 36. Элемент 3-его периода главной подгруппы II группы
- 37. Элемент 3-его периода главной подгруппы II группы
- 38. Запомни СО, N2O,NO – несолеобразующие оксиды!!! Всем
- 39. Элемент 2- oго периода главной подгруппы
- 40. Элемент 2- oго периода главной подгруппы
- 41. Часть В – выбрать 2 ответа
- 42. В каких рядах элементы расположены в порядке
- 43. В каких рядах элементы расположены в порядке
- 44. 1) N – O – F2) Se
- 45. 1) N – O – F2) Se
- 46. В каком ряду химические элементы расположены в
- 47. В каком ряду химические элементы расположены в
- 52. В ряду химических элементов: Al → Si
- 53. В ряду химических элементов: Al → Si
- 54. В ряду химических элементов Si — Ge — Sn
- 55. В ряду химических элементов Si — Ge — Sn
- 56. В ряду химических элементов C – Si
- 57. В ряду химических элементов C – Si
- 58. В ряду химических элементов Si – P
- 59. Скачать презентацию
- 60. Похожие презентации

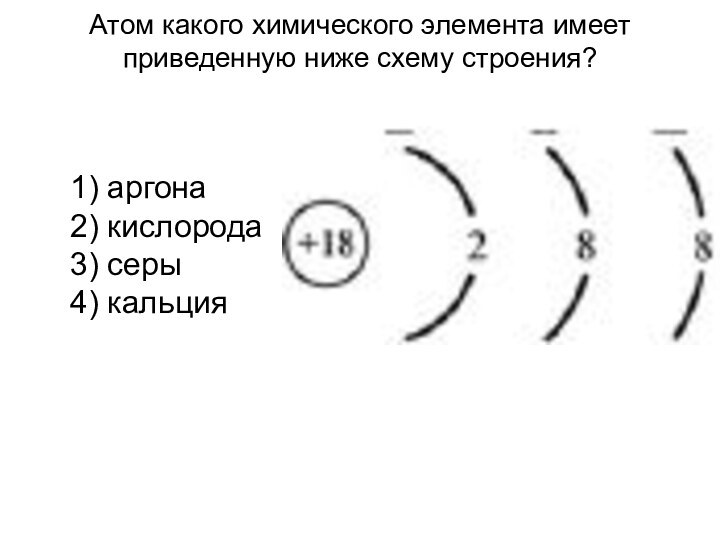
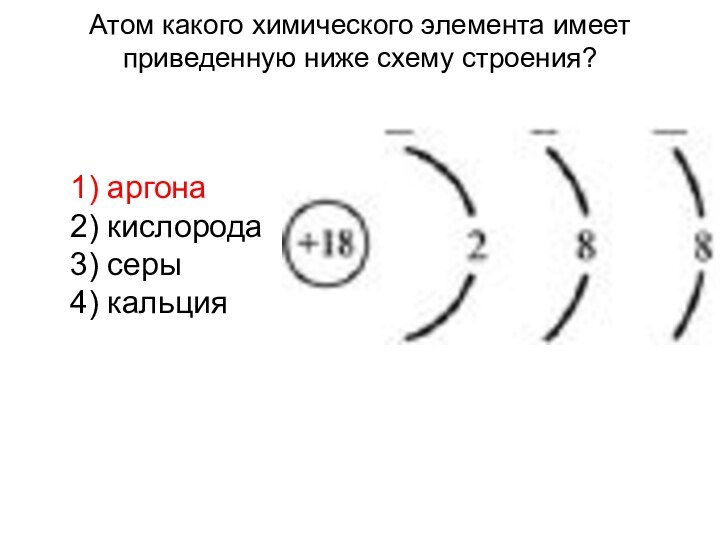















































Слайд 3 Атом какого химического элемента имеет приведенную ниже схему
строения?
1) аргона
2) кислорода
3) серы
4) кальция
Слайд 4 Сколько электронов находится на внешнем уровне элемента с
порядковым номером 13? 1) 3 2) 5
3) 8 4) 13Слайд 5 Сколько электронов находится на внешнем уровне элемента с
порядковым номером 13? 1) 3 2) 5
3) 8 4) 13Слайд 6 Элементу не хватает 3 электронов до завершения
энергетического уровня. Порядковый номер элемента в периодической системе:
1) 3
2) 5 3) 7 4) 11Слайд 7 Элементу не хватает 3 электронов до завершения
энергетического уровня. Порядковый номер элемента в периодической системе:
1) 3
2) 5 3) 7 4) 11Слайд 8 В атоме элемента число электронов на внешнем
уровне в два раза превышает
число внутренних электронов.
Какой это элемент?1) литий 3) кислород 2) углерод 4) сера
Слайд 9 В атоме элемента число электронов на внешнем
уровне в два раза превышает
число внутренних электронов.
Какой это элемент?1) литий 3) кислород 2) углерод 4) сера
Слайд 10 Атом элемента содержит на внешнем энергетическом
уровне 3 электрона. Порядковый номер элемента в периодической
системе:1) 3 2) 5 3) 7 4) 11
Слайд 11 Атом элемента содержит на внешнем энергетическом
уровне 3 электрона. Порядковый номер элемента в периодической
системе:1) 3 2) 5 3) 7 4) 11
Слайд 12 В атоме элемента два энергетических уровня
заполнены электронами, а на
третьем находится 4 электрона. Какой
это элемент?1) кремний 2) углерод 3) кислород 4) сера
Слайд 13 В атоме элемента два энергетических уровня
заполнены электронами, а на
третьем находится 4 электрона. Какой
это элемент?1) кремний 2) углерод 3) кислород 4) сера
Слайд 18
И иону F и иону Mg
соответствует схема
2+
) )
)
) ) )
) )
) )
2 e 8e
2e 2 e 2е
2 e 8e
2 e 8e 4e
-
Слайд 19
И иону F и иону Mg
соответствует схема
2+
) )
)
) ) )
) )
) )
2 e 8e
2e 2 e 2е
2 e 8e
2 e 8e 4e
-
Слайд 20
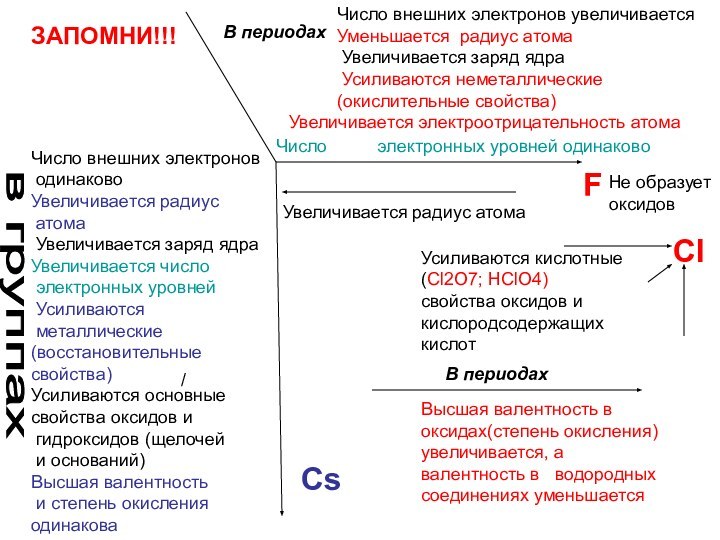
Cs
F
Число внешних электронов
одинаково
Увеличивается радиус
атома
Увеличивается заряд
ядра
Увеличивается число
электронных уровней
Усиливаются
металлические
(восстановительные
свойства)
Усиливаются основные
свойства оксидов
игидроксидов (щелочей
и оснований)
Высшая валентность
и степень окисления
одинакова
Увеличивается радиус атома
/
ЗАПОМНИ!!!
Число внешних электронов увеличивается
Уменьшается радиус атома
Увеличивается заряд ядра
Усиливаются неметаллические (окислительные свойства)
Усиливаются кислотные (Cl2O7; HClO4)
свойства оксидов и
кислородсодержащих кислот
Высшая валентность в оксидах(степень окисления) увеличивается, а валентность в водородных соединениях уменьшается
Увеличивается электроотрицательность атома
Cl
Не образует
оксидов
Число электронных уровней одинаково
в группах
В периодах
В периодах
Слайд 21
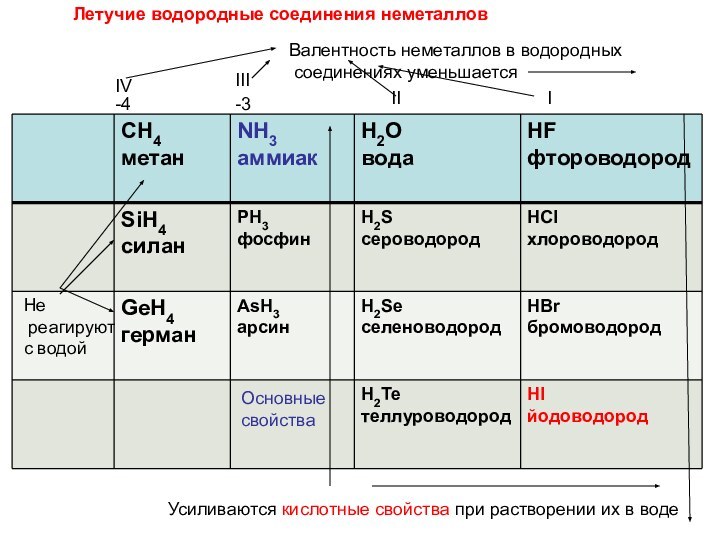
Усиливаются кислотные свойства при растворении их в воде
Основные
свойства
Не
реагируют
с водой
-4
-3
Летучие водородные соединения неметаллов
Валентность неметаллов в водородных
соединениях уменьшаетсяIV
III
II
I
Слайд 22
От кислотных к оснóвным меняются свойства оксидов в ряду
1) CaO →
SiO2 → SO3 2) CO2 → Al2O3 → MgO 3) SO3 → P2O5 → Al2O3 4) Na2O
→ MgO → Al2O3
Слайд 23
От кислотных к оснóвным меняются свойства оксидов в ряду
1) CaO →
SiO2 → SO3 2) CO2 → Al2O3 → MgO 3) SO3 → P2O5 → Al2O3 4) Na2O
→ MgO → Al2O3Слайд 24 В ряду O – S –
Se – Te увеличивается
1) электроотрицательность элемента
2) валентность
элемента в водородном соединении3) высшая степень окисления
4) радиус атома
Слайд 25 В ряду O – S –
Se – Te увеличивается
1) электроотрицательность элемента
2) валентность
элемента в водородном соединении3) высшая степень окисления
4) радиус атома
Слайд 26
В каком ряду химических элементов увеличивается радиус атома?
1)
литий – бериллий – бор
2) кальций – магний
– бериллий3) фосфор – сера – хлор
4) гелий – неон – аргон
Слайд 27
В каком ряду химических элементов увеличивается радиус атома?
1)
литий – бериллий – бор
2) кальций – магний
– бериллий3) фосфор – сера – хлор
4) гелий – неон – аргон
Слайд 28 В каком ряду химических элементов усиливаются неметаллические свойства
соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2)
фтор → азот → углерод3) хлор → бром → иод
4) кремний → сера → фосфор
Слайд 29 В каком ряду химических элементов усиливаются неметаллические свойства
соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2)
фтор → азот → углерод3) хлор → бром → иод
4) кремний → сера → фосфор
Слайд 30 Валентность элемента в водородном соединении уменьшается в
ряду
1) S → Se → Te 3)
Cl → Br → I2) S → P → Si 4) N → O → F
Слайд 31 Валентность элемента в водородном соединении уменьшается в
ряду
1) S → Se → Te 3)
Cl → Br → I2) S → P → Si 4) N → O → F
Слайд 32
Валентность элемента в высшем оксиде растёт в ряду
1)
Be ? B ? C 3) Cl ? Br
? I2) Ca ? Sr ? Mg 4) H ? Li ? Na
Слайд 33
Валентность элемента в высшем оксиде растёт в ряду
1)
Be ? B ? C 3) Cl ? Br
? I2) Ca ? Sr ? Mg 4) H ? Li ? Na
Слайд 34 В ряду F – Cl – Br –
I уменьшается
1) электроотрицательность элемента
2) радиус атома
3) число электронов в
атоме4) число заполненных электронных слоев в атоме
Слайд 35 В ряду F – Cl – Br –
I уменьшается
1) электроотрицательность элемента
2) радиус атома
3) число электронов в
атоме4) число заполненных электронных слоев в атоме
Слайд 36 Элемент 3-его периода главной подгруппы II группы образует высший
гидроксид, общая формула которого
1) Э(ОН)2
2) Н2ЭО3
3) Э(ОН)3
4) НЭО3
Слайд 37 Элемент 3-его периода главной подгруппы II группы образует высший
гидроксид, общая формула которого
1) Э(ОН)2
2) Н2ЭО3
3) Э(ОН)3
4) НЭО3
Слайд 38
Запомни
СО, N2O,NO – несолеобразующие оксиды!!!
Всем другим оксидам
соответствуют гидроксиды:
Оксидам металлов (основным) – основания CaO
Ca(OH)2 - гидроксид кальцияАмфотерным оксидам (Al2O3, BeO,ZnO и Cr2O3) –амфотерные гидроксиды –например Al(OH)3
Оксидам неметаллов (кислотным) – кислоты P2O5 H3PO4 –фосфорная кислота
И основания и кислородные кислоты являются гидроксидами, но формулы кислот
записываются так, что атомы Н впереди и каждая кислота имеет своё конкретное название…
Слайд 39 Элемент 2- oго периода главной подгруппы V группы
образует высший гидроксид, формула которого
1 Э(ОН)2
2 Н2Э
Э(ОН)3
НЭO3
Слайд 40 Элемент 2- oго периода главной подгруппы V группы
образует высший гидроксид, формула которого
1 Э(ОН)2
2 Н2Э
Э(ОН)3
НЭO3
Слайд 42 В каких рядах элементы расположены в порядке усиления
кислотных свойств их летучих водородных соединений?
1) F – Cl
– Br2) As – P – N
3) N – O – F
4) Se – S – O
5) Cl – S – P
Слайд 43 В каких рядах элементы расположены в порядке усиления
кислотных свойств их летучих водородных соединений?
1) F – Cl
– Br2) As – P – N
3) N – O – F
4) Se – S – O
5) Cl – S – P
Слайд 44
1) N – O – F
2) Se –
S – O
3) F – Cl – Br
4) O
– N – C5) Si – P – S
В каких рядах элементы расположены в порядке уменьшения кислотных свойств их летучих водородных соединений?
Слайд 45
1) N – O – F
2) Se –
S – O
3) F – Cl – Br
4) O
– N – C5) Si – P – S
В каких рядах элементы расположены в порядке уменьшения кислотных свойств их летучих водородных соединений?
Слайд 46 В каком ряду химические элементы расположены в порядке
увеличения их электроотрицательности
1) Be – Mg – Ca
2) C
– Si – Ge3) As – P – N
4) Si – Al – Mg
5) Si – P – S
Слайд 47 В каком ряду химические элементы расположены в порядке
увеличения их электроотрицательности
1) Be – Mg – Ca
2) C
– Si – Ge3) As – P – N
4) Si – Al – Mg
5) Si – P – S
Слайд 52 В ряду химических элементов: Al → Si →
P – происходит увеличение
(усиление)
1) числа протонов в ядрах атомов
2)
числа заполняемых электронных слоёв в атомах3)радиуса атомов
4)металлических свойств
5) степени окисления в высших оксидах
Слайд 53 В ряду химических элементов: Al → Si →
P – происходит увеличение
(усиление)
1) числа протонов в ядрах атомов
2)
числа заполняемых электронных слоёв в атомах3)радиуса атомов
4)металлических свойств
5) степени окисления в высших оксидах
Слайд 54
В ряду химических элементов Si — Ge — Sn
1) увеличивается
число электронных слоев в атомах 2) уменьшается число протонов в ядрах атомов 3)
увеличивается значение электроотрицательности 4) усиливается оснóвный характер высших оксидов 5) увеличивается число электронов во внешнем слое атомов
Слайд 55
В ряду химических элементов Si — Ge — Sn
1) увеличивается
число электронных слоев в атомах 2) уменьшается число протонов в ядрах атомов 3)
увеличивается значение электроотрицательности 4) усиливается оснóвный характер высших оксидов 5) увеличивается число электронов во внешнем слое атомовСлайд 56 В ряду химических элементов C – Si –
Ge увеличивается
1) радиус атома
2) высшая степень окисления
3) валентность элемента
в летучем водородном соединении4) число заполненных электронных слоев
5) число электронов на внешнем уровне
Слайд 57 В ряду химических элементов C – Si –
Ge увеличивается
1) радиус атома
2) высшая степень окисления
3) валентность элемента
в летучем водородном соединении4) число заполненных электронных слоев
5) число электронов на внешнем уровне
Слайд 58 В ряду химических элементов Si – P –
S увеличивается
1) радиус атома
2) высшая степень окисления
3) валентность элемента
в летучем водородном соединении4) число заполненных электронных слоев
5) кислотный характер высшего оксида





























