- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сульфатна кислота.
Содержание
- 2. Сульфатна кислота (сірчана кислота, — дигідрогенсульфат, застаріла назва — купоросне масло) —
- 3. ІсторіяСульфатна кислота (або стара назва — купоросне масло) була
- 4. Пізніше поліпшення методу, французьким хіміком Жозефом Луї Гей-Люссаком і
- 5. Знаходження в природі:1. Земля:Вільна сірчана кислота зустрічається
- 6. 2. Знаходження поза межами землі:Сірчана кислота знаходиться
- 7. Виробництво:1. Сировиною для виробництва сірчаної кислоти є
- 8. У 1999 році в Європі було випалено
- 9. Триоксид сірки не розбавляється у воді відразу ж.
- 10. Фізичні властивості:Майже вся 99% сірчана кислота втрачає
- 11. Хімічно чиста сульфатна кислота являє собою важку
- 12. Хімічні властивості:1.Дисоціація у водному розчині йде в
- 13. Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні
- 14. Застосування:Сірчана кислота є дуже важливим товаром хімічної
- 15. Електроліт:Сірчана кислота діє як електроліт в свинцево-кислотних акумуляторах:1.
- 16. Каталізатор:Сірчана кислота використовується, також, для інших цілей
- 17. Безпека:Сірчана кислота дуже їдка. Окрім звичайних властивостей
- 18. Скачать презентацию
- 19. Похожие презентации














Слайд 2 Сульфатна кислота (сірчана кислота, — дигідрогенсульфат, застаріла назва — купоросне масло) — сполукасірки з
Слайд 3
Історія
Сульфатна кислота (або стара назва — купоросне масло) була відома
з давніх часів. Перші згадки про неї можна знайти
в текстах алхіміка Джабіра ібн Хайяна 8-го століття.Можливі методи виробництва описані в працях Альберта Великого (1200–1280) і Василя Валентина (1600).В основі цього методу лежить утворення кислоти з хальканинту, та галунів.Застаріла назва походить від застарілої назви мінералів з яких вона отримувалася — купороси. Перші наукові дослідження, за допомогою сірчаної кислоти провів Йоганн Рудольф Ґляубер. Він провів реакцію між сірчаною кислотою і сіллю та отримав соляну кислоту і сіль яка була названа на його честь — глауберова сіль . Методи, у яких були використані сульфати, були дуже складними і дорогими. Для отримання великих кількостей цієї речовини, в 18-му столітті, розробили процес, в якому було використовувалося спалення сірки і селітри у скляній тарі. Так як скляні посудини були дуже крихкими, то перша реакція була проведена в 1746 році Джоном Робаком, усвинцевих контейнерах. Сірчана кислота створених процесом Джона Робака мала концентрацію тільки 35-40%.Слайд 4 Пізніше поліпшення методу, французьким хіміком Жозефом Луї Гей-Люссаком і англійськім
Джоном Гловером, дало вихід речовини 78% концентрації. Тим не
менше, виробництво деяких барвників та інших хімічних речовин вимагають більш концентрований продукт. Протягом 18-го століття, сірчана кислота отримувалася сухою перегонкою мінералів, процес схожий на оригінальні алхімічні процеси. Пірит (дисульфід заліза, FeS2) нагрівали в повітрі для отримання заліза(II)сульфат, FeSO4, який окислюється при подальшому нагріванні до заліза(III)сульфат Fe2(SO4)3, який, при нагріванні до 480 ° С, розкладається дозаліза(III)оксид і триоксида сірки, який може бути використаний для отримання сірчаної кислоти в будь-якої концентрації. У 1831році британський купець Перегрін Філліпс запатентував контактний процес, який був набагато більш економічний. Сьогодні, майже вся сірчана кислота у світі виробляється з використанням цього методу.
Слайд 5
Знаходження в природі:
1. Земля:
Вільна сірчана кислота зустрічається в
природі дуже рідко. В атмосфері вона утворюється з діоксиду сірки, який утворюється
при згоранні сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється гідроксильними радикалами та киснем з утворенням триоксиду сірки, який вступаючи в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також можна знайти в деяких вулканічних джерелах, які називаються сольфатари. Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати, зустрічається в природі набагато частіше. Існує багато різних мінералів сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 · 2 H2O), барит (BaSO4), Халькантит(CuSO4 · 5 H2O) і глауберова сіль (Na2SO4 · 10 H2O).
Слайд 6
2. Знаходження поза межами землі:
Сірчана кислота знаходиться за
межами Землі в верхніх шарах атмосфери Венери. Вона утворюється в результаті фотохімічних реакцій діоксиду сірки
і води, які утворюють краплі 80-85% кислоти. У більш глибоких шарах, кислота розпадається через високі температури знову на діоксид сірки, і воду, які піднімаючись догори знову можуть утворювати сірчану кислоту. Інфрачервоні спектри які були отримані апаратом Галілео показують різні ступені поглинань на супутнику Юпітера, які були віднесені до одного або кількох видів гідратів сульфатної кислоти.
Слайд 7
Виробництво:
1. Сировиною для виробництва сірчаної кислоти є елементарна сірка яку
отримують в величезних кільскостях на нафто- та газовопереробних заводах, з сірководню,
за допомогою процесу, який відомий як процес Клауса. Потім сірку оксилюють до діоксиду сірки:Реакція сірки з киснем
2. Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
Реакція під час випалу сульфіду цинку
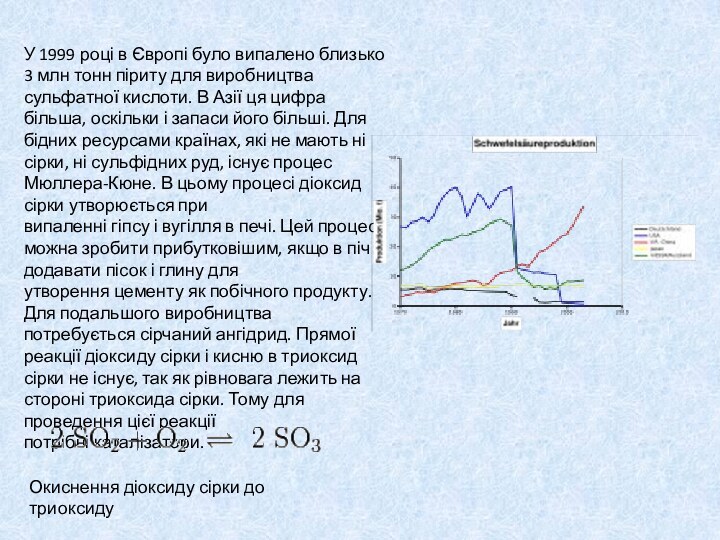
Слайд 8 У 1999 році в Європі було випалено близько
3 млн тонн піриту для виробництва сульфатної кислоти. В Азії ця цифра
більша, оскільки і запаси його більші. Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту. Для подальшого виробництва потребується сірчаний ангідрид. Прямої реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага лежить на стороні триоксида сірки. Тому для проведення цієї реакції потрібні каталізатори.Окиснення діоксиду сірки до триоксиду
Слайд 9 Триоксид сірки не розбавляється у воді відразу ж. Спочатку
його вводять у концентровану сірчану кислоту, цей розчин називають — олеумом.
Потім олеум розчиняють у воді до утворення сірчаної кислоти.Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло в основному в Китаї, у той час як в європейських країнах, виробництво скоротилося.
Слайд 10
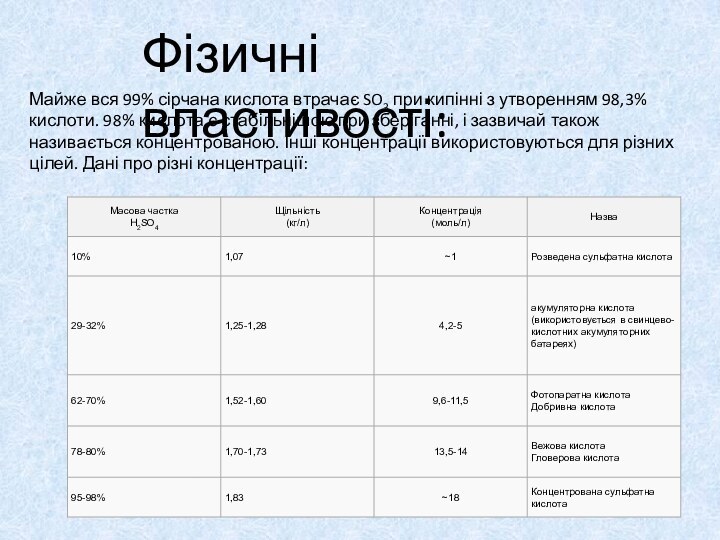
Фізичні властивості:
Майже вся 99% сірчана кислота втрачає SO3 при кипінні з
утворенням 98,3% кислоти. 98% кислота є стабільнішою при зберіганні,
і зазвичай також називається концентрованою. Інші концентрації використовуються для різних цілей. Дані про різні концентрації:Слайд 11 Хімічно чиста сульфатна кислота являє собою важку безбарвну
маслянисту рідину. Продається звичайно її 96,5% — ий водний розчин густиною
1,84 г/см3 або так званий«олеум», тобто розчин SO3 в H2SO4. У воді H2SO4 розчиняється дуже добре (змішується з водою в необмежених кількостях). При цьому виділяється тепло, і розчин дуже сильно нагрівається (навіть до кипіння води). Тому при додаванні води до концентрованої сульфатної кислоти остання розбризкується внаслідок швидкого перетворення води в пару. Через це при розведенні концентрованої H2SO4 треба кислоту вливати у воду (а не навпаки!) тонким струменем при старанному розмішуванні розчину скляною паличкою. Концентрована сульфатна кислота як і чиста вода погано проводить струм внаслідок малої дисоціаціїї, питома електропровідність 1,044 · 10−2S/см
Слайд 12
Хімічні властивості:
1.Дисоціація у водному розчині йде в декілька
етапів:
Перший етап дисоціації;K2 = 2.4 x 106 (сильна кислота)
2. Це
значення кислотності взяте як основне при визначені суперкислот.Друга стадія дисоціаціїї;K1 = 1.0 x 10−2
Слайд 13 Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо.
Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота
віднімає від них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни.Реакція міді з концентрованою сульфатною кислотою
Слайд 14
Застосування:
Сірчана кислота є дуже важливим товаром хімічної промисловості
і є індикатором її промислової потужності.Світове виробництво в 2004
році склало близько 180 млн тон, при наступному географічному розподілі: Азія 35%, Північна Америка 24%,Африка11%, Західна Європа 10%, Східна Європа і Росія 10%, Австралія і Океанія 7%, Південна Америка 7%. Більша частина виробленої кислоти (~ 60%) витрачається на виробництво добрив, суперфосфату фосфату амонію,сульфатів, сульфату амонію. Близько 20% використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників,фармацевтичних препаратів, інсектицидів,
антифризу, а також для різних технічних процесів.
Близько 6% використовують для виробництва
пігментів, фарб, емалей, типографських фарб.
Використовується також як осушувач газів.
Слайд 15
Електроліт:
Сірчана кислота діє як електроліт в свинцево-кислотних акумуляторах:
1. На аноді:
Pb
+ 3 SO2−4 ⇌ PbSO4 + 2 e−
2. На катоді:
PbO2 + 4 H+ + SO2−4 +
2 e− ⇌ PbSO4 + 2 H2O3. Загалом:
Pb + PbO2 + 4 H+ + 2 SO2−4 ⇌ 2 PbSO4 + 2 H2O