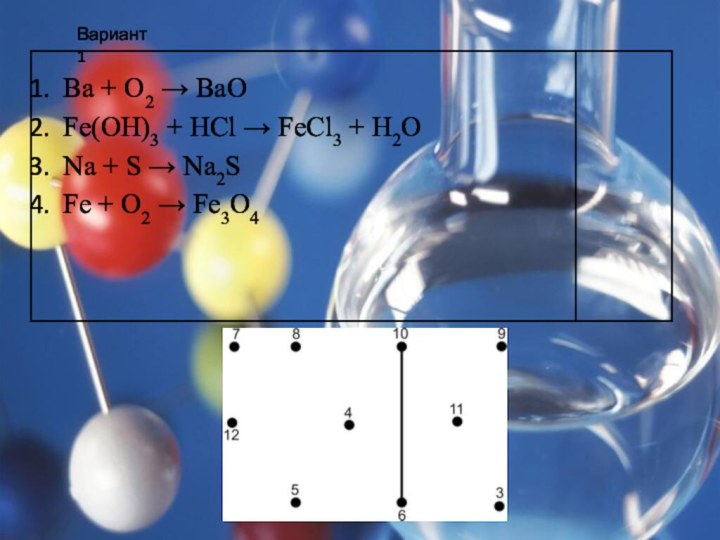
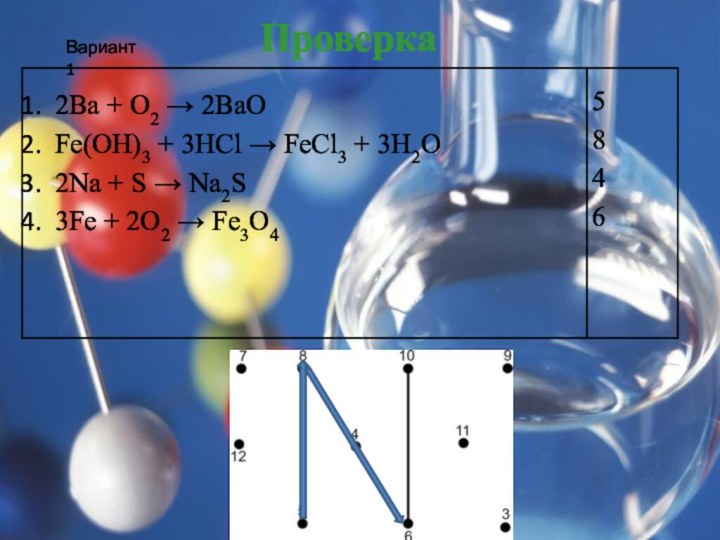
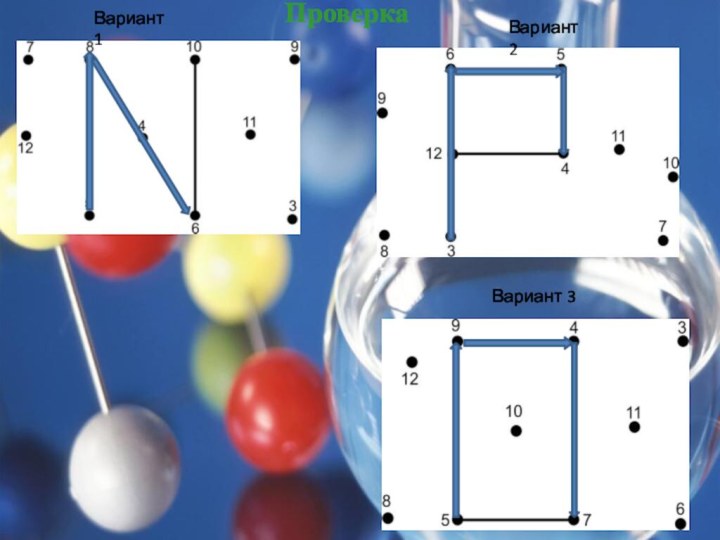
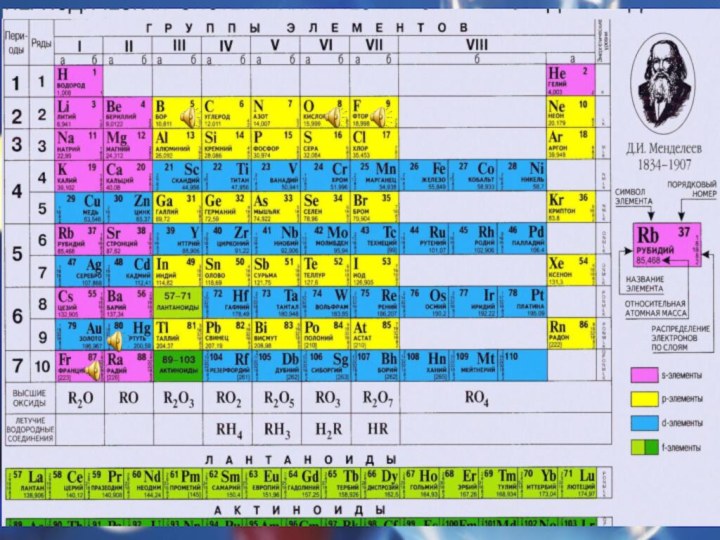
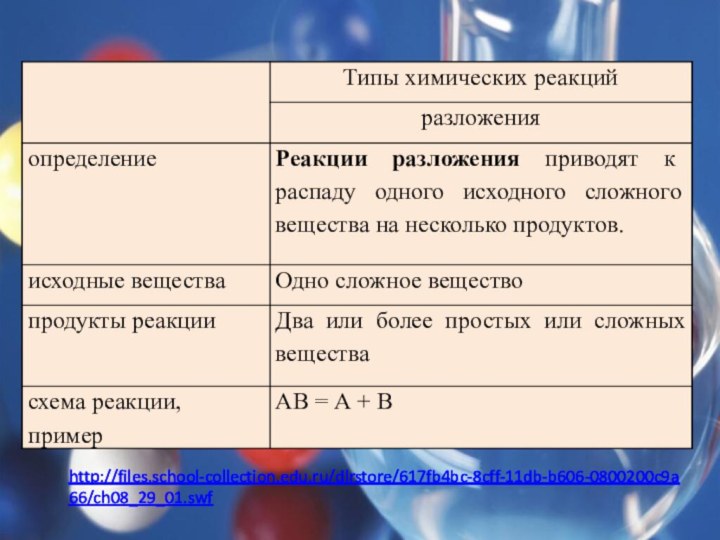
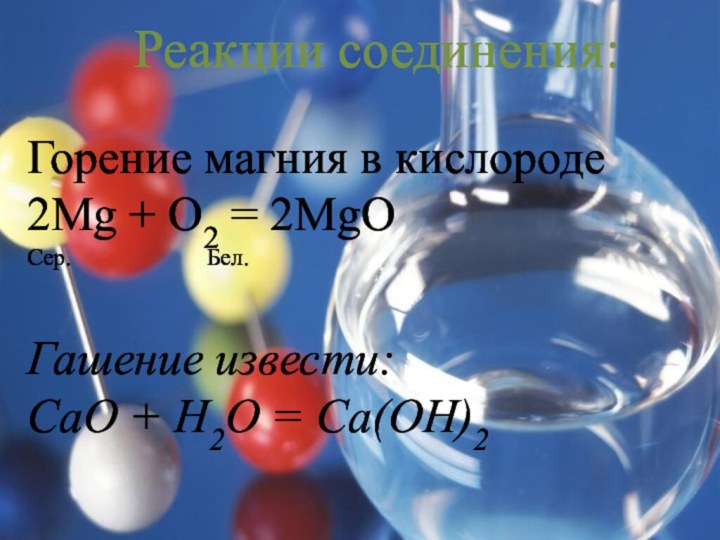
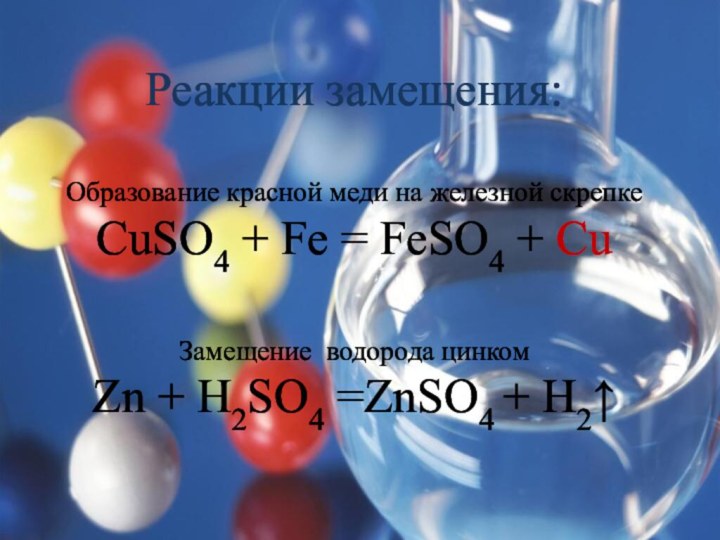
Теологи прошлого
утверждали, чтохимией интересовался уже Адам, которого
привлекала проблема искусственного
получения золота.
В дальнейшем химическими
экспериментами успешно занимался
Иисус Христос, превращавший воду
в вино.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть