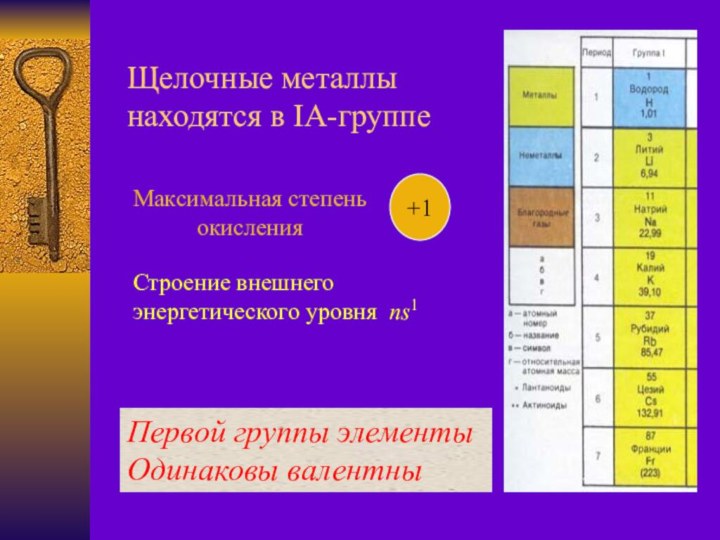
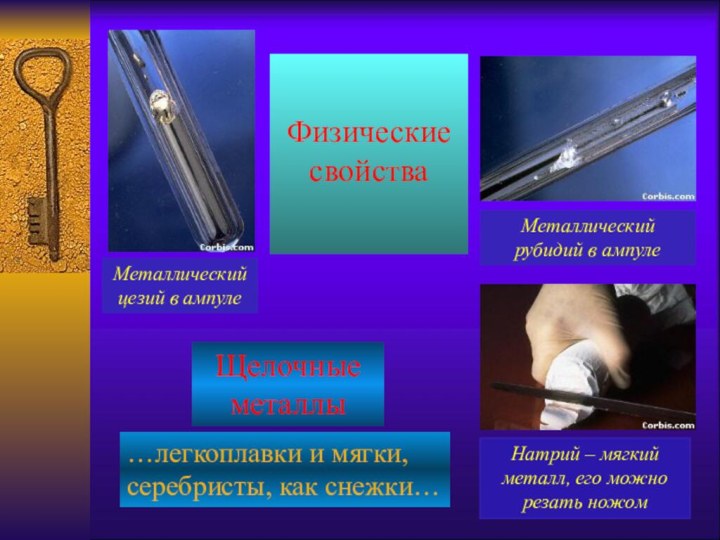
Арведсоном в 1817 г. по предложению Й.Берцелиуса назван литием
(от греч. литос – камень).Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей.
Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь).
Гемфри Дэви
(1778 – 1829)
Йенс-Якоб Берцелиус (1779–1848)