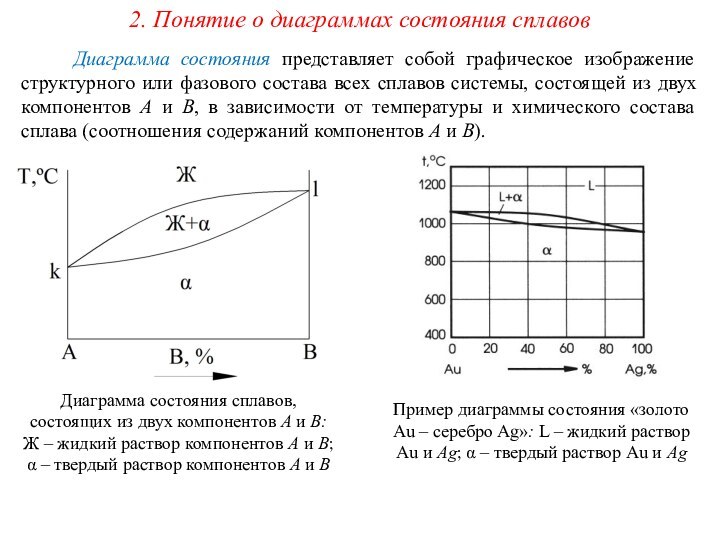
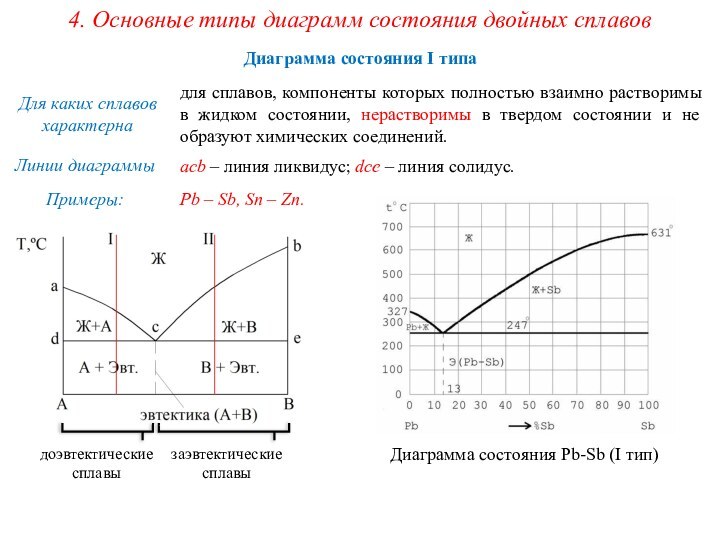
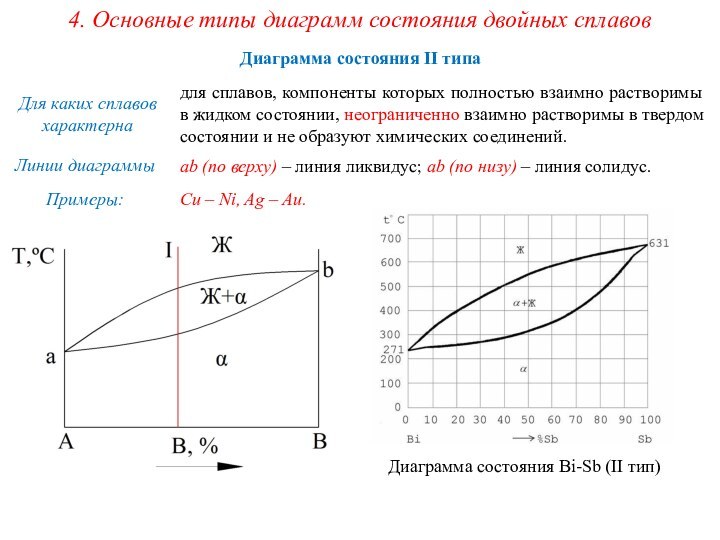
сплавах
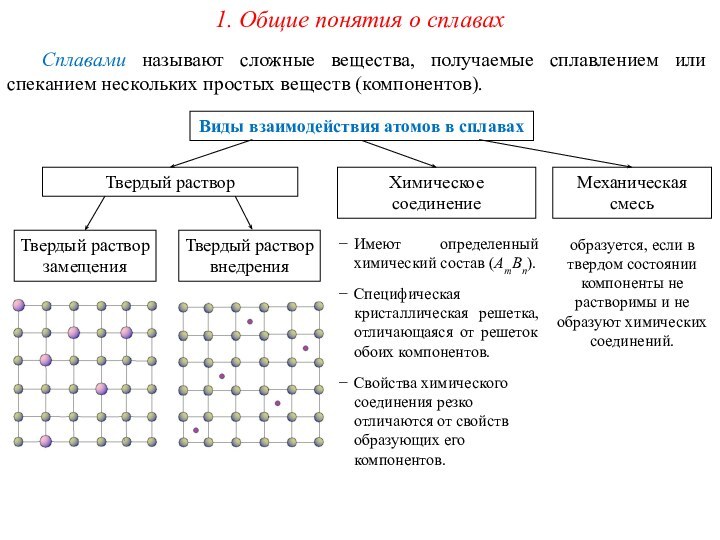
Сплавами называют сложные вещества, получаемые сплавлением или спеканием нескольких
простых веществ (компонентов). Твердый раствор
Химическое соединение
Механическая смесь
Твердый раствор замещения
Твердый раствор внедрения
Имеют определенный химический состав (АmВn).
Специфическая кристаллическая решетка, отличающаяся от решеток обоих компонентов.
Свойства химического соединения резко отличаются от свойств образующих его компонентов.
образуется, если в твердом состоянии компоненты не растворимы и не образуют химических соединений.