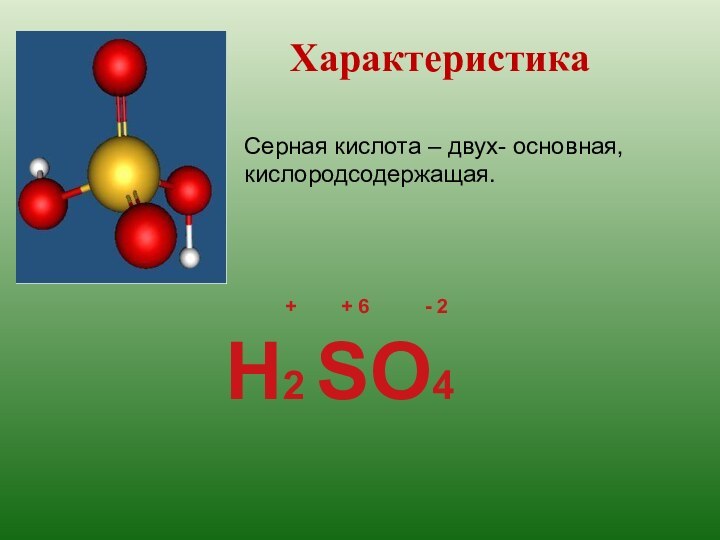
+ + 6
- 2H2 SO4
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




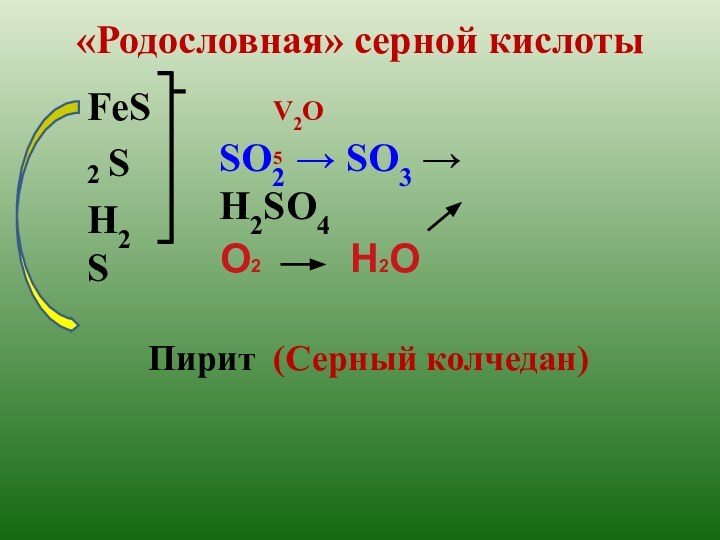
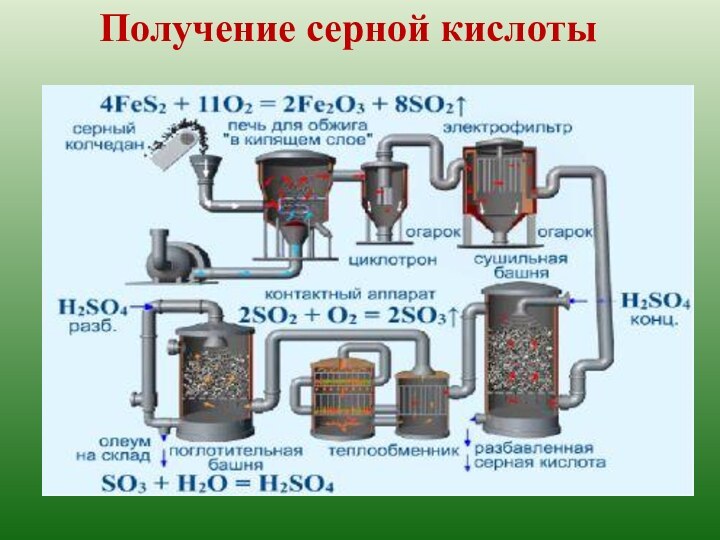














t кип. = 340ºС
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
Cu0 + 2е → Cu+2
S+6 + 2е→ S+4
Cu0 + 2H2S+6O4 → S+4O2 + Cu+2SO4 + 2H2О
Cu + H2SO4 → SO2 + CuSO4 + H2О
1 окислитель
1 восстановитель
2
2
При нагревании концентрированная серная кислота может окислять отдельные неметаллы, а также различные неорганические вещества проявляющие восстановительные свойства.
ZnO + 2H+ → Zn2+ + H2O