- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Вода з точки зору хімії
Содержание
- 2. У молекулі води є
- 3. Між молекулами води існують водневі
- 4. Розглянемо на малюнку утворення зв'язків в молекулі
- 5. Вода одночасно і проста, і
- 6. Молекули води з’єднані між собою
- 7. Вода — єдина речовина
- 8. При переході від рідкого
- 9. Жесткость водыОбщаяНекарбонатная (постоянная)Карбонатная (временная)
- 10. ОксидиОсновніАмфотерніКислотніТверді речовиниЧастіше не розчинні у водіМожуть бути:
- 13. Скачать презентацию
- 14. Похожие презентации
У молекулі води є два ковалентні зв'язки між атомами Оксигену і Гідрогену. Через велику різницю електроактивності в бік Оксигену(3,5) і Гідрогену (2,2), електронні хмари зміщені в бік Оксигену, внаслідок чого молекула води являє












Слайд 3 Між молекулами води існують водневі зв'язки,
завдяки яким молекули сполучаються між собою,утворюючи так звані кластери
і клатрати (асоціати). Сила водневого зв'язку між молекулами води у 20 разів менша за силу ковалентного зв'язку Н-О у самій молекуліСлайд 4 Розглянемо на малюнку утворення зв'язків в молекулі води
між атомами Гідрогену та Оксигеном, елементами неметалами. Спільна електронна
пара зміщена до більш електронегативного елементу Оксигену, тому тип ковалентного зв'язку – ковалентний полярний. Але дана схема не передає просторове розміщення атомів. Молекула води має кутову будову і кут зв'язку між атомами 104,5 градусівСлайд 5 Вода одночасно і проста, і складна
речовина. Її молекула складається з трьох атомів — двох
атомів водню та одного атому кисню. Водночас, вода має такі особливості будови, які зумовлюють ряд її незвичайних, майже магічних властивостейСлайд 6 Молекули води з’єднані між собою водневими
зв’язками. Ці слабкі зв’язки між позитивно зарядженими атомами водню
та від’ємним зарядом атомів кисню іншої молекули визначають фізичні, а також деякі хімічні властивості води.Слайд 7 Вода — єдина речовина на
Землі, яка зустрічається у трьох агрегатних станах: твердому, рідкому
та газоподібному. За нормальних умов, температура замерзання чистої води дорівнює 0 градусів Цельсія, а кипіння - відповідно 100 градусів Цельсія, що покладено в основу температурної шкали Цельсія. В залежності від атмосферного тиску, наприклад, на висоті, де тиск нижчий, температура кипіння води теж знижується. Розчинення різних речовин у воді знижує її температуру замерзанняСлайд 8 При переході від рідкого до
твердого стану густина і вага майже всіх речовин збільшується.
На відміну від них, вода збільшує свій об’єм і стає легшою при замерзанні. Ця властивість має велике значення для збереження життя у водних об’єктах узимку. Лід утворюється на поверхні водойми і захищає її від повного промерзання. Падаюча крапля дощу розчиняє різні гази
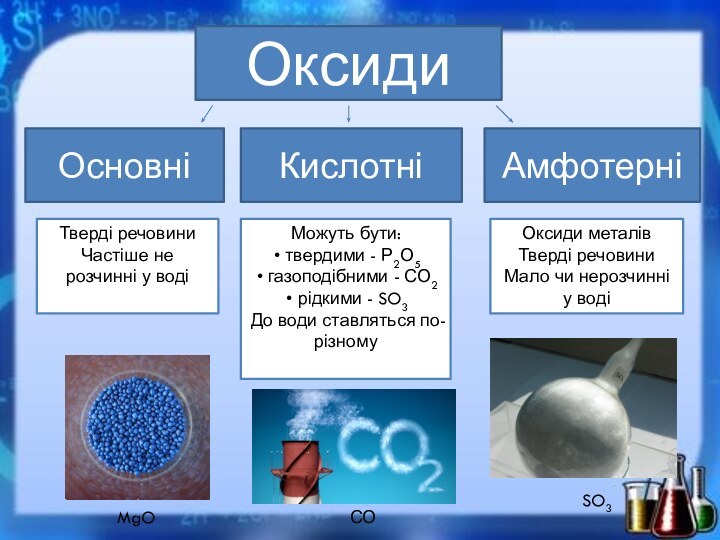
Слайд 10
Оксиди
Основні
Амфотерні
Кислотні
Тверді речовини
Частіше не розчинні у воді
Можуть бути:
твердими
- Р2О5
газоподібними - СО2
рідкими - SO3
До води
ставляться по-різномуОксиди металів
Тверді речовини
Мало чи нерозчинні у воді
MgO
СО2
SO3





























