Слайд 2
Углеводы
Углеводы
– органические вещества, молекулы которых состоят из атомов углерода,
водорода и кислорода, причем водород и кислород находятся в них, как правило, в таком же соотношении, как и в молекуле воды (2:1).
Общая формула углеводов – Cn(H2O)m, т.е. они как бы состоят из углерода и воды, отсюда и название класса, которое имеет исторические корни.
Углеводы можно разделить на три основные группы: моносахариды, дисахариды и полисахариды.
Слайд 3
Моносахариды
Моносахариды – углеводы, которые
не подвергаются гидролизу. В свою очередь, в зависимости от
числа атомов углевода моносахариды подразделяются на триозы, тетрозы, пентозы, гексозы и т. д.
В природе моносахариды представлены преимущественно пентозами и гексозами.
К гексозам, имеющим общую молекулярную формулу С6Н12О6, относят, например, фруктозу и глюкозу.
Слайд 4
Дисахариды
Дисахариды – углеводы, которые
гидролизуются с образованием двух молекул моносахаридов, например гексоз.
К дисахаридам
относится: сахароза, мальтоза, лактоза.
Сладкий вкус разных моно- и дисахаридов различен. Так, самый сладкий моносахарид – фруктоза – в полтора раза слаще глюкозы, которую принимают за эталон.
Слайд 5
Полисахариды
Полисахариды - крахмал, гликоген, декстрины,
целлюлоза…- углеводы, которые гидролизуются с образованием множества молекул моносахаридов,
чаще всего глюкозы. Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Они принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
Слайд 6
Серная кислота
Серная кислота –
один из основных продуктов химической промышленности.
Специфические свойства концентрированной
серной кислоты:
Концентрированная серная кислота – сильный окислитель: при нагревании она реагирует почти со всеми металлами (исключение Au, Pt и некоторые другие). В этих реакциях в зависимости от активности металла и условий выделяется SO2, H2S, S.
Концентрированная серная кислота энергично реагирует с водой с образованием гидратов.
Концентрированная серная кислота отщепляет от органических веществ водород и кислород в виде воды, обугливая их.
Слайд 7
Явление дегидратации углеводов хорошо известно на
примере обугливания сахара под действием концентрированной серной кислоты. Данная
реакция является характерной для углеводов. Серная кислота аналогичным образом действует на другие углеводсодержащие продукты и углеводы. Скорость протекания реакции и внешние признаки определяются типом углевода.
Слайд 8
Цель исследования:
Определение зависимости скорости дегидратации углеводов от условий
протекания реакции.
Задачи исследования:
Познакомиться со специфическими свойствами концентрированной серной кислоты.
Выяснить как концентрированная серная кислота и раствор воздействует на углеводы.
Объекты исследования:
Сахароза, фруктоза, галактоза, лактоза, глюкоза, крахмал, мед, попкорн, мука пшеничная, белый хлеб, спагетти.
Слайд 9
Методика эксперимента
В стакан на 50 или 100
мл помещали 10 г образца углевода или углеводсодержащего продукта,
добавляли 10 мл концентрированной серной кислоты и аккуратно размешивали до образования однородной массы.
Из соображений безопасности стакан устанавливали в чашу с песком.
Через некоторое время появляются признаки реакции: смесь приобретает желтоватый оттенок, затем темнеет и становится черной, вслед за этим начинается вспенивании: в стакане образуется пористый углеродистый столб черного цвета.
Cn(H2O)m+H2SO4 → nCn+H2SO4*mH2O
Слайд 10
Практическая работа
Исследуя зависимость скорости дегидратации от
условий протекания реакции, в стакан перед добавлением серной кислоты
помещали определенный объем воды. В процессе выполнения опыта фиксировали характерные кинетические параметры реакции: t(1) – время появления первых признаков почернения и t(2) – время, когда высота углеродистого столба достигает отметки 100 или 50 мл на стакане.
Оборудование и материалы:
концентрированная серная кислота, дистиллированная вода, образцы углеводов, стаканы на 50-100 мл, чашки Петри, стеклянные палочки, секундомер, учебно-лабораторный комплекс, резиновые перчатки, защитные очки, халат, песок, питьевая сода (NaHCO3).
Слайд 11
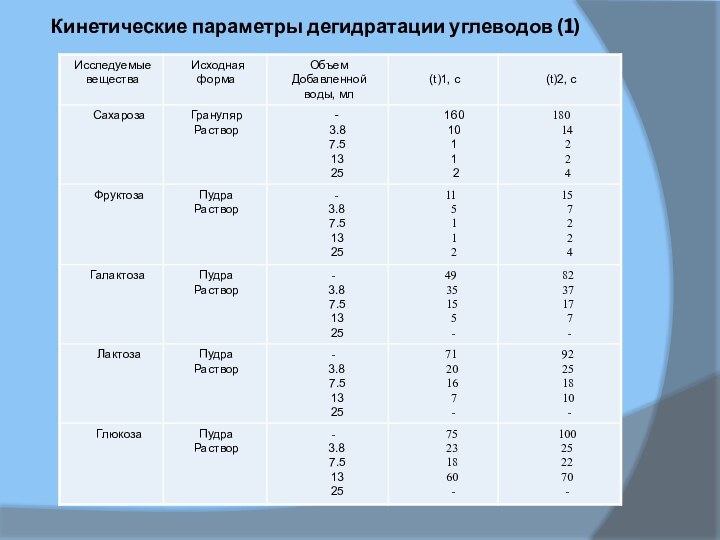
Кинетические параметры дегидратации углеводов (1)
лактоза
глюкоза
галактоза
фруктоза
Слайд 13
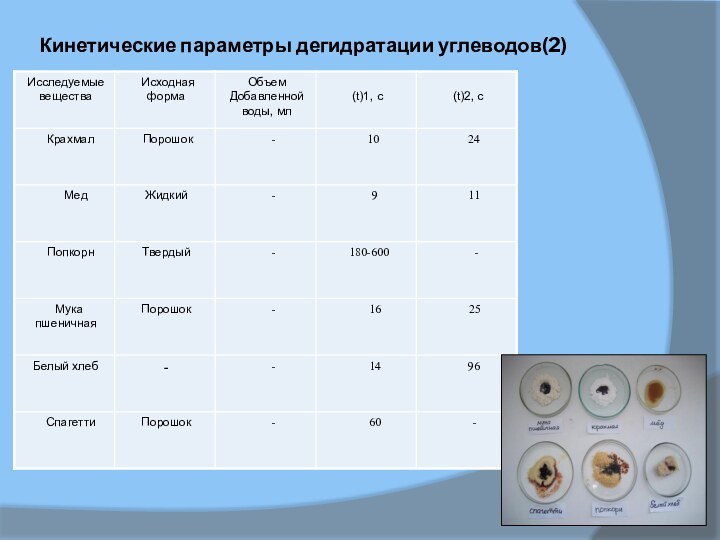
Кинетические параметры дегидратации углеводов(2)
Слайд 15
Результаты исследования
В таблице 1и 2 приведены результаты,
полученные при дегидратации ряда углеводов в разных ситуациях. Параметры
t(1) и t(2) довольно индивидуальны для каждого углевода, однако использовать их не посредственно для идентификации разных сахаров затруднительно, так как кинетика реакции во многом определяется исходной формой реагента и количеством добавляемой воды. Например, в случае сахарозы наибольшая скорость разложения достигается для сахарной пудры, увеличение объема воды сначала повышает скорость реакции, а затем (свыше 50 мл) снижает ее до нуля.
Слайд 16
Исследование основано на том, что разные углеводы обугливаются
серной кислотой с разной скоростью, поэтому можно не только
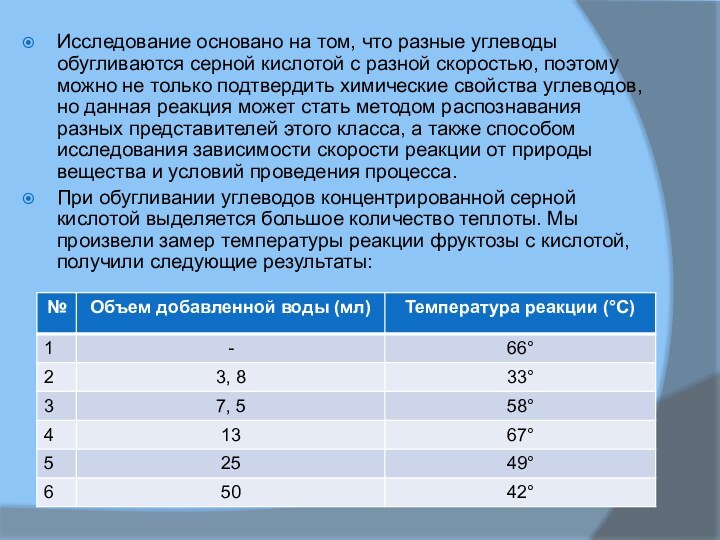
подтвердить химические свойства углеводов, но данная реакция может стать методом распознавания разных представителей этого класса, а также способом исследования зависимости скорости реакции от природы вещества и условий проведения процесса.
При обугливании углеводов концентрированной серной кислотой выделяется большое количество теплоты. Мы произвели замер температуры реакции фруктозы с кислотой, получили следующие результаты:
Слайд 17
Выводы
Дегидратация
сахаров зрелищна и эффектна.
Мы научились экспериментально определять простейшие кинетические
характеристики при обугливании углеводов.
С помощью полученных результатов можно практически распознавать углеводы.
Нужно учитывать, что концентрированная серная кислота очень опасна и при работе с ней нужно быть предельно осторожными.
Слайд 18
Техника безопасности:
Опыт выполняется в защитных
очках и резиновых перчатках. Если пена выходит за пределы
стакана, необходимо накрыть его сверху большим стаканом. Для нейтрализации остатков кислоты реакционную смесь помещают в большую емкость и обрабатывают небольшими порциями гидрокарбоната натрия (на 40 мл концентрированной серной кислоты – около 121 г питьевой соды).
Слайд 19
Список литературы:
1. Артеменко А. И. Органическая химия. М.:
Высшая школа, 2001.
2.Головнер В. Н. Химия. Интересные уроки. Из
зарубежного опыты преподавания. 8-11 классы. М.: НЦ ЭНАС, 2002.
3. Карцова А. А. Покорение вещества. Органическая химия. СП.: Химиздат, 1999.
4. Цветков Л.А. Эксперимент по органической химии в средней школе. Методика и техника. М.: Школьная пресса, 2000.