- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Защита спиртовой -ОН группы
Содержание
- 2. Защита спиртовых гидроксильных группПростые эфиры Сложные эфирыАцетали и кетали
- 3. Простые эфирыМетиловый эфир соответствующего спирта получают действием
- 5. Метиловые эфиры очень устойчивы как в основных,
- 6. Трет-бутиловый эфир получают при взаимодействии спирта с
- 7. Аллиловый эфир получают действием на спирты аллилбромида
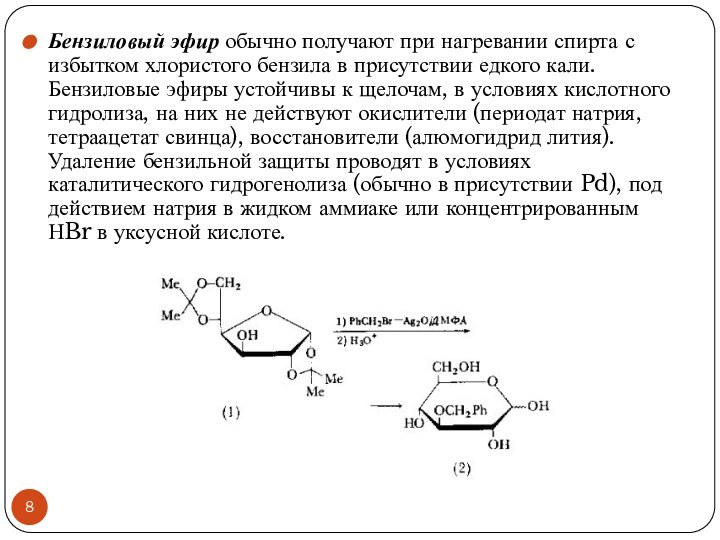
- 8. Бензиловый эфир обычно получают при нагревании спирта
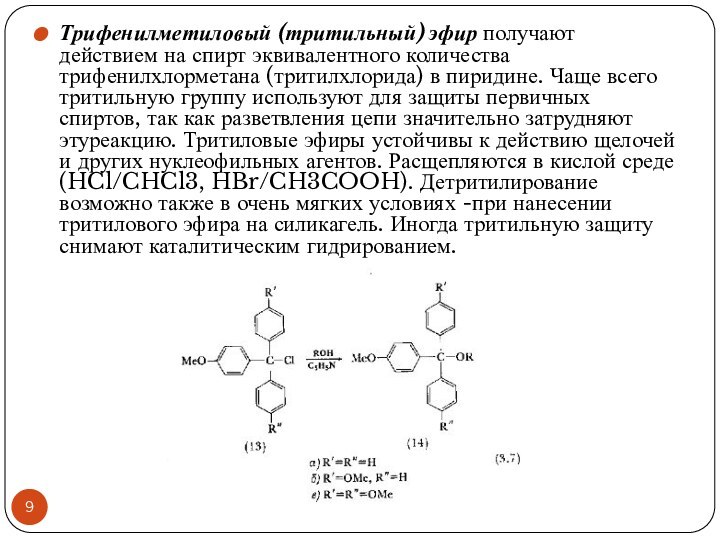
- 9. Трифенилметиловый (тритильный) эфир получают действием на спирт
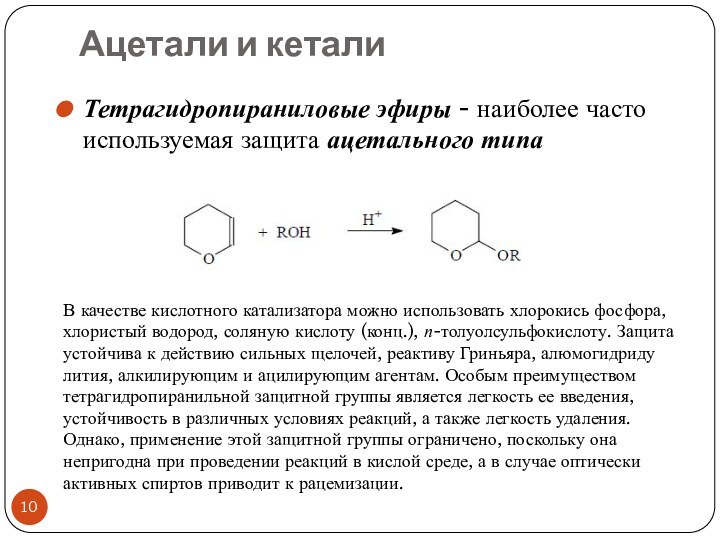
- 10. Ацетали и кеталиТетрагидропираниловые эфиры - наиболее часто
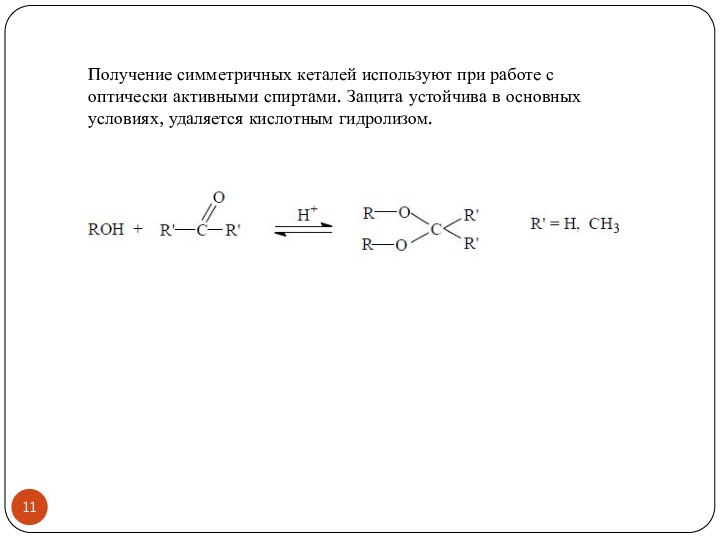
- 11. Получение симметричных кеталей используют при работе с
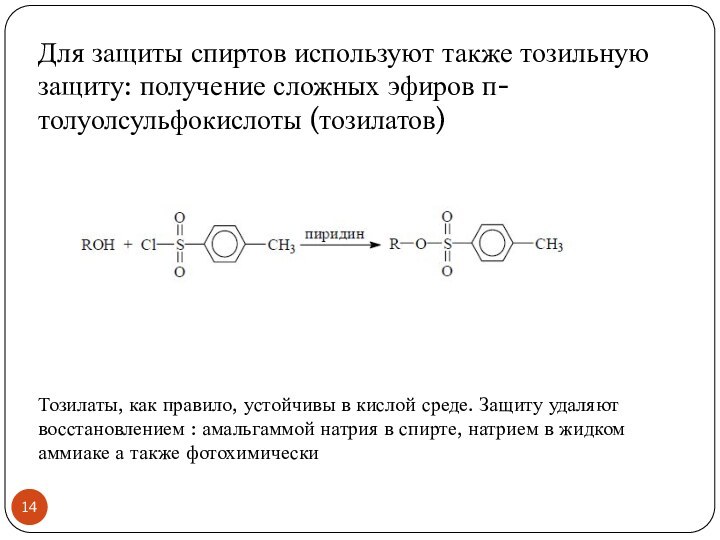
- 12. Сложные эфирыПолучение сложных эфиров – наиболее распространенный
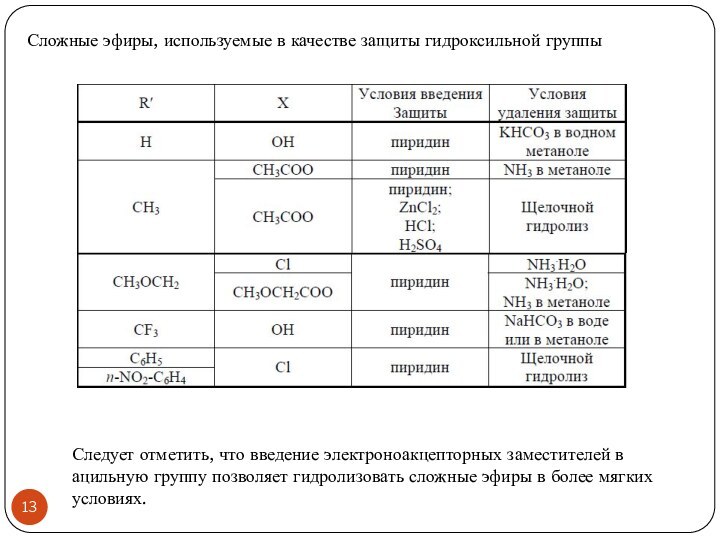
- 13. Сложные эфиры, используемые в качестве защиты гидроксильной
- 14. Скачать презентацию
- 15. Похожие презентации
Защита спиртовых гидроксильных группПростые эфиры Сложные эфирыАцетали и кетали





Слайд 3
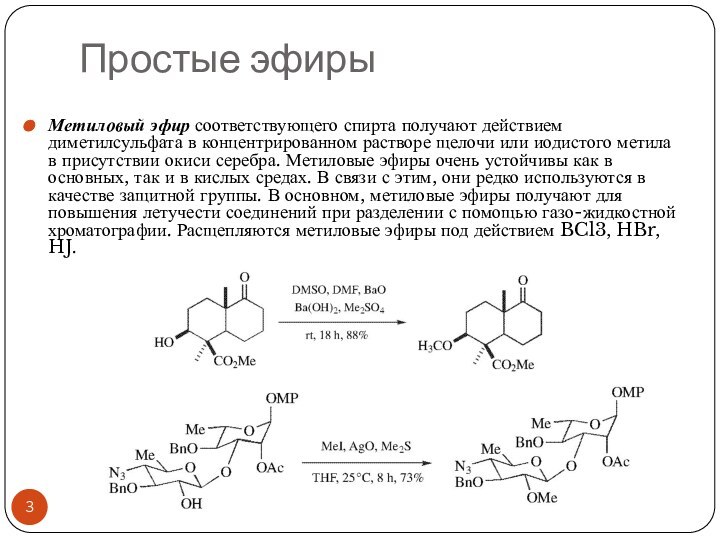
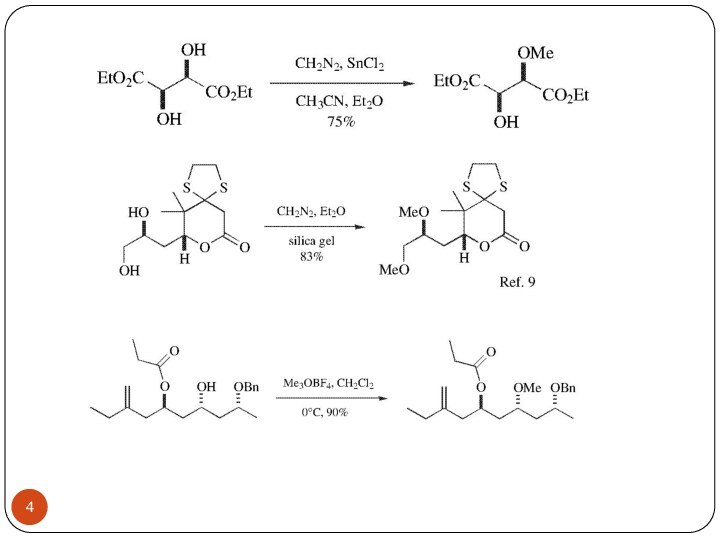
Простые эфиры
Метиловый эфир соответствующего спирта получают действием диметилсульфата
в концентрированном растворе щелочи или иодистого метила в присутствии
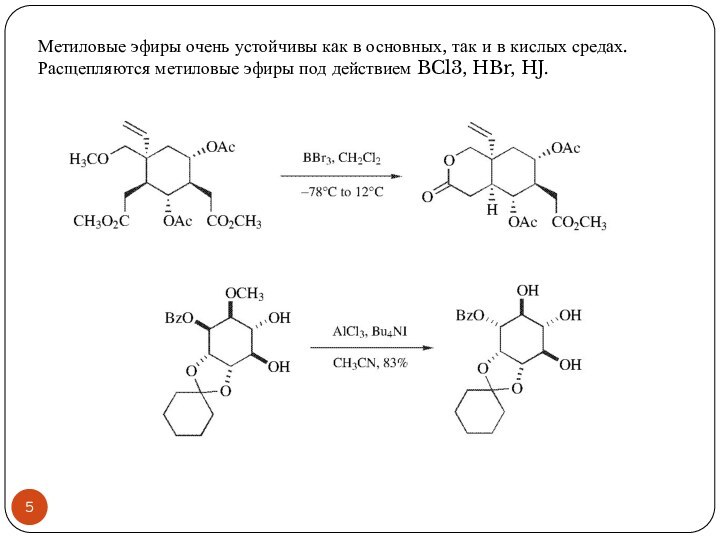
окиси серебра. Метиловые эфиры очень устойчивы как в основных, так и в кислых средах. В связи с этим, они редко используются в качестве защитной группы. В основном, метиловые эфиры получают для повышения летучести соединений при разделении с помощью газо-жидкостной хроматографии. Расщепляются метиловые эфиры под действием BCl3, HBr, HJ.Слайд 5 Метиловые эфиры очень устойчивы как в основных, так
и в кислых средах. Расщепляются метиловые эфиры под действием
BCl3, HBr, HJ.Слайд 6 Трет-бутиловый эфир получают при взаимодействии спирта с избытком
изобутилена в условиях кислотного катализа (конц. H2SO4) при комнатной
температуре.Трет-бутиловые эфиры устойчивы к щелочам и каталитическому гидрогенолизу. Лучшими реагентами для удаления являются CF3COOH (безв.), HBr (в уксусной кислоте). Таким образом, трет-бутильная группа пригодна для защиты спиртовой гидроксильной группы в тех случаях, когда другие функциональные группы в молекуле могут выдержать те достаточно жесткие условия кислотности, в которых происходит снятие защиты.