Слайд 2
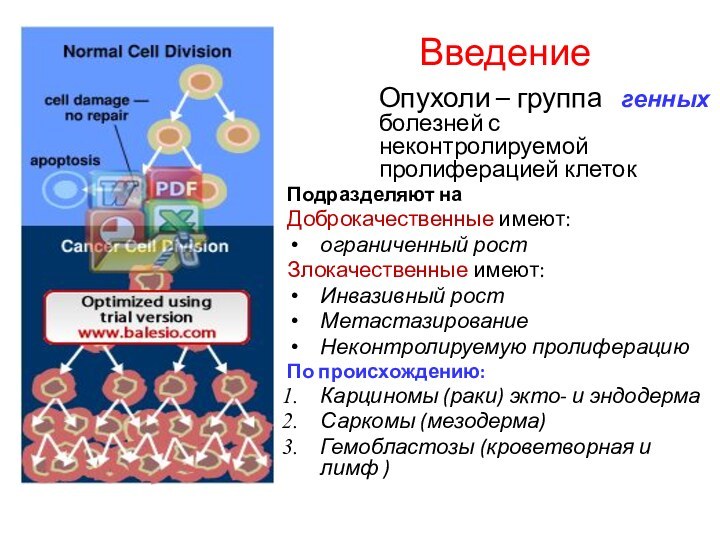
Введение
Опухоли – группа генных болезней с неконтролируемой
пролиферацией клеток
Подразделяют на
Доброкачественные имеют:
ограниченный рост
Злокачественные имеют:
Инвазивный рост
Метастазирование
Неконтролируемую пролиферацию
По
происхождению:
Карциномы (раки) экто- и эндодерма
Саркомы (мезодерма)
Гемобластозы (кроветворная и лимф )
Слайд 3
Этиология опухолей
В 80% возникновение опухолей связано с воздействием
факторов внешней среды (образ жизни, питание, вредные привычки, и
наследств. прераспол):
Излучение –УФО, R- и γ-лучи оказывают мутагенное и канцерогенное действие
Химический канцерогенез – огромное кол-во в-в обладают мутагенным и канцерогенным действие
Вирусный канцерогенез – ДНК и РНК содержащие вирусы
Наследственная предрасположенность
Слайд 4
Радиационный канцерогенез
Интенсивное УФО, проживание на территориях зараженных радионуклидами
увеличивает риск появления меланом и карцином кожи, лейкозов
Механизм
действия
удаление АО и образование апуринизированных и апиримидинизированных участков
Одно- и двунитевые разрывы или сшивки
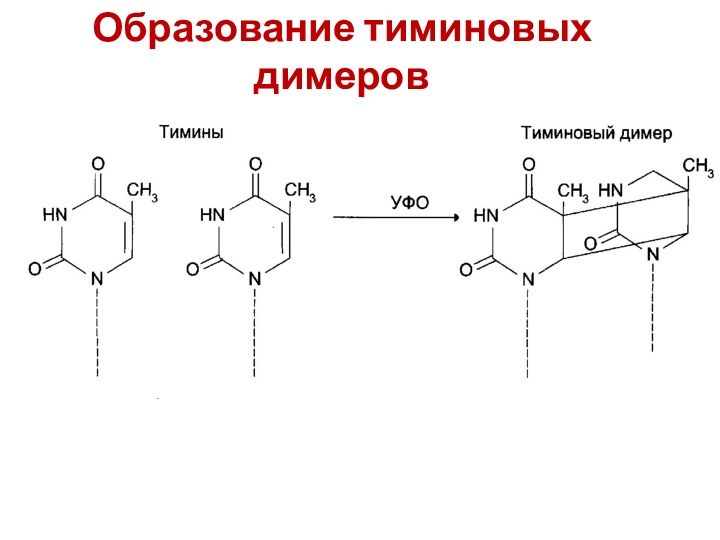
УФО вызывает обр тиминовых димеров
R- и γ-излучение индуцирует образование в тканях АФК (О2* , ОН*, Н2О2 и др.)
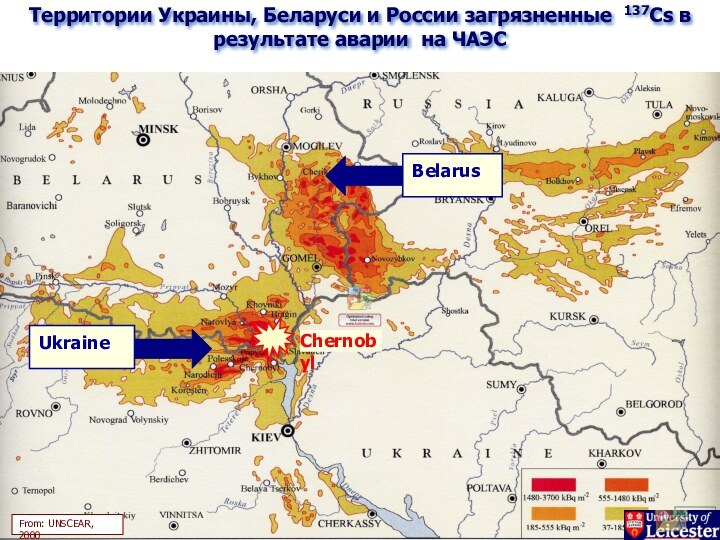
Слайд 5
Территории Украины, Беларуси и России загрязненные 137Cs в
результате аварии на ЧАЭС
From: UNSCEAR, 2000
Chernobyl
Слайд 6
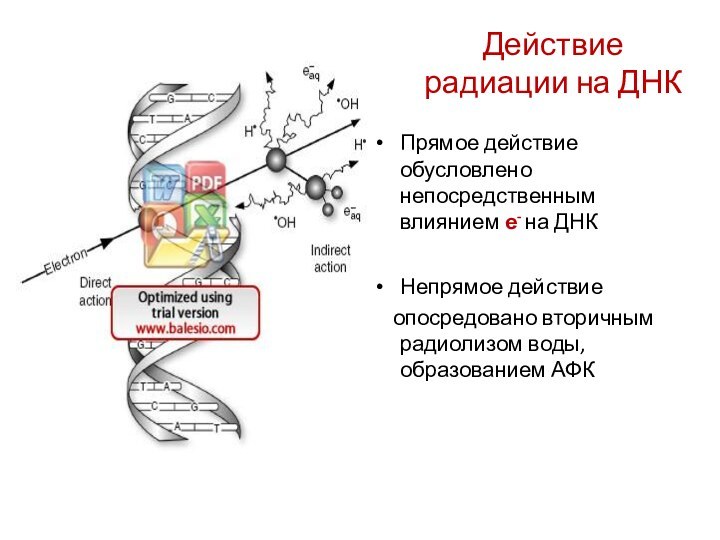
Действие радиации на ДНК
Прямое действие обусловлено непосредственным влиянием
е- на ДНК
Непрямое действие
опосредовано вторичным радиолизом
воды, образованием АФК
Слайд 7
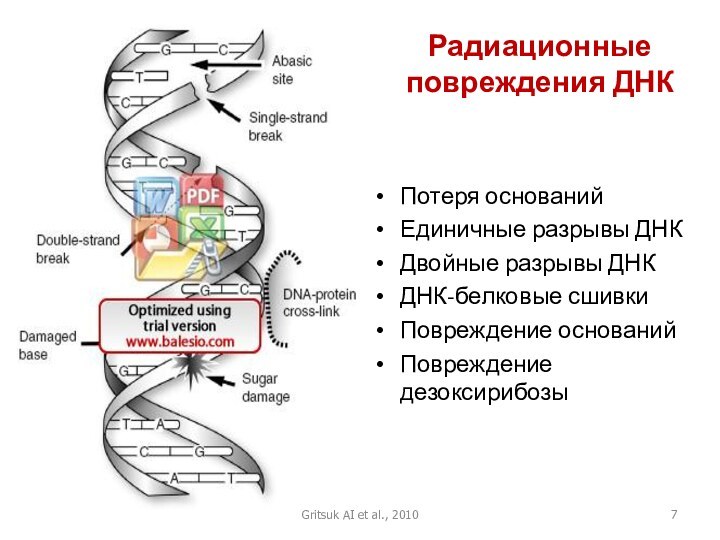
Радиационные повреждения ДНК
Потеря оснований
Единичные разрывы ДНК
Двойные разрывы ДНК
ДНК-белковые
сшивки
Повреждение оснований
Повреждение дезоксирибозы
Gritsuk AI et al., 2010
Слайд 8
Образование тиминовых димеров
Слайд 9
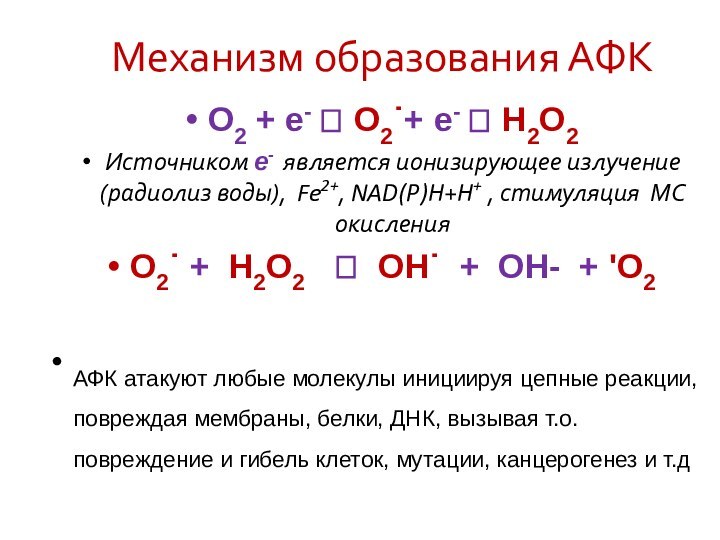
Механизм образования АФК
О2 + е- ? О2˙+ е-
? Н2О2
Источником е- является ионизирующее излучение (радиолиз воды),
Fe2+, NAD(P)H+H+ , стимуляция МС окисления
О2˙ + Н2О2 ? OH˙ + ОН- + 'О2
АФК атакуют любые молекулы инициируя цепные реакции, повреждая мембраны, белки, ДНК, вызывая т.о. повреждение и гибель клеток, мутации, канцерогенез и т.д
Слайд 10
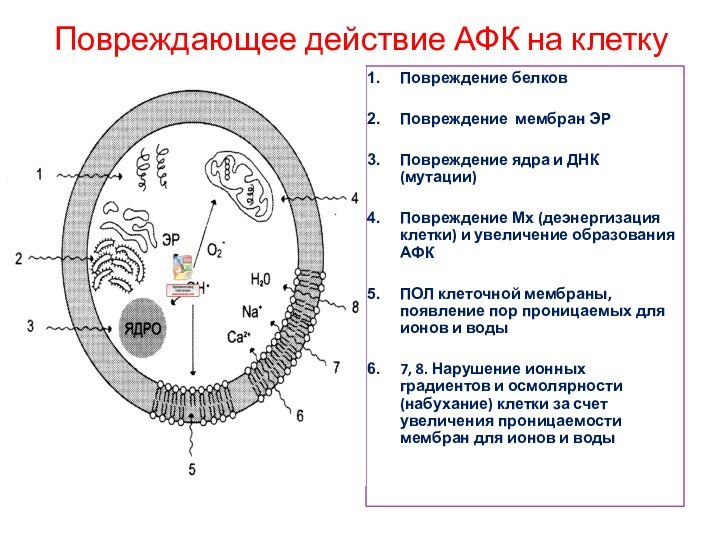
Повреждающее действие АФК на клетку
Повреждение белков
Повреждение мембран ЭР
Повреждение
ядра и ДНК (мутации)
Повреждение Мх (деэнергизация клетки) и увеличение
образования АФК
ПОЛ клеточной мембраны, появление пор проницаемых для ионов и воды
7, 8. Нарушение ионных градиентов и осмолярности (набухание) клетки за счет увеличения проницаемости мембран для ионов и воды
Слайд 11
Антиоксидантная защита (АОЗ)
Неферментативная – АО вещества образующие менее
активные радикалы и «гасят» цепные реакции (вит А,Е,С, GSH,
гис, адреналин, КС, мочевина, билирубин , природные полифенолы, красители, флавонойды и др.)
Ферментативная представлена ферментами (СОД, каталаза, глютатион-пероксидаза, глютатион-редуктаза и др.)
О2∙ + О2∙ + 2Н+ ? Н2О2 + О2 (СОД)
2Н2О2 ? 2Н2О + О2 (каталаза)
2GSH + Н2О2?2Н2О+GS-SG (GSH-пероксидаза)
Слайд 12
Химический канцерогенез
Большинство канцерогенов существует в форме проканцерогенов, которые
в печени превращ в активные формы, реагирующими с НК
и белками (летальный синтез).
Ферменты детоксикации (МC окисление) обладают выраженным полиморфизмом, при их низкой активности проканцерогены выводятся из орг-ма не успев превратиться в канцерогены (различная чувс-ть людей к канцерогенам табачного дыма).
Слайд 13
Основные химические канцерогены (ХК)
Все ХК
(орг. и неорг.), обычно электрофилы, реагируют с нуклеофильными группами
ДНК и белков
Слайд 14
Химические канцерогены (ХК)
ПАУ- продукты неполного сгорания угля,нефти, табака,
пиролиза масел, органических компонентов пищи и др.
После ферментативной
активации цит Р450
и образования эпоксидов, реагируют с пуринами (особенно с G)
Слайд 15
Химические канцерогены (прод.)
Ароматические амины - анилиновые красители и
в-ва используемые в резиновой пром-сти
Нитрозамины – образуются в организме
при взаимодействии нитритов и вторичных алифатических аминов, постоянных компонентов пищи и обр при запекании мяса и рыбы. Нитриты широко используются как консерванты пищи. Нитрозамины обр с ДНК N7-метил G ДНК и О7-метил G ДНК
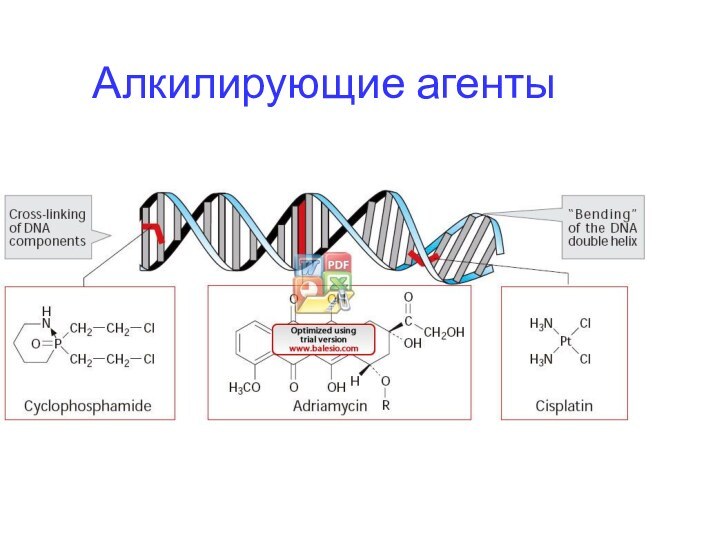
Алкилирующие и ацилирующие агенты повреждают структуру ДНК
Слайд 17
Вирусный канцерогенез
ДНК-содержащие вирусы (герпеса, аденовирус, ветряной оспы) полностью
или частично встраиваются в геном хозяина и экспрессируют свои
гены
РНК-содержащие вирусы содержат ревертазу и онкогены, ответственные за опух трансформацию (вирус саркомы Рауса – src-онкоген, встраивание в геном клеток приводит к их трансформации).
Слайд 18
Наследственная предрасположенность
Нестабильность генома приводит в дефектам системы репарации
ДНК
У детей предрасположенность к Rb (ретино-бластоме) наследуется как аутосомно-доминантный
признак
В последнее время изучаются фрагменты генома (SNP single nucleotide polimorfism) однонуклеотидные вариации
приходящиеся ~ на каждые 1000 нуклеотидов
характеризующие индивид. особенности генома и
ответственные за наследственную предрасположенность к развитию опухолей (в российской популяции до 50% предрасположены к раку легкого)
Слайд 19
Нестабильность генома –
эпигенетический феномен
Нестабильность генома
вызвана длительными изменениями экспрессии генов и переносится через много
поколений выживших клеток (memorized) (Morgan, 2003).
Его основные механизмы – метилирование ДНК и модификация гистонов (Barton et al., 2005).
Облучение приводит к индукции наследуемых изменений метилирования ДНК, вызывая нестабильность генома (Kaup et al., 2006).
Ряд генов, вовлеченных в канцерогенез, инактивируется путем метилирования (APC, p16, p14, RB1, LKB, ER, RAR2β, VHL, DAP, MGMT, CDI и др.);
Слайд 20
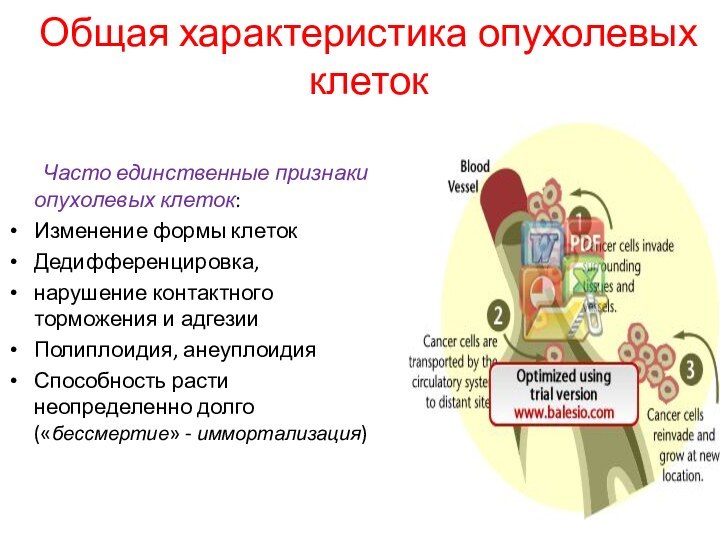
Общая характеристика опухолевых клеток
Часто единственные признаки опухолевых клеток:
Изменение
формы клеток
Дедифференцировка,
нарушение контактного торможения и адгезии
Полиплоидия, анеуплоидия
Способность расти
неопределенно долго («бессмертие» - иммортализация)
Слайд 21
Защитные механизмы опухолевых клеток
Высокий уровень экспрессии шаперона
БТШ 70 (Hsp70 ), который:
фолдирует новые белки
транспортирует их ч/з
мембраны
встраивает в «нужное» место
«ремонтирует» поврежденные белки
защищает от факторов, индуцирующих апоптоз (α-ФНО, стауроспорин, тепловой стресс и др.)
препятствует противоопухолевой терапии
Слайд 22
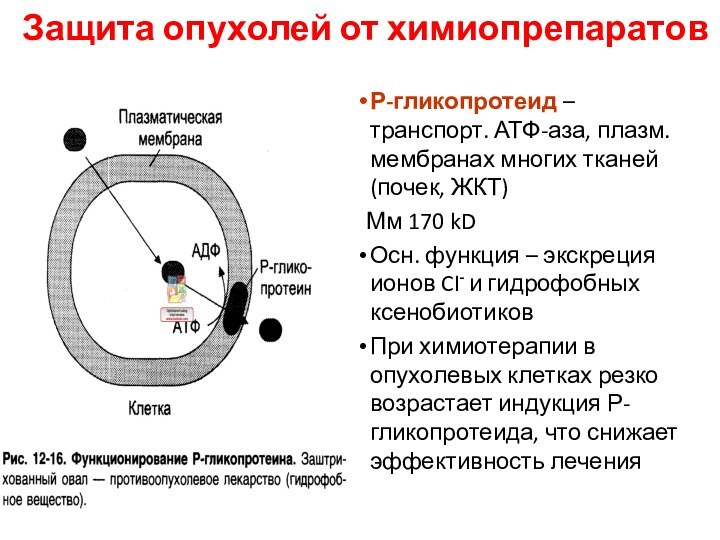
Защита опухолей от химиопрепаратов
Р-гликопротеид – транспорт. АТФ-аза, плазм.
мембранах многих тканей (почек, ЖКТ)
Мм 170 kD
Осн. функция
– экскреция ионов CI- и гидрофобных ксенобиотиков
При химиотерапии в опухолевых клетках резко возрастает индукция Р-гликопротеида, что снижает эффективность лечения
Слайд 23
Особенности метаболизма опухоли
подчинены обеспечению роста клеток
↑
активность рибонуклеотидредуктазы (рибоза
—> дезоксирибоза) и синтеза ДНК и
РНК
↑ скорость ПЦ - биосинтезы
↓ катаболизм пуринов и пиримидинов
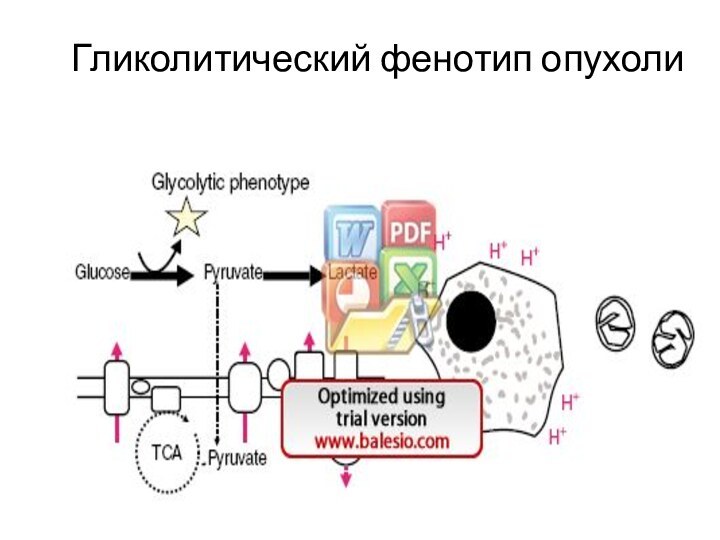
↑ скорость анаэр гликолиза (обратный эффект Пастера – эфф. Кребтри) - гликолитический фенотип
↓ аэробные процессы (Мх окисление )
Сдвиг изоферментов в сторону фетальных форм
Слайд 25
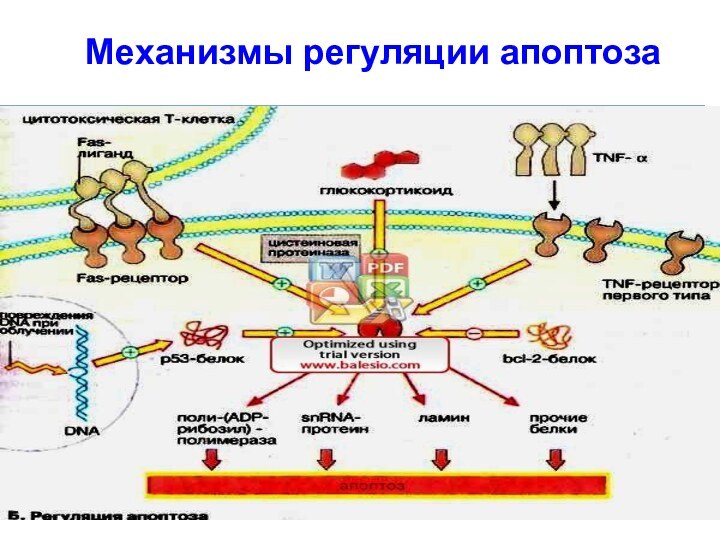
1 путь активации апоптоза:
Фактор некроза опухолей [α-ФНО (αTNF)]
связывается с ФНО-рецептором и запускает апоптоз.
Центральную роль в
регуляции апоптоза играют цистеиновые протеиназы (интерлейкин расщепляющие ферменты - каспазы).
Их активация через ФНО-рецептор приводит к расщеплению:
поли-(АДФ-рибозил)-полимеразы ,
белков sn-РНК (малоядерных РНК),
ламина (белка ядерной мембраны) и др. белков.
Слайд 26
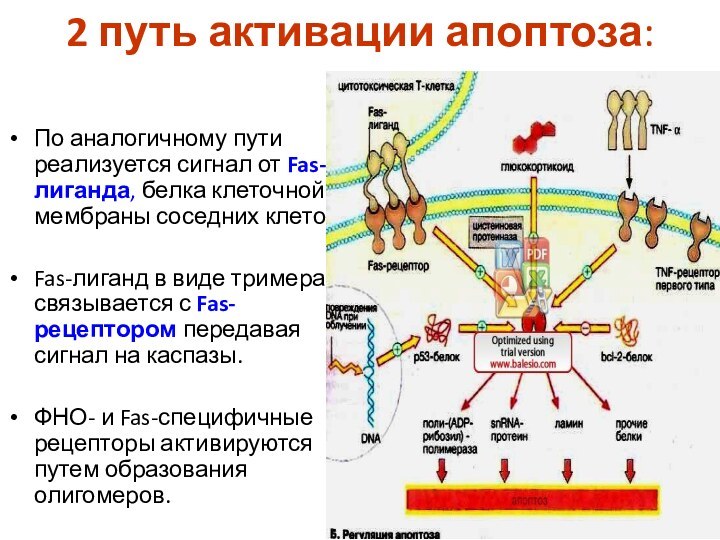
2 путь активации апоптоза:
По аналогичному пути реализуется сигнал
от Fas-лиганда, белка клеточной мембраны соседних клеток.
Fas-лиганд в
виде тримера связывается с Fas-рецептором передавая сигнал на каспазы.
ФНО- и Fas-специфичные рецепторы активируются путем образования олигомеров.
Слайд 27
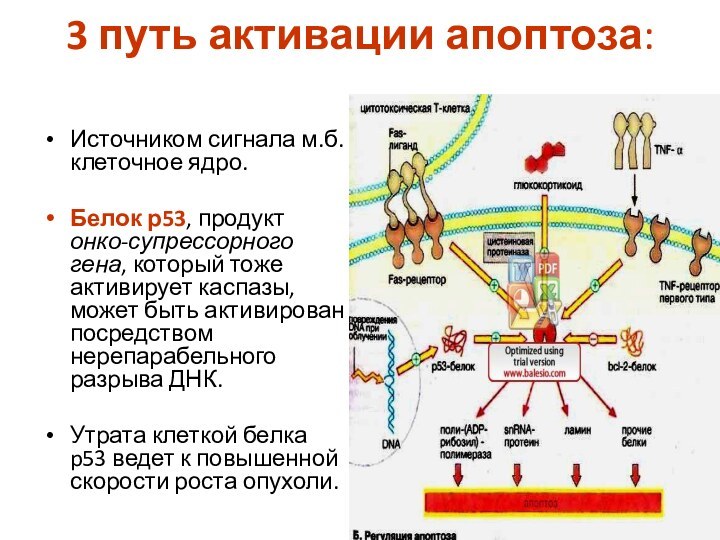
3 путь активации апоптоза:
Источником сигнала м.б. клеточное ядро.
Белок р53, продукт онко-супрессорного гена, который тоже активирует каспазы,
может быть активирован посредством нерепарабельного разрыва ДНК.
Утрата клеткой белка p53 ведет к повышенной скорости роста опухоли.
Слайд 28
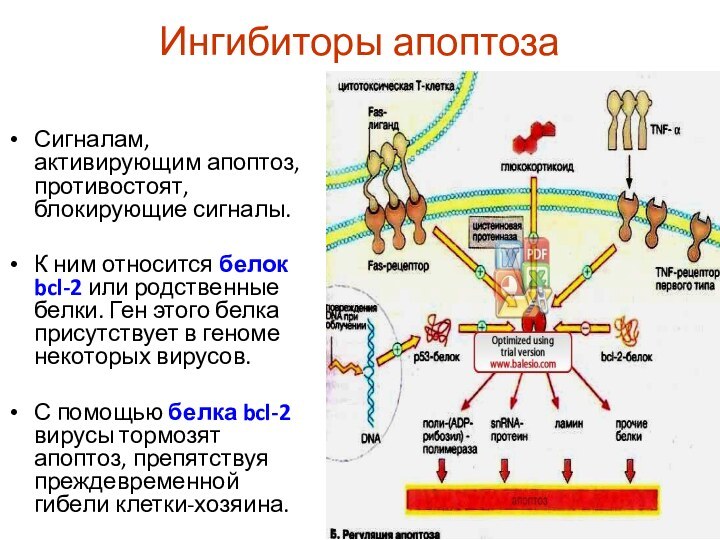
Ингибиторы апоптоза
Сигналам, активирующим апоптоз, противостоят, блокирующие сигналы.
К
ним относится белок bcl-2 или родственные белки. Ген этого
белка присутствует в геноме некоторых вирусов.
С помощью белка bcl-2 вирусы тормозят апоптоз, препятствуя преждевременной гибели клетки-хозяина.
Слайд 29
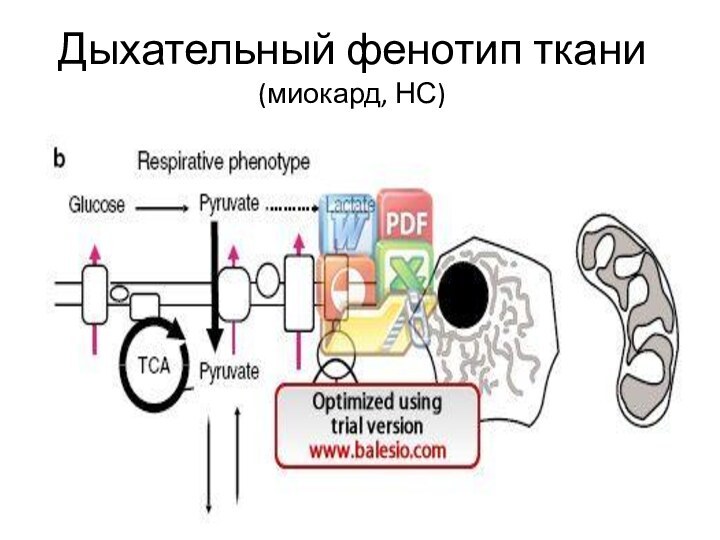
Дыхательный фенотип ткани (миокард, НС)
Слайд 30
Гликолитический фенотип опухоли
Слайд 31
Трансформация метаболического фенотипа опухоли
Слайд 32
Особенности метаболизма опухоли (прод)
В связи с
этим опухоль:
Является ловушкой глюкозы, АК, ЖК, АО и др.
Ведет «крупноблочное строительство» - для синтеза РНК и ДНК использует целые блоки нуклеотидов
Синтезирует эмбриональные белки и ферменты (a-ФП, РЭА, теломераза)
Изменяется структура плазм мембран – снижен синтез интегринов, адгезивных молекул
Усиливается б/с протеаз, коллагеназ, гликозидаз обеспечивающих инвазивный рост опухоли
Усиливается б/с ангиогенина – цитокина активирующего рост сосудов
Слайд 33
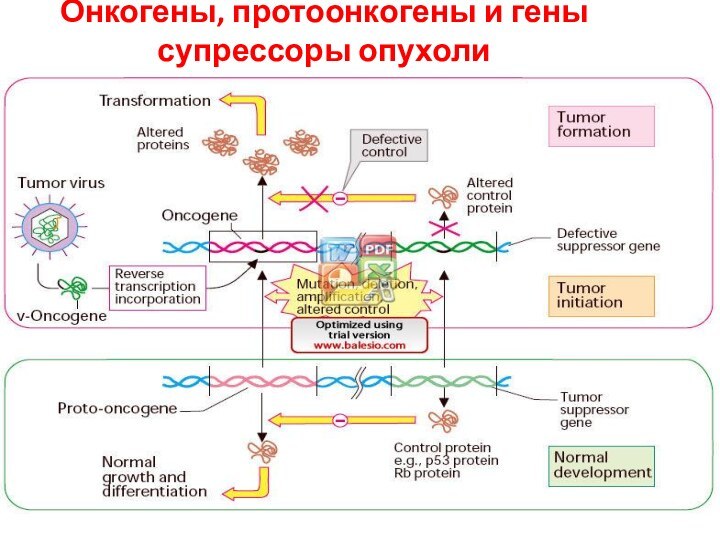
Онкогены, протоонкогены и гены супрессоры опухоли
Протонкогены – гены
экспрессирующие белки контролирующие рост ФР, их рецепторы, транскрипционные факторы
и др
Онкогены - гены трансформации (мутантный вариант Протонкогенов )
гены супрессоры опухоли описано более 10
(rb1, p53, p15, p16, p21wt1 и др )
Слайд 34
Онкогены, протоонкогены и гены супрессоры опухоли
Слайд 36
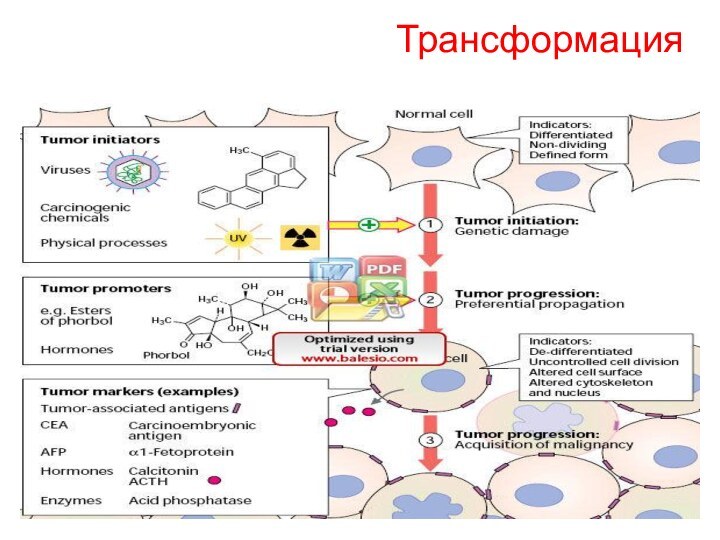
Механизмы трансформации
1. нарушение баланса генома
«Выключение» генов путем метилирования
ДНК
Превращение протоонкогенов в онкогены
Точечные мутации регуляторных участков
Мутации в
генах-супрессорах
Хромосомные аберрации
2. изменение поверхности клеток
Рецепторных белков
Выделение литических ферментов
Нарушение «контактного торможения»
Инвазия и метастазирование
Слайд 37
Основные подходы лабораторной диагностики опухолей
Опухолевые маркеры
Онкофетальные белки (а-ФП,
РЭА и др.)
мРНК онкофетальных белков раковых клеток:
мРНК теломеразы,
мРНК а-ФП (рак печени), мРНК РЭА и мРНК цитокератина-белка эпителиальных клеток (рак толстой кишки),
Гормоны и их рецепторы (инсулин-инсулинома)
Слайд 38
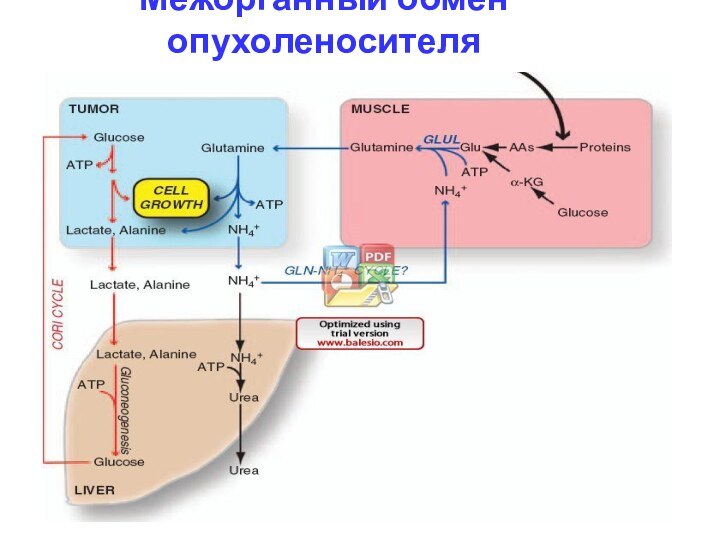
Межорганный метаболизм кахектичного ракового пациента
Рост опухоли сопровождается
потреблением глюкозы и глн с секрецией лактата, ала и
NH4+.
Часть лактата окисляться в хорошо оксигенируемых областях опухоли и используется как дыхательное топливо.
Др часть лактата и ала в печени используется в ГНГ и возвращаться в опухоль в виде глюкозы (цикл Кори). NH3 поступает в ЦСМ или для синтеза новых молекул глн, образуемого при протеолизе и метаболизме глюкозы.
Цикл Кори и глюкозо-аммонийный цикл поставляет энергию опухоли, но цена энергии в др. органах формирует раковую кахексию.
Слайд 39
Межорганный обмен опухоленосителя
Слайд 40
мРНК теломеразы
Теломераза синтезирует концевые участки хромосом (теломер)
Обнаружена во
всех c-r клетках
мРНК теломеразы присутствует в и в N
стволовых клетках, которые, как и c-r в могут неограниченно делиться, но отличие от c-r клеток они занимают свою нишу и не распространяются по организму
онкофетальных белков раковых клеток:
Слайд 41
Метилированная ДНК - ценный биомаркер
диагностики рака
1. Ряд генов, вовлеченных в канцерогенез, инактивируется
путем метилирования (APC, p16, p14, RB1, LKB, ER, RAR2β, VHL, DAP, MGMT, CDI и др.);
2. Разработаны новые методы качественного и количественного анализа метилирования ДНК.
3. Метилирование генов, вовлеченных в канцерогенез:
является одним из наиболее ранних событий в канцерогенезе
высоко специфичный и чувствительный биомаркер опухоли
не наблюдается в ДНК нормальных тканей;
мб определен в сыворотке крови
строго соответствует профилю метилирования ДНК, выделенной из соответствующей опухоли;
позволяет предсказать поведение опухоли (эффективность терапии, метастазирование)
(A.Patel, J.D.Groopman, A.Umar. DNA methylation as a Cancer-Specific Biomarker. Ann. N.Y. Acad. Sci., 2003, 983: 286-297).













![БИОХИМИЯ ОНКОГЕНЕЗА 1 путь активации апоптоза:Фактор некроза опухолей [α-ФНО (αTNF)] связывается с ФНО-рецептором и](/img/tmb/12/1108302/d9e0d2793396338bd6c51eed5bc09e0f-720x.jpg)