Слайд 2
Державне підприємство
“Державний експертний центр
Міністерства охорони здоров’я
України”
- уповноважена Міністерством охорони здоров'я України спеціалізована експертна
установа у сфері доклінічного вивчення, клінічних випробувань та державної реєстрації лікарських засобів (в тому числі медичних імунобіологічних препаратів) в межах, що визначені Законами України “Про лікарські засоби” та “Про захист населення від інфекційних хвороб”, яка також є головною організацією у сфері здійснення фармаконагляду, стандартизації медичної допомоги та медичного, в тому числі фармацевтичного, обслуговування, включаючи розробку відповідних медико-технологічних документів та проектів нормативних актів, що заснована на державній власності та належить до сфери управління Міністерства охорони здоров’я України.
Статут Державного підприємства “Державний експертний центр Міністерства охорони здоров’я України”
Слайд 3
Накази МОЗ якими регулюється процес
реєстрації лікарських засобів
в Україні
1. Наказ МОЗ № 426 від 26.08.2005р.
2. Наказ МОЗ № 3 від 04.01.2013р.
4. Наказ МОЗ № 460 від 23.07.2015р.
5. Наказ МОЗ № 721 від 03.11.2015р.
6. Наказ МОЗ № 1245 від 17.11.2016р.
Слайд 4
Порядок реєстрації ЛЗ та МІБП
затверджений наказом МОЗ
України №460
не поширюються, на:
препарати на основі крові та
плазми, які фракціонуються з людської донорської крові згідно з інструкціями виробника в акредитованих відповідно до сфери діяльності лікувальних установах;
кров та плазму, які використовуються для промислового виробництва готових препаратів крові.
Слайд 5
Порядок поширюється на препарати
отримані з людської
крові або плазми.
Відповідно п.32 розділу ІІ лікарські засоби,
отримані з крові або плазми людини – лікарські засоби на основі компонентів крові, вироблені промисловим способом на державних або приватних підприємствах; такі лікарські засоби включають, зокрема, альбумін, фактори згортання крові та імуноглобуліни людського походження;
Слайд 6
При проведенні реєстрації препаратів отриманих з людської крові
або плазми, виробник зобов'язаний довести свою здатність досягти постійності
характеристик від серії до серії, а також довести відсутність специфічної контамінації вірусами у тому ступені, який можливий при сучасному рівні технологій.
Матеріали реєстраційного досьє, які надає Заявник при реєстрації препаратів отриманих з людської крові або плазми мають відповідати вимогам Порядку.
Положення модуля 3 частково не застосовуються до лікарських засобів, отриманих з крові або плазми людини, для яких реєстраційне досьє, оформлене згідно з вимогами, викладеними у пункті 3.2 ЗТД для вихідних матеріалів, отриманих з крові/плазми людини, може бути замінене мастер-файлом на плазму (далі – ПМФ), оформленим відповідно до додатку 10.
Процедура реєстрації лікарських засобів отриманих з людської крові або плазми в Україні, гармонізована до вимог Директиви 2001/83/EC.
Слайд 7
Реєстрація препаратів крові в Євросоюзі:
Збір та дослідження крові
та її компонентів регулюється
Слайд 8
Реєстрація препаратів крові в Євросоюзі:
збір та дослідження
крові та її компонентів регулюється
Слайд 9
Збір та дослідження
крові та її компонентів регулюється
Слайд 10
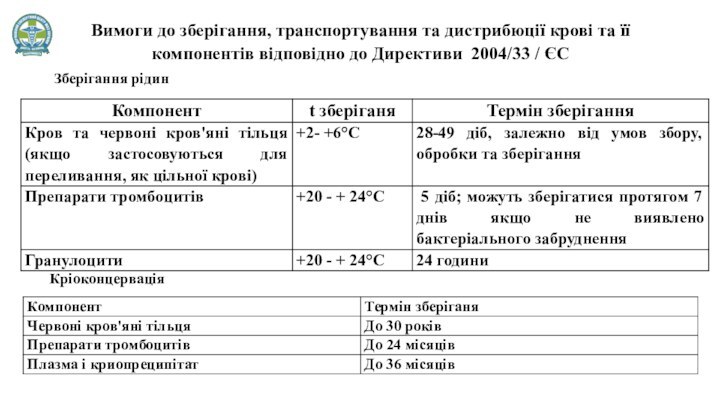
Вимоги до зберігання, транспортування та дистрибюції крові та
її компонентів відповідно до Директиви 2004/33 / ЄC
Зберігання
рідин
Кріоконцервація
Слайд 11
Збір плази для фракціонування:
Керівництво
ЄС з Належної виробничої практики (GMP) (http://ec.europa.eu/health//sites/health/files/files/eudralex/vol-4/annex14_rev30-03_2011_en.pdf)
Керівництво ЄС щодо
вимог до наукових даних плазма-майстер файлу (EMEA/CHMP/BWP /3794/03 Rev.1, 15. Nov. 2006 http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003663.pdf
Керівництво ЄС та рекомендації ВОЗ з епідеміологічних даних щодо інфекцій які передаються через кров (EMEA/та CHMP/BWP /548524/2008 EMEA Guideline ВООЗ.http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2016/02/WC500202385.pdf )
Слайд 12
Керівництво ЄС з Належної виробничої практики (GMP) (http://ec.europa.eu/health//sites/health/files/files/eudralex/vol-4/annex14_rev30-03_2011_en.pdf):
додаток
14: якщо плазма постачається до ЄС з країн третього
світу, то вона повинна відповідати вимогам до якості і безпеки, які передбачені Директивою 2002/98 / EC та Додатком V Директиви 2004/33 / EC.
Діяльність виробника повинна відповідати вимогам GMP, вимогам викладених в Директиві 2005/62/EC, вимогам до простежуваності та фіксації повідомлень про серйозні побічні реакції і події, викладених в Директиві 2005/61/EC та відповідним рекомендаціям ВООЗ ( WHO Recommendations for the production, control and regulation of human plasma for fractination. Annex 4 in: WHO Expert Committee on Biological Standardization. Fifty-sixth report. Geneva, World Health Organization, 2007 (WHO Technical Report Series, No. 941, WHO guidelines on Good Manufacturing Practices for blood establishments).