Слайд 2
План лекции
1. Фармацевтическая
биоэтика
а) Талидомид
б) Биоэтика как наука
2.
Ключевые вопросы биоэтики
3. Биотические аспекты клинических испытаний лекарственных средств
4. Национальное законодательство о клинических испытаниях
5. Требования GCP к ЭК
6. Этика проведения клинических испытаний с участием детей
Слайд 3
Актуальность темы
Успешная работа по продвижении
лекарственных препаратов на рынок много в чем зависит от
профессионализма медицинских представителей . Для того , чтоб на высоком уровне представлять фармацевтическую продукцию , медицинские представители должны иметь медицинское образование , ответственность .
Слайд 4
Актуальность темы
Такая подготовленность должна включать
инструктаж про соответственные этичные аспекты поведения , учитывая критерии
ВООЗ . Медицинские работники обязаны давать особам ,что назначают лекарственные средства на основе официальных источников.
Слайд 5
Фармацевтическая биоэтика
Ускорение научно-технического прогресса во второй половине XX
в. еще более ярко высветило проблемы
морально-нравственных норм и
правил использования достижений науки, в т.ч. биологии, медицины и фармации.
Слайд 6
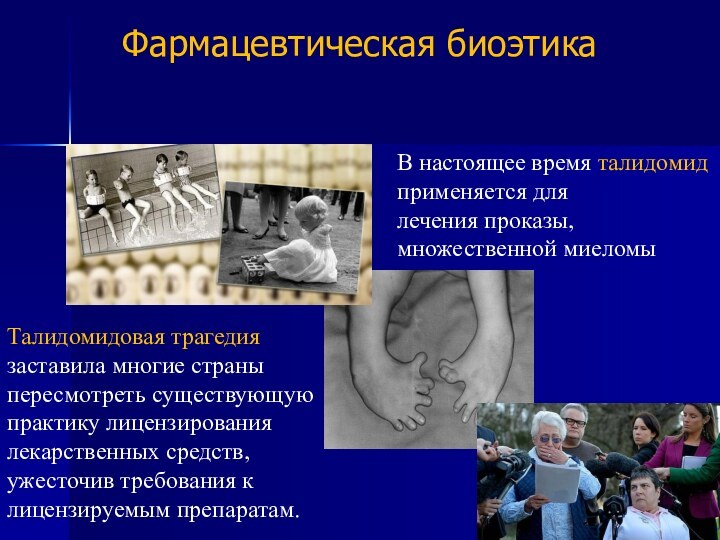
Талидомид — седативное снотворное лекарственное средство, обладающее тератогенностью. В период с 1956 по 1962 годы в ряде
стран мира родилось по разным подсчётам от 8000 до12 000 детей с врождёнными уродствами,
обусловленными тем, что матери принимали препараты талидомида во время беременности.
Фармацевтическая биоэтика
Слайд 7
Талидомидовая трагедия заставила многие страны пересмотреть существующую практику
лицензирования лекарственных средств, ужесточив требования к лицензируемым препаратам.
Фармацевтическая биоэтика
В
настоящее время талидомид применяется для лечения проказы, множественной миеломы
Слайд 8
Зимняя олимпиада в Солт-Лейк Сити в 2002 г.
преподнесла немало новых случаев использования лекарств с неблаговидными целями.
Фармацевтическая биоэтика
Известно около 11 тысяч лекарственных препаратов, которые используют для стимуляции спортсменов во имя рекордов и, в конечном счете, для наживы, не считаясь с вредом здоровью.
Слайд 9
Фармацевтическая биоэтика
В ответ на сложившуюся ситуацию появилось новое
направление в науке - биоэтика.
Термин «биоэтика» был впервые предложен
известным онкологом —
исследователем из Университета штата Висконсин (США) Ван Рансселер Поттером
Слайд 10
Фармацевтическая биоэтика
Биоэ́тика (от др.-греч. βιός — жизнь и ἠθική —этика, наука о нравственности) — наука,
изучающая противоречия между интересами людей, а также их сообществ
в области здоровья
и достижениями биологии, медицины и фармации, которые могут прямо или опосредованно нанести ущерб здоровью и качеству жизни, с целью выработки морально-нравственных норм, требований и принципов, обеспечивающих здоровье человека и общества.
Слайд 11
Фармацевтическая биоэтика
Первый круг проблем биомедицинской этики связан с
необходимостью проследить, как могут и должны проявлять себя в
деятельности медицинского работника – на теоретическом и практическом уровнях – общечеловеческие моральные ценности и принципы, как регулируют они нормы поведения врача и исследователя, выступая основой их профессионального выбора. Здесь, в свою очередь, выделяется два этических аспекта.
Слайд 12
Фармацевтическая биоэтика
Во-первых, это проблема активного включения в лечебную
практику в качестве руководства к действию свода высших общечеловеческих
моральных ценностей, представленных такими этическими категориями, как Добро и Зло, Страдание и Сострадание, Долг и Совесть, Честь и Достоинство, Свобода и Ответственность.
Слайд 13
Фармацевтическая биоэтика
Во-вторых, это проблема установления однозначного трактования сущности
и признаков Жизни и Смерти человека как
высших базовых ценностей.
Решение этой задачи, которое должно стать делом совокупных усилий медиков, философов, представителей религиозных конфессий, даст возможность определиться наконец в решении вопроса о праве человека на достойную жизнь и столь же достойную смерть.
Слайд 14
Фармацевтическая биоэтика
Второй круг проблем биомедицинской этики связан со
спецификой, развитием и современными достижениями медицины, которые проявляются каждый
раз в конкретных, неповторимых случаях и сказываются на определенной, человеческой судьбе. К их числу относятся:
Слайд 15
Фармацевтическая биоэтика
проблема эвтаназии;
проблемы реанимирования – принятия решения о
его необходимости и длительности,
проблемы трансплантации органов – морально-правовой
аспект выбора донора и реципиента;
проблема установления критериев нормы и патологии взрослого человека и человеческого зародыша;
проблема последствий искусственного оплодотворения и прерывания беременности;
проблема предвидения и предотвращения негативных последствий медико-биологических, особенно генетических, исследований и экспериментов на человеке;
определение меры ответственности и возможной степени риска исследователя.
Слайд 16
Ключевые вопросы биоэтики
моральные и философские проблемы аборта –
ст. 50 Закона Украины «Основы законодательства Украины о зравоохранеии»,
№ 2801-XII, ст. 281 Гражданского кодекса Украины, Указ МЗ Украины «Об утверждении инструкции о порядке проведения операции искусственного прерывания беременности, форм первичной учетной документации и порядке ее заполнения» от 20.07.2006 р. № 508;
Слайд 17
Ключевые вопросы биоэтики
Технология суррогатного материнства запрещена в некоторых
странах (Германия), но разрешена на Украине и в России.
В каждой стране имеются особенности законодательства, по-разному нормирующие эту практику.
Во Франции, Германии, Австрии, Норвегии, Швеции суррогатное материнство запрещено полностью.
Слайд 18
Ключевые вопросы биоэтики
В некоторых юрисдикциях разрешено лишь некоммерческое
суррогатное материнство -Великобритания (допускается лишь оплата текущих расходов суррогатной матери), Дания (с
серьезными ограничениями), Канада, Израиль, Нидерланды (запрещена реклама суррогатного материнства, предложение услуг суррогатных матерей и их подбор), некоторые штаты США (Нью-Гемпшир, Вирджиния).
В Бельгии, Греции, Испании, Финляндии суррогатное материнство не регулируется законодательством, но фактически имеет место.
Слайд 19
Ключевые вопросы биоэтики
Правовое урегулирование отношений суррогатного материнства совершается
положениями Семейного кодекса Украины, Приказом Министерства юстиции Украины «О
внесении изменений в Правила регистрации актов гражданского состояния в Украине» № 1154/5 от 22.11.2007, приказа Министерства здравоохранения Украины «Об утверждении Инструкции о порядке применения вспомогательных репродуктивных технологий» № 771 от 23 декабря 2008 года.
Слайд 20
Ключевые вопросы биоэтики
Пионером в области легализации добровольной смерти
стали Нидерланды. В 1984 году Верховный суд страны признал добровольную эвтаназию приемлемой.
Эвтаназия
была легализована в Бельгии в 2002 году.
С апреля 2005 года в бельгийских аптеках появились специальные наборы для эвтаназии, позволяющие упростить процедуру добровольного ухода из жизни. В набор стоимостью примерно 60 евро входит одноразовый шприц с ядом и другие необходимые для инъекции средства.
Набор для эвтаназии может заказать только практикующий врач, который должен указать точную дозировку отравляющего вещества. Оформить заказ можно после обращения в одну из 250 бельгийских аптек, имеющих соответствующую лицензию.
Слайд 21
Фармацевтическая биоэтика
В 90х годах XX века началось становление
фармацевтичес-кой биоэтики как одного из направлений биоэтики, тесно связанного
с биомедицинской этикой.
Слайд 22
Фармацевтическая биоэтика
Фармацевтическая биоэтика изучает:
*
моральные, правовые, социальные, экологические и юридические проблемы, возникающие при
создании, клинических испытаниях, регистрации, контроле качества, производстве, доведения до потребителя и использовании лекарственных препаратов и других аптечных товаров;
Слайд 23
Фармацевтическая биоэтика
* формы оказания фармацевтических научно-консультативных услуг, с
целью защиты здоровья
населения и отдельных лиц,
качества их жизни, физической и психической неприкосновенности личности, защиты человеческого достоинства.
Слайд 24
Фармацевтическая биоэтика
в профессиональной деятельности в сфере
обращения аптечных товаров, в первую очередь лекарств.
Фармацевтическая биоэтика
является ядром формирования морально-нравственной и этической позиции фармацевта
Слайд 25
Фармацевтическая биоэтика
В 1996 году была проведена первая международная
конференция "Фармацевтическая биоэтика", в этот год, можно считать, родилось
новое научно-практическое направление в фармации.
Слайд 26
Биоэтические аспекты клинических испытаний лекарственных средств
В Украине за
последние пять лет проведено более 1000 клинических испытаний лекарственных
средств.
Проведение испытаний нового лекарственного средства или метода лечения на людях необходимо для предотвращения развития возможных опасных побочных реакций в процессе применения препарата
Слайд 27
Биоэтические аспекты клинических испытаний лекарственных средств
Задачи, стоящие перед
фармацевтической биоэтикой в Украине
1. Решение вопроса о
клиническом тестировании препаратов-генериков
Слайд 28
Биоэтические аспекты клинических испытаний лекарственных средств
Для оценки их
качества в нашей стране до настоящего времени применяются так
называемые ограниченные
клинические испытания (контингент больных – чаще всего 30 пациентов основной группы и 15 контрольной).
Слайд 29
Биоэтические аспекты клинических испытаний лекарственных средств
Учитывая, что частота
возникновения побочных эффектов многих лекарственных препаратов составляет 1 :
50,
1 : 100, 1 : 200, чаще всего ожидаемые и неожидан-ные эффекты остаются вне поля зрения ограничен-ного клинического испытания.
Слайд 30
Биоэтические аспекты клинических испытаний лекарственных средств
Возникает вопрос: этично
ли результаты ограниченных клинических испытаний считать тестом, дающим
основание к широкому медицинскому применению генерического препарата?
Слайд 31
Биоэтические аспекты клинических испытаний лекарственных средств
2. Решение этических
проблем при проведении исследований биоэквивалентности
Слайд 32
Биоэтические аспекты клинических испытаний лекарственных средств
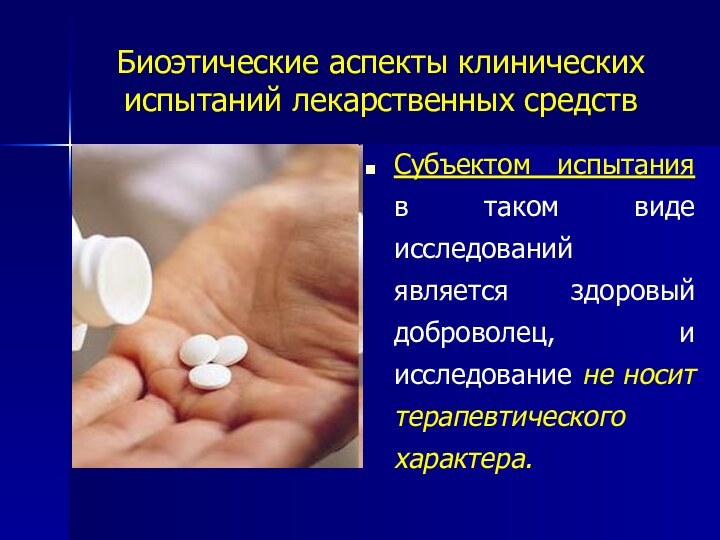
Субъектом испытания в
таком виде исследований является здоровый доброволец, и исследование не
носит терапевтического характера.
Слайд 33
Биоэтические аспекты клинических испытаний лекарственных средств
Особое внимание при
рассмотрении материалов клинических испытаний этические комитеты
должны обращать на
этические моменты, а именно: на порядок, методы и суммы выплат испытуемым.
Слайд 34
Биоэтические аспекты клинических испытаний лекарственных средств
В соответствии с
требованиями GCP суммы выплат должны быть пропорциональны длительности участия
здоровых добровольцев в исследовании и не должны полностью зависеть от того, участвовал ли испытуемый в клиническом исследовании в течение всего установленного протокольного срока.
Слайд 35
Биоэтические аспекты клинических испытаний лекарственных средств
Если для привлечения
в исследование здоровых добровольцев используются объявления, они должны быть
представлены для рассмотрения в этические комитеты.
Слайд 36
Биоэтические аспекты клинических испытаний лекарственных средств
Этические комитеты (ЭК)
— это независимые организации, в состав которых входят профессиональные
медики и лица немедицинских специальностей, несущие ответственность за обеспечение защиты прав и здоровья людей, участвующие в исследовании, и гарантирующие такую защиту для общества в целом.
Слайд 37
Биоэтические аспекты клинических испытаний лекарственных средств
Базовым документом для создания и функционирования национальных этических
комитетов (НЭК) — GCP (Good Clinical Practice — Надлежащая клиническая практика).
Слайд 38
Биоэтические аспекты клинических испытаний лекарственных средств
Основные направления работы
ЭК в соответствии с GCP :
* учреждение ЭК;
* предоставление
заявок на рассмотре-ние;
* экспертиза;
* принятие решения о проведении клини-ческого исследования;
* контроль проведения клинического исследования.
Слайд 39
Биоэтические аспекты клинических испытаний лекарственных средств
ХЕЛЬСИНСКАЯ ДЕКЛАРАЦИЯ ВСЕМИРНОЙ
АССОЦИАЦИИ ВРАЧЕЙ
Рекомендации для врачей по проведению биомедицинских исследований
с участием человека в качестве объекта исследования
Принята 18-й Генеральной ассамблеей Всемирной ассоциации врачей, Хельсинки, Финляндия, июнь 1964 г. (пересмотрена 52-й Генеральной ассамблеей Всемирной ассоциации врачей, Эдинбург, Шотландия, октябрь 2000 г.)
Слайд 40
Биоэтические аспекты клинических испытаний лекарственных средств
Следует подчеркнуть, что
изложенные в Хельсинской декларации принципы являются только рекомендательными положениями,
но не освобождают врачей от уголовной и гражданской ответственности, предусмотренной национальным законодательством.
Слайд 41
Биоэтические аспекты клинических испытаний лекарственных средств
В 1966 г.
принята Международная Конвенция гражданских и политических прав
Статья 7
«Никто не
должен подвергаться пытке, жестокости, негуманному или неполноценному лечению, а также наказанию. В частности, никто не может подвергаться медицинским или научным экспериментам без свободно принятого согласия».
Слайд 42
НАЦИОНАЛЬНОЕ ЗАКОНОДАТЕЛЬСТВО О КЛИНИЧЕСКИХ ИСПЫТАНИЯХ
В украинском законодательстве
правовые и этические вопросы при проведении клинических испытаний рассматриваются:
-
в статьях 7 и 8 закона Украины «О лекарственных средствах»;
- в «Инструкции о проведении клинических испытаний лекарственных средств и экспертизе материалов клинических исследований», утвержденной МЗ Украины (приказ № 281 от 01.11.2000 г.);
- в «Типовом положении о комиссии по вопросам этики», утвержденном МЗ Украины (приказ № 281 от 01.11.2000 г.);
- в «Методических рекомендациях по клиническому испытанию лекарственных средств в Украине» (1999 г.).
Слайд 43
Биоэтические аспекты клинических испытаний лекарственных средств
в статье 7 закона
Украины «О лекарственных средствах», в частности, говорится, что клинические
исследования лекарственных средств проводятся после обязательной оценки этических и морально-правовых аспектов программы клинического исследования комиссиями по вопросам этики, которые созданы и действуют при лечебно-профилактических учреждениях, проводящих клинические испытания. Положение о комиссии по вопросам этики утверждается МЗ Украины или уполномоченным им органом.
Слайд 44
Биоэтические аспекты клинических испытаний лекарственных средств
Статья 8 закона
Украины «О лекарственных средствах» полностью посвящена защите прав пациента
(добровольца). В ней отмечено, что клинические исследования лекарственных средств проводятся при наличии письменного согласия пациента (добровольца) на участие в проведении клинического исследования или письменного согласия его законного представителя на проведение клинического исследования с участием несовершеннолетнего или недееспособного пациента. Пациент (доброволец) или его законный представитель должен получить информацию о сути и возможных последствиях исследования, о свойствах лекарственного средства, ожидаемой эффективности, степени риска.
Слайд 45
Биоэтические аспекты клинических испытаний лекарственных средств
Заказчик клинического исследования
лекарственного средства обязан составить договор о страховании жизни и
здоровья пациента (добровольца) в порядке, предусмотренном действующим в данной стране законодательством. Руководитель клинического исследования обязан остановить проведение клинического исследования или отдельные его этапы в случае возникновения угрозы здоровью или жизни пациента (добровольца) вследствие проведения исследования, а также по желанию пациента (добровольца) или его законного представителя.
Слайд 46
Биоэтические аспекты клинических испытаний лекарственных средств
Решение о приостановке
клинического испытания лекарственного средства или отдельных его этапов в
случае возникновения угрозы здоровью или жизни пациента (добровольца) вследствие проведения исследования, а также в случае отсутствия или недостаточной эффективности действия лекарственного средства, нарушения этических норм принимает МЗ Украины или уполномоченный им орган
Слайд 47
Биоэтические аспекты клинических испытаний лекарственных средств
В Украине в
1995 г. при Государственном фармакологическом комитете МЗ была создана
Этическая комиссия. Ее работа регламентируется Положением о комиссии по вопросам этики. Однако данная Комиссия не смогла проконтролировать соблюдение прав участвующих в клинических испытаниях пациентов непосредственно в клиниках.
Слайд 48
Биоэтические аспекты клинических испытаний лекарственных средств
Для решения комплекса
биомедицинских проблем ГФЦ в 2000 г. были разработаны и утверждены
Министерством здравоохранения Украины (приказ № 281 от 01.11.2000 г.) «Инструкция о проведении клинических исследований лекарственных средств и экспертизы материалов клинических испытаний», а также «Типовое положение о комиссии по вопросам этики», которое соответствует статье 8 закона Украины «О лекарственных средствах» с учетом международных норм — правил GCP и Хельсинской декларации (1964).
Слайд 49
ТРЕБОВАНИЯ GCP К ЭК
Европейский форум GCP разработал
рекомендации относительно состава ЭК. Они включают требование, чтобы в
их состав входили не менее 5 человек (рекомендуемый максимум составляет 12 человек). Среди них должны быть как минимум 2 врача, имеющих опыт проведения исследований в соответствии с GCP и независимых от учреждения, в котором проводится испытание.
Слайд 50
ТРЕБОВАНИЯ GCP К ЭК
В состав ЭК должны быть
включены также юрист, парамедик и хотя бы один человек,
который не занимается научной деятельностью. В ЭК должны быть лица обоего пола, разного возраста. Члены ЭК должны быть хорошо ознакомлены с культурными и этническими традициями региона, население которого предполагается привлекать к участию в исследовании.
Слайд 51
ТРЕБОВАНИЯ GCP К ЭК
Основными задачами Комиссии по вопросам
этики являются:
защита прав и интересов исследуемых, привлеченных к клиническому
испытанию лекарственных средств;
защита прав и интересов исследователей;
обеспечение этической и нравственно-правовой оценки материалов клинического испытания.
Слайд 52
ТРЕБОВАНИЯ GCP К ЭК
До начала проведения клинического испытания
лекарственного средства ЭК оценивает этические и нравственно-правовые аспекты программы
(протокола) клинического испытания. При обсуждении материалов клинического испытания члены ЭК рассматривают следующие вопросы:
• соответствие представленного протокола целям и задачам исследования, возможность получения обоснованного результата при минимальной степени риска для субъектов исследования, оправданность возможного риска и неудобств для субъекта в сравнении с ожидаемой пользой для субъекта и других лиц;
Слайд 53
ТРЕБОВАНИЯ GCP К ЭК
пригодность исследователя(лей) для проведения предложенного
клинического испытания;
соответствие исследовательского центра целям и задачам исследования;
процедуру привлечения
потенциальных субъектов к исследованию;
порядок страхования пациентов и выплаты компенсации (если таковая предполагается);
содержание информации об исследовании, предоставляемой пациенту;
процедуру получения согласия пациента на участие в исследовании.
Слайд 54
ТРЕБОВАНИЯ GCP К ЭК
Во время проведения клинического испытания
лекарственного средства Комиссия осуществляет контроль по защите прав и
здоровья исследуемых, является гарантом их безопасности, действует в соответствии с разработанными письменными стандартными процедурами, утвержденными на своих заседаниях Комиссии. Деятельность Комиссии должна отвечать требованиям GCP и законодательству Украины.
Слайд 55
ТРЕБОВАНИЯ GCP К ЭК
Варианты заключений Комиссии по рассмотренным
материалам клинических исследований:
Одобренное мнение (в странах ЕС используется термин
«благоприятная оценка» — favorable opinion, в США — «утвердить» — approve).
Для благоприятного решения требуется внесение изменений.
Отрицательное решение.
Отмена любого ранее принятого решения.
Слайд 56
ТРЕБОВАНИЯ GCP К ЭК
В процессе проведения клинических испытаний
исследователь информирует Комиссию в следующих случаях:
При внесении любых изменений
и дополнений к протоколу клинических исследований.
При внесении любых изменений и дополнений к информации, предоставляемой субъектам клинических исследований.
При возникновении тяжелых и/или неожиданных побочных эффектов или побочных явлений.
При появлении любых новых данных о возможном влиянии исследуемого препарата на человека.
Слайд 57
ТРЕБОВАНИЯ GCP К ЭК
В Украине в настоящее время
проводится активная работа по созданию местных этических комиссий. Сейчас
при лечебно-профилактических учреждениях и высших медицинских учебных заведениях созданы 50 Комиссий, которые разрабатывают регламенты своей работы и стандартные операционные процедуры на основании утвержденного Типового положения.
В состав созданных при медицинских учреждениях Комиссий включают от 5 до 11 человек.
Слайд 58
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Согласно
существующей в Украине практике, клинические испытания лекарственных средств на
детях, за редким исключением, когда препараты предназначены исключительно для применения в педиатрии, проводятся по завершению аналогичных испытаний лекарственных средств на эффективность и безопасность у взрослых. Фармакокинетические исследования оригинальных или генерических лекарственных средств на здоровых детях не проводятся ввиду их сложности.
Слайд 59
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Изучение фармакокинетики
оригинальных или сравнительной фармакокинетики генерических лекарств следует проводить лишь
у тех детей, заболевание которых служит показанием к применению данного лекарственного средства.
Слайд 60
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Фармакокинетика многих
лекарственных препаратов изменяется в зависимости от возраста пациента, а
их желательные и побочные эффекты могут быть разными у детей и у взрослых. Например, фенобарбитал оказывает седативный эффект у взрослых, при этом у детей он может вызывать возбуждение.
Слайд 61
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Прежде чем
приступить к исследованию с привлечением детей, рекомендуется исследователям и
ЭК ответить на четыре вопроса:
* Обосновано ли клиническое исследование, важны ли предполагаемые результаты и будут ли в результате получены ответы на поставленные вопросы?
* Не являются ли достаточными результаты, полученные при проведении исследований на взрослых пациентах?
* Допустимы ли риск и нагрузки, которым будут подвергнуты субъекты исследования?
* Не нарушаются ли права субъектов исследования при получении согласия?
Слайд 62
ЭТИКА ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ С УЧАСТИЕМ ДЕТЕЙ
Не следует
привлекать к клиническим исследованиям детей, содержащихся в домах для
сирот, исправительных учреждениях, а также необходимо резко ограничить участие детей из социально неблагополучных семей (родители-алкоголики, наркоманы, безработные, неоднократно судимые и т.д.). ЭК может потребовать привлечения для каждого ребенка, находящегося на попечении государства, адвоката в дополнение к любому частному лицу, действующему от имени ребенка в качестве попечителя или приемного родителя.