- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Функциональная биохимия соединительной ткани
Содержание
- 2. Ткань – это филогенетически сложившаяся система обладающих
- 3. В любой системе все её элементы упорядочены
- 4. Морфофункциональная классификация тканей2. Ткани внутренней среды3. Мышечные1. Эпителиальные4. Нервная
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА, КЛАССИФИКАЦИЯ
- 6. Ткани внутренней среды(соединительные ткани, кровь
- 7. Классификация соединительных тканей Собственно соединительная (волокнистая) ткань:
- 8. ОСНОВНЫЕ ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ.
- 9. Трофическая функция – регуляция питания различных
- 10. Защитная функция – защита от механических воздействий
- 11. Морфогенетическая функция (структурообразовательная) –формирование тканевых комп-лексов и
- 12. Опорная функция (биомеханическая) обеспечивается коллагеновыми и эластическими
- 13. Пластическая функция выражается в адаптации к меняющимся
- 14. Главные компоненты соединительных тканей1. Клетки,
- 15. Рыхлая волокнистая ткань:Основные типы клеток:Фибробласты – синтез
- 16. Рыхлая волокнистая ткань:Внеклеточное вещество: 1. Волокна (коллаген,
- 17. МЕТАБОЛИЗМ КОЛЛАГЕНА И ЭЛАСТИНА.
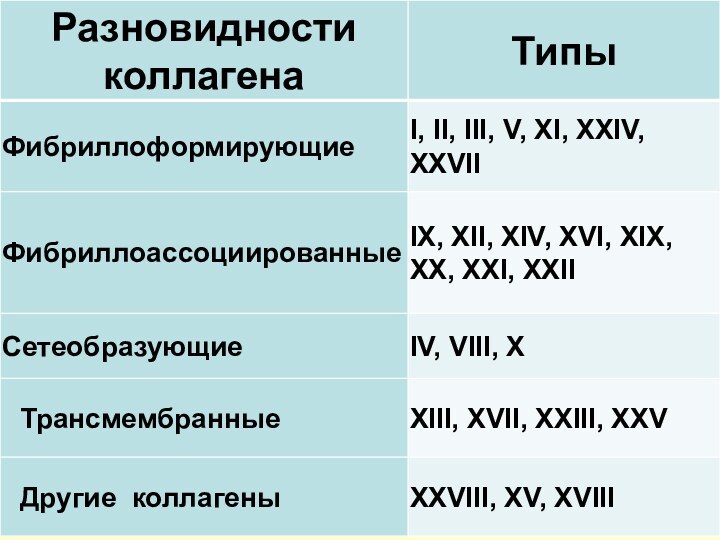
- 18. Основные структурные белки соединительных тканей – КОЛЛАГЕНЫ
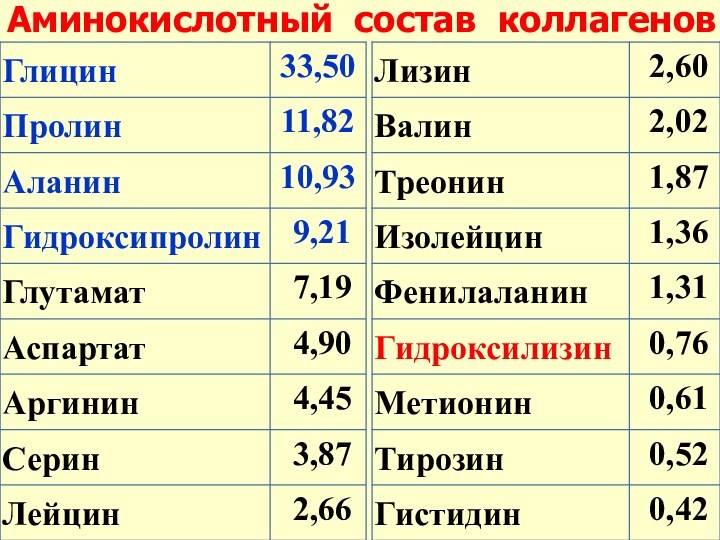
- 20. Аминокислотный состав коллагенов
- 21. Особенность строения коллагена –высокое содержание
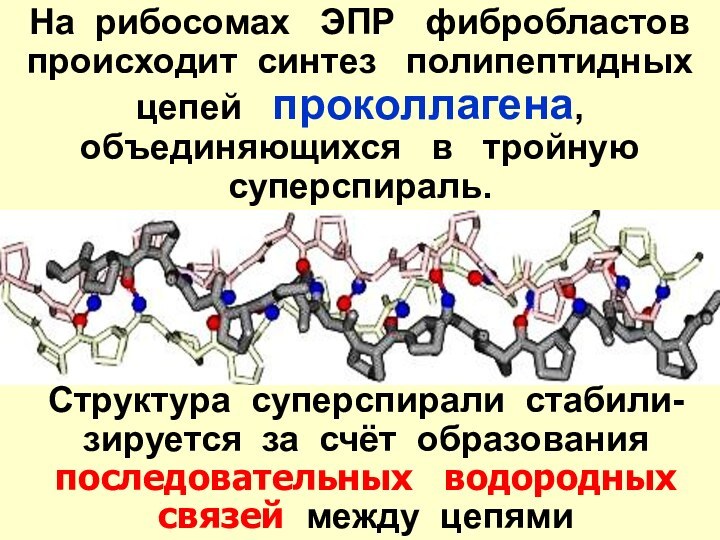
- 22. На рибосомах ЭПР фибробластовпроисходит синтез
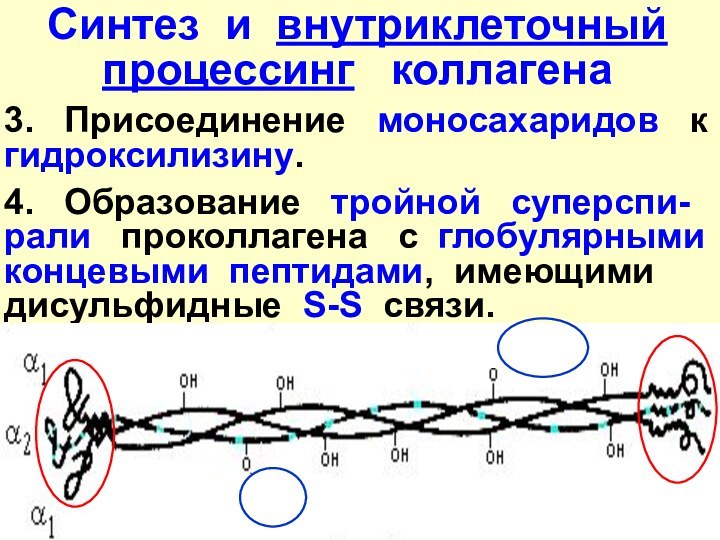
- 23. Синтез и внутриклеточный процессинг коллагена
- 24. Синтез и внутриклеточный процессинг коллагена3.
- 25. Дополнительные аминокислотные последовательности на концах цепей
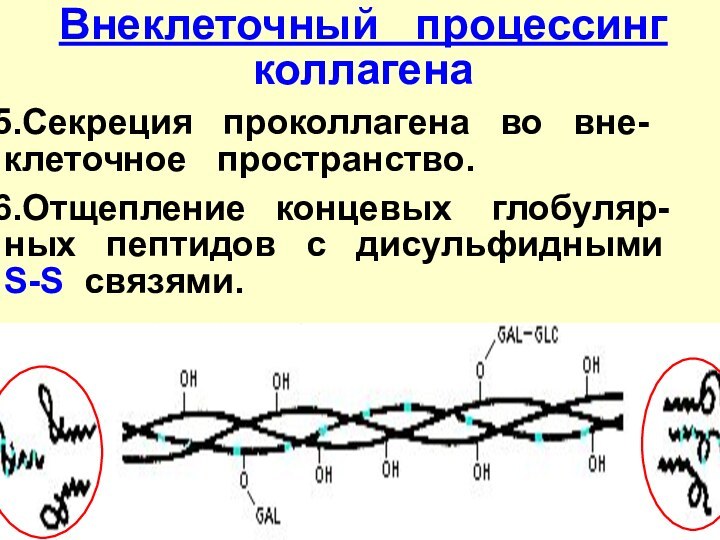
- 26. Внеклеточный процессинг коллагенаСекреция проколлагена
- 27. 7. Фибриллогенез (спонтанное образо-вание волокон
- 28. Окисление лизина и альдольная конденсация
- 29. Особенности эластических волокон Эти волокна придают эластичность
- 30. Особенности эластических волокон Путём модификаций лизина
- 31. Особенности строения и метаболизма
- 33. (белковые цепи – полирибосомы шереховатого ЭПР;
- 34. Схема образования гликозидных связей белково-углеводных комплексовN-гликозидная связь О-гликозидная связь
- 35. ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ структурные компоненты мем-бран клеток,
- 36. ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ ферментативная активность (факторы
- 37. ГЛИКО-(МУКО-)ПРОТЕИНЫсодержат моносахариды: глюкозу, галактозу, маннозу, фукозу,
- 38. N-ацетил-нейраминовая (сиаловая) кислота образуется ферментативной альдольной конденсацией пиру-вата и N-ацетил-D-маннозаминаАльдольнаяконденсация
- 39. Сиаловые кислоты входят в состав различных
- 40. α-нейраминидазаβ-галактозидазаКатаболизм глико-(муко)протеинов
- 41. Сиаловые кислоты значительно влияют на физико-химические свойства
- 42. Распад белково-углеводных комплексов катализируется
- 43. Протеогликаны — это белково-углеводные комплексы,
- 44. ФУНКЦИИ ПРОТЕОГЛИКАНОВ универсальные компоненты
- 45. Углеводные компоненты протеогликанов — ГЛИКОЗАМИНОГЛИКАНЫ —
- 46. Гликозаминогликаны классифицируют: по остаткам моносахаридов, образующих
- 47. гиалуроновая кислотаМономеры:β-D-глюкуроновая кислотаβ-N-ацетилглюкозамин!
- 48. Хондроитин-сульфатыМономеры:β-D-глюкуроновая кислотаβ-N-ацетилгалактозамин-сульфаты (4- или 6-)
- 49. дерматан-сульфаты(L-идуронат (частично S) + ГалNAц-4-S) кератан-сульфаты (D-Гал + ГлюNАц-6-S)
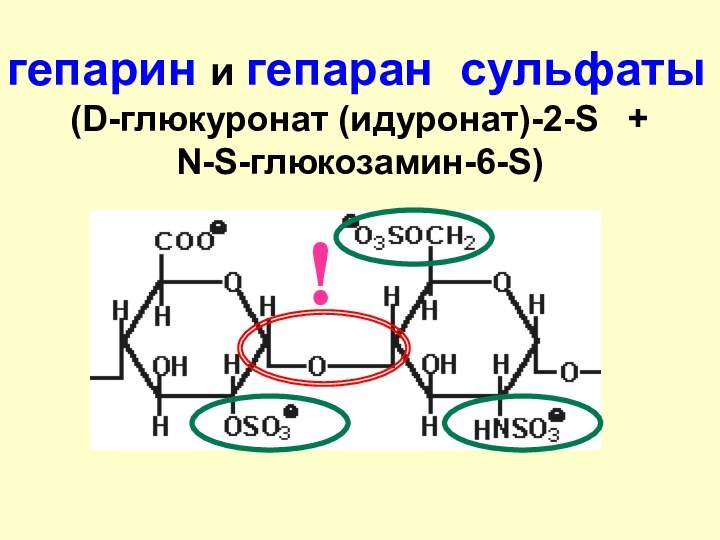
- 50. гепарин и гепаран сульфаты(D-глюкуронат (идуронат)-2-S + N-S-глюкозамин-6-S) !
- 51. МУКОПОЛИСАХАРИДОЗЫ – это заболевания, обусловленные генетическим
- 52. Скачать презентацию
- 53. Похожие презентации




































Слайд 3
В любой системе все её элементы упорядочены в
пространстве и функционируют согласованно друг с другом.
Система
в целом приобретает при этом свойства, не присущие ни одному из ее элементов, взятому в отдельности ! Соответственно и в каждой ткани ее строение и функции несводимы к простой сумме свойств отдельных входящих в нее клеток.
Слайд 4
Морфофункциональная классификация тканей
2. Ткани внутренней среды
3. Мышечные
1. Эпителиальные
4.
Нервная
Слайд 6
Ткани внутренней среды
(соединительные ткани, кровь и
лимфа)
развиваются из эмбриональной сое-динительной ткани — мезенхимы, участвуют
в поддержании постоян-ства внутренней среды организма. Они отличаются от других тканей морфологически (более низким содержанием клеток и преобладанием межклеточного вещества, определяю-щего их свойства) и метаболи-чески – меньшей потребностью в аэробных окислительных процессах.
Слайд 7
Классификация соединительных тканей
Собственно соединительная (волокнистая) ткань:
рыхлая волокнистая
плотная неоформленная
плотная оформленная
2. Соединительные ткани
со специальными свойствами:ретикулярная; жировая; слизистая
3. Скелетные ткани:
хрящевая, костная
цемент и дентин
Они отличаются по природе компо-нентов и соотношению между ними
Слайд 9 Трофическая функция – регуляция питания различных тканевых
структур с участием в обмене веществ и поддержании гомеостаза.
В обеспечении этой функции главную роль играет основное вещество, осуществляющее транспорт воды, солей, молекул питательных веществ.
Слайд 10 Защитная функция – защита от механических воздействий и
обезвреживание чужеродных веществ, поступающих извне или образующихся внутри организма.
Физическая защита (костная ткань) и деятельность макрофагов и иммунокомпе-тентных клеток (клеточный и гуморальный иммунитет).
Слайд 11
Морфогенетическая функция (структурообразовательная) –формирование тканевых комп-лексов и обеспечение
общей структурной организации органов (образование капсул, внутриорган-ных перегородок);
регулирую-щее влияние на пролифера-цию и дифференцировку клеток различных тканей (факторы роста).Слайд 12 Опорная функция (биомеханическая) обеспечивается коллагеновыми и эластическими волокнами,
образующими волокнистые основы всех органов, а также составом и
физико-химическими свойствами межклеточного вещества скелетных тканей (например, минерализацией).Слайд 13 Пластическая функция выражается в адаптации к меняющимся условиям
существования, способности к регенерации, участии в замещении дефектов органов
при их повреждении (формирование рубцовой ткани при заживлении ран или капсулы вокруг инородного тела).
Слайд 14
Главные компоненты соединительных тканей
1. Клетки, создающие
и поддер-живающие количественное и качес-твенное соотношение неклеточ- ных
компонентов:фибро(остео-, хондро-, одонто-)бласты,
фиброциты, фиброкласты
2. Межклеточное вещество:
коллагеновые, эластические, ретикулярные волокна
основное вещество (золь, гель, минерализованное) – интегративно-буферная метаболическая среда
Слайд 15
Рыхлая волокнистая ткань:
Основные типы клеток:
Фибробласты – синтез коллагена,
эластина; протеогликанов и глико-протеинов; могут перемещаться вдоль волокон с
помощью фибронектина.Миофибробласты – заживление ран; способны к сокращению за счёт появления в цитозоле мио-филаментов.
Фиброциты – дефинитивная форма развития фибробластов.
Фиброкласты – фагоцитирование межклеточного вещества и гидролиз его в лизосомах.
Слайд 16
Рыхлая волокнистая ткань:
Внеклеточное вещество:
1. Волокна (коллаген, эластин)
2. Белки клеточной адгезии
(фибронектин, ламинин)3. Основное вещество:
А. Главные компоненты:
– гликозаминогликаны (напр., гиалуроновая кислота, хондроитин-сульфаты и др.)
– протеогликаны
Б. Дополнительные компоненты:
гликопротеины; альбумин, глобулины и неорганические ионы
Слайд 18 Основные структурные белки соединительных тканей – КОЛЛАГЕНЫ (составляют
25% всех белков организма человека)
Главная функция − поддержание
специфической структуры органов и тканей в процессе развития и жиз-недеятельности организма, сопро-тивление растяжениюВ геноме человека ≈ 30 генов, ко-дирующих α-цепи коллагенов. Выде-лено свыше 25 типов изоколлагенов
Слайд 21
Особенность строения коллагена –
высокое содержание
глицина (33 %!), пролина
и гидроксипролина (триплет – глицин-пролин-Х)
Слайд 22
На рибосомах ЭПР фибробластов
происходит синтез
полипептидных цепей проколлагена,
объединяющихся в тройную суперспираль.Структура суперспирали стабили-зируется за счёт образования последовательных водородных связей между цепями
Слайд 23
Синтез и внутриклеточный процессинг коллагена
Синтез про-α-цепей на рибо-сомах ЭПР
2.
Гидроксилирование в цепях пролина и лизина (vit.C!!!, Fe2+, O2).
Слайд 24
Синтез и внутриклеточный процессинг коллагена
3. Присоединение
моносахаридов к гидроксилизину.
4. Образование
тройной суперспи-рали проколлагена с глобулярными концевыми пептидами, имеющими дисульфидные S-S связи.
Слайд 25 Дополнительные аминокислотные последовательности на концах цепей с
большим количеством внутри- и межцепочечных дисульфидных (S-S) связей
препятствуют преждевременному объединению молекул проколлагена в волокна внутри клетки (во избежание её разрушения!).
Слайд 26
Внеклеточный процессинг коллагена
Секреция проколлагена
во вне-клеточное пространство.
Отщепление концевых
глобуляр-ных пептидов с дисульфидными S-S связями.
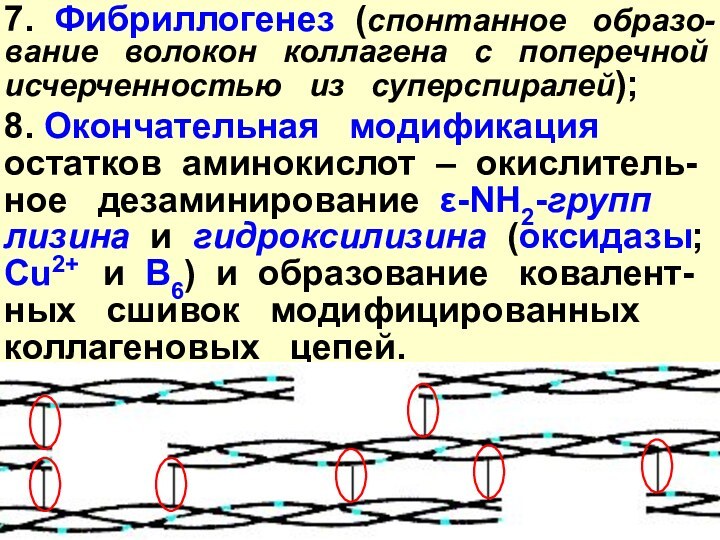
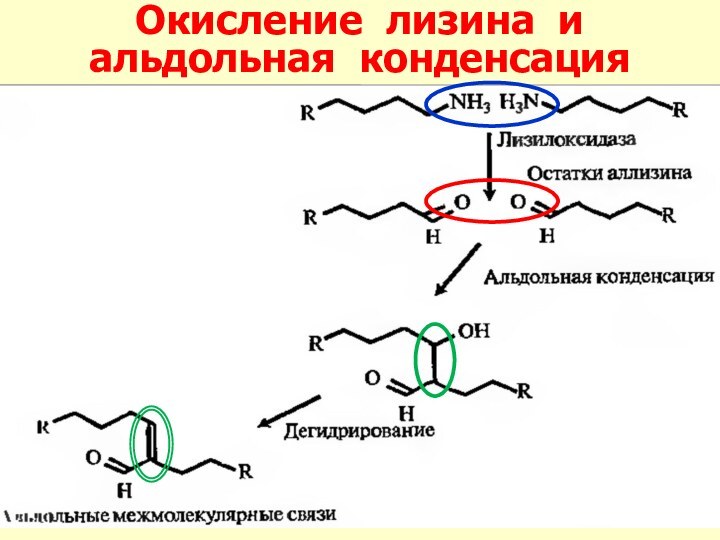
Слайд 27 7. Фибриллогенез (спонтанное образо-вание волокон
коллагена с поперечной исчерченностью из
суперспиралей);8. Окончательная модификация остатков аминокислот – окислитель-ное дезаминирование ε-NH2-групп лизина и гидроксилизина (оксидазы; Cu2+ и B6) и образование ковалент-ных сшивок модифицированных коллагеновых цепей.
Слайд 29
Особенности эластических волокон
Эти волокна придают эластичность внеклеточной
матрице. Основной их компонент – эластин
(составляет 50% сухого веса артерий). В отличие от коллагенов эластин представлен только одним геном. Состоящая из эластиновых цепей сердцевина волокон защищена снаружи гликопротеинами (фибриллины, фибулины и эмилины).
Слайд 30
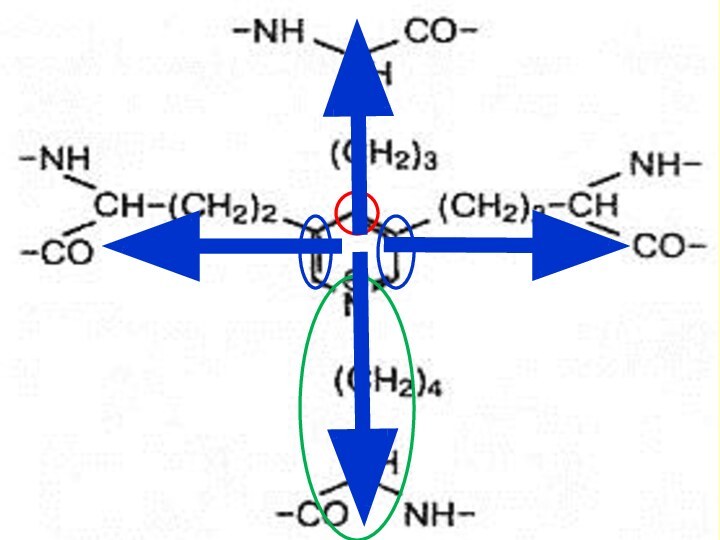
Особенности эластических волокон
Путём модификаций лизина (остатки
которого, объединяясь, превращаются в
десмозин или изодесмозин) отдельные молекулы соединяются в способные к растяжению эластичные протофибриллы, микрофибриллы, образующие сетеобразную структуру.
Слайд 31
Особенности строения и метаболизма
углеводных компонентов различных
белково-углеводных комплексов внеклеточного матрикса соединительных тканейСлайд 33 (белковые цепи – полирибосомы шереховатого ЭПР;
углеводные компоненты – комплекс Гольджи)
А) О-гликозидные комплексы –
последовательное присоединение моносахаридов к белку (Ser, Thr, HLys) специфическими мембрано-связанными О-гликозил-трансферазами
Б) N-гликозидные комплексы –
предварительное образование олигосахаридной части из УДФ(ГДФ)-производных моносахаров с участием долихола и перенос ее на белок (Asn) олигосахарид-трансферазой
Синтез белково-углеводных комплексов
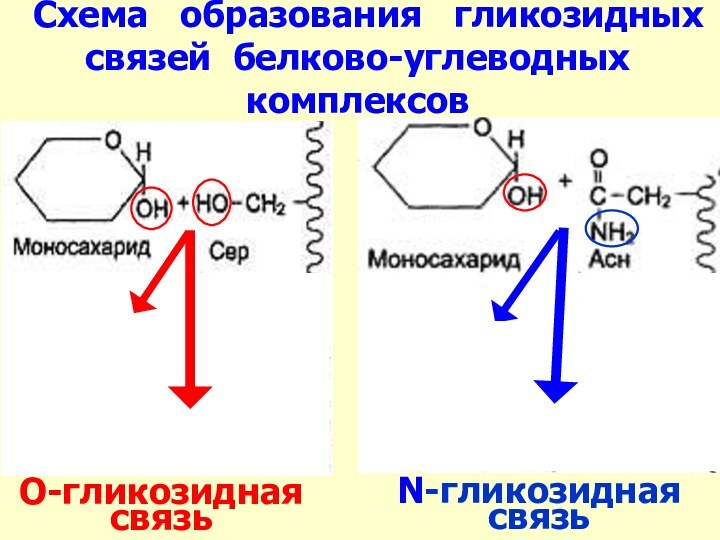
Слайд 34 Схема образования гликозидных связей белково-углеводных
комплексов
N-гликозидная связь
О-гликозидная связь
Слайд 35
ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ
структурные компоненты мем-бран клеток, коллагеновых,
элас-тиновых, фибриновых волокон, костного матрикса
транспортные молекулы вита-минов, липидов,
микроэлементовобеспечение иммунной защиты
гормональная активность (ТТГ, ФСГ, ЛГ)
Слайд 36
ФУНКЦИИ ГЛИКО-(МУКО)ПРОТЕИНОВ
ферментативная активность (факторы свертывания
крови)
уменьшение трения соприка-сающихся суставных поверхно-стей
обеспение
групповой, видо-вой и тканевой специфичности
Слайд 37
ГЛИКО-(МУКО-)ПРОТЕИНЫ
содержат моносахариды: глюкозу, галактозу, маннозу, фукозу,
гексозамины, а также нейраминовую и сиаловые кислоты.
Нет уроновых кислот !
Количество углеводов: 5 – 50%
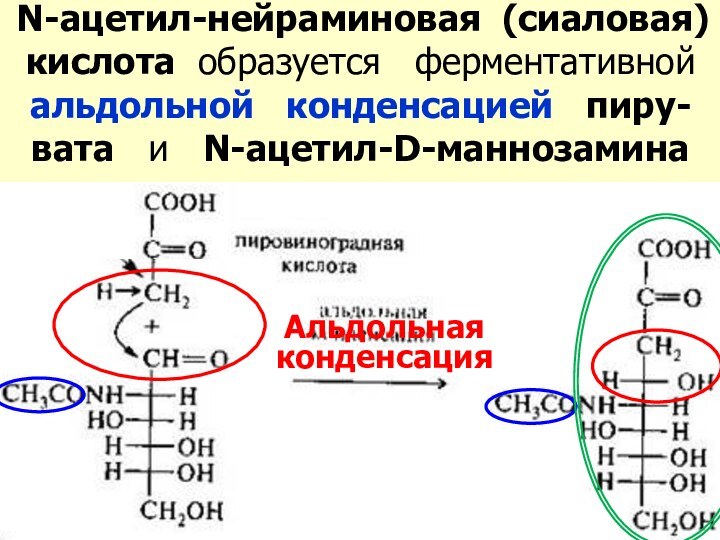
Слайд 38 N-ацетил-нейраминовая (сиаловая) кислота образуется ферментативной альдольной
конденсацией пиру-вата и N-ацетил-D-маннозамина
Альдольная
конденсация
Слайд 39
Сиаловые кислоты входят в состав различных углеводсодержащих
веществ (гликопротеины, гликолипиды, в ликворе
– в свободном виде !), занимая в них концевое положение.После отщепления сиаловых кислот концевым сахаром в молекулах становится галактоза, и они поглощаются клетками печени, в которых происходит их катаболизм.
Слайд 41 Сиаловые кислоты значительно влияют на физико-химические свойства и
биологическую активность веществ (определяют длительность циркуляции эритроцитов, лимфоцитов,
белков плазмы (кислого α1-гликопротеина, церулоплазмина), гормонов (ФСГ, ЛГ).Находясь в составе углеводной части они «маскируют» остатки сахаров, явля-ющихся антигенными детерминантами, и играют важную роль в иммунных реакциях, снижая иммуногенные свой-ства нормальных и опухолевых клеток.
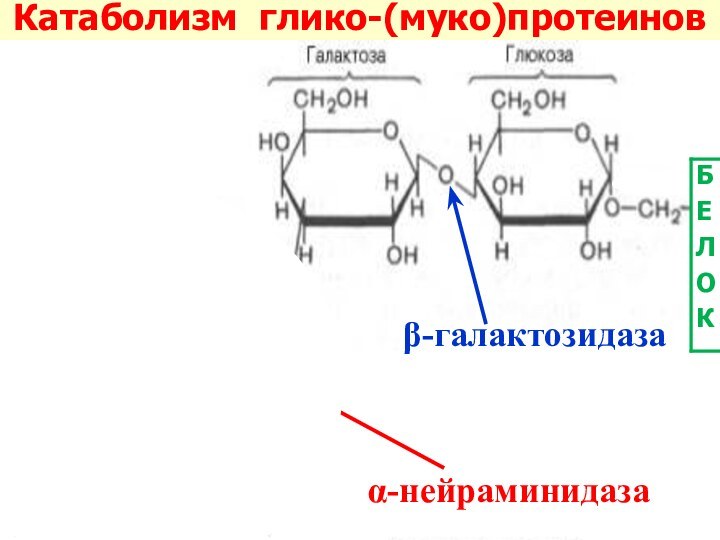
Слайд 42 Распад белково-углеводных комплексов катализируется
большим набором
лизосомальных гидролаз:
белковая часть
– катепсиныуглеводная часть – гликозидазы
сульфатазы
α-нейраминидаза (экзо-α-сиалидаза)
β-галактозидаза
β-гексозаминидаза
α- и β-маннозидаза
α-фукозидаза
эндо-β-N-ацетилглюкозаминидаза
аспартилглюкозаминидаза
Генетически детерминированный дефект указанных ферментов приводит к нарушению распада БУК и развитию гликопротеинозов
Слайд 43
Протеогликаны — это белково-углеводные комплексы, в
которых с молекулами белка ковалентно связаны гетерополисахариды
– гликозаминогликаны. Белки протеогликанов называют коровыми белками (core — сердцевина, стержень).
Слайд 44
ФУНКЦИИ ПРОТЕОГЛИКАНОВ
универсальные компоненты базальных
мембран
обеспечение тургора тканей, противодействие силам
компрес-сии влияние на расположение рецепторов на поверхности клеток
участие в обмене ионов
антикоагулянты
Слайд 45
Углеводные компоненты протеогликанов — ГЛИКОЗАМИНОГЛИКАНЫ —
это гетерополисахариды, состоящие из многократно повторяющихся дисахаридов, соединенных β(1-4)
гликозидными связями, мономеры которых – уроновые кислоты и гексозамины – связаны между собой β(1-3) гликозидной связью.
Слайд 46
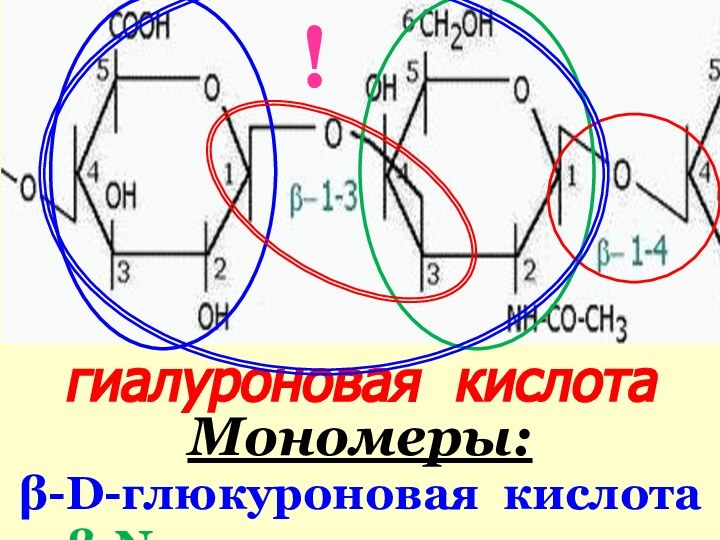
Гликозаминогликаны классифицируют:
по остаткам моносахаридов, образующих
их структурные дисахаридные мономеры;
по типу связи
между дисаха-ридными мономерами;по локализации сульфатных групп и др.
Слайд 48
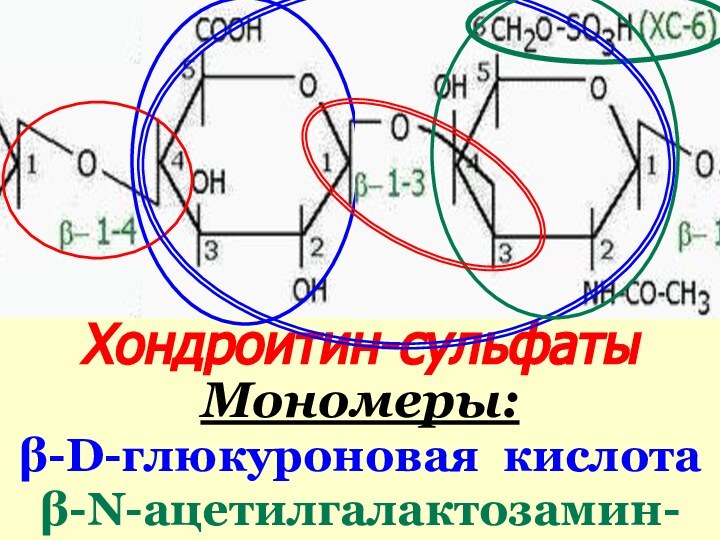
Хондроитин-сульфаты
Мономеры:
β-D-глюкуроновая кислота
β-N-ацетилгалактозамин-сульфаты (4- или 6-)
Слайд 49
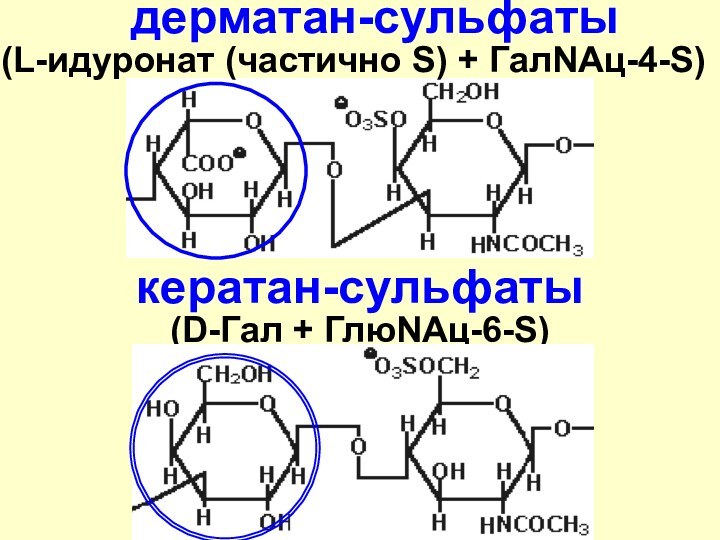
дерматан-сульфаты
(L-идуронат (частично S) + ГалNAц-4-S)
кератан-сульфаты (D-Гал +
ГлюNАц-6-S)
Слайд 51
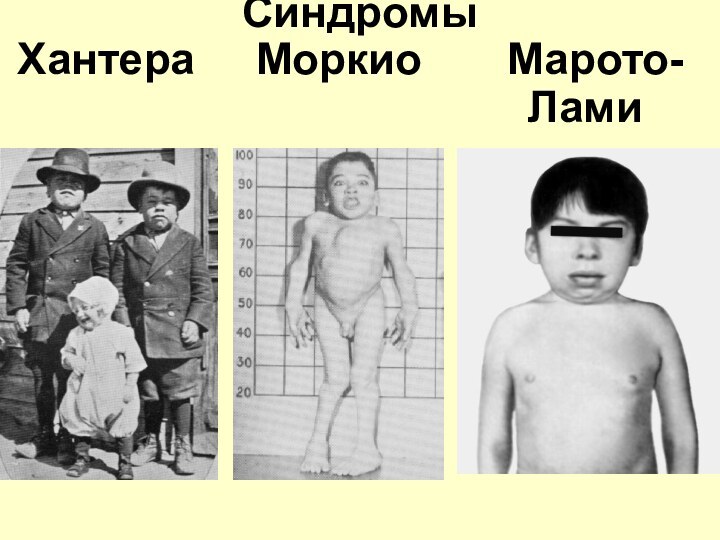
МУКОПОЛИСАХАРИДОЗЫ –
это заболевания, обусловленные генетическим
дефектом ферментативного расщепления углеводной части молекулы различных
протеогликанов инакоплением в лизосомах клеток соответствующих кислых гликозаминогликанов.