Слайд 2
Основа системы государственного контроля качества лекарственных средств в
Украине была заложена в 1996 г. вместе с принятием
Закона Украины «О лекарственных средствах».
В дальнейшем система контроля качества в нашей стране претерпевала изменения, и с 2004 г. в данной сфере Украина четко взяла европейский курс и выбранное направление никогда не менялось.
Слайд 3
Качество лекарственного средства — совокупность свойств, которые дают лекарственному
средству способность удовлетворять потребителей в соответствии со своим назначением
и соответствуют требованиям, установленным законодательством
(Закон Украины «О лекарственных
средствах» от 04.04. 1996)
Слайд 4
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ В ХОДЕ ЕГО ПРИМЕНЕНИЯ
На
этом этапе контрольные мероприятия имеют несколько направлений:
контроль производства лекарственных
средств;
контроль качества лекарственных средств во время их ввоза на территорию Украины;
контроль качества лекарственных средств в ходе их продажи конечным потребителям.
Слайд 5
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ В ХОДЕ ЕГО ПРИМЕНЕНИЯ
Контроль
качества лекарственных средств в лечебном процессе (в ЛПУ) осуществляется
должностными лицами Государственной службы по контролю качества лекарственных средств.
Кроме того в аптечных заведениях и ЛПУ имеются уполномоченные лица, отвечающие за обеспечение качества лекарственных средств при осуществлении входного контроля.
Слайд 6
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ: ВИЗУАЛЬНЫЙ КОНТРОЛЬ
Визуальному контролю подлежат
само лекарственное средство и его упаковка.
При осмотре лекарственного
средства внимание обращают:
- на цвет, однородность, размер и форму твердых лекарственных форм;
- цветность, прозрачность, вязкость, наличие взвешенных частиц и прочие характеристики для жидких лекарственных форм.
Данные характеристики должны отвечать параметрам, указанным в соответствующем сертификате производителя лекарственного средства.
Слайд 7
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ: ВИЗУАЛЬНЫЙ КОНТРОЛЬ
Упаковка проверяется на
соответствие маркировки данным, указанным в сертификате производителя.
В обязательном порядке
проверяются:
торговое название,
наименование лекарственной формы,
Наименование действующего вещества,
дозировки действующего вещества,
производителя,
регистрационный номер препарата в Украине,
номер серии,
дата выпуска и конечная дата годности препарата,
штрих-код,
наличие инструкции
голограмма или контроль вскрытия упаковки. (если предусмотрено производителем)
Проверяется качество упаковочного материала и полиграфического оформления упаковки лекарственного средства.
.
Слайд 8
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ: ВИЗУАЛЬНЫЙ КОНТРОЛЬ
Отклонения в оформлении
упаковки, другой оттенок типографской краски или смещение изображения, другое
качество картона, не говоря уж об отсутствии защитных знаков, иногда видимых лишь при специальном освещении, может говорить о фальсификации, так как производители обязаны строго придерживаться стандартов оформления, утвержденных на конкретные лекарственные средства.
Слайд 9
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
При любых сомнениях в качестве
или подлинности лекарственное средство не допускается в розничную продажу
или к медицинскому применению и помещается на карантинное хранение для проведения дополнительного контроля или лабораторного анализа.
Государственные инспекторы Государственной службы регулярно проводят проверки аптечных учреждений и ЛПУ на предмет соблюдения требований законодательства в сфере качества лекарственных средств.
В ходе проверок аптечных учреждений или ЛПУ инспекторами производятся изъятия лекарственных препаратов, которые по какойто причине вызвали сомнения в их качестве.
Слайд 10
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ: СОВРЕМЕННЫЕ ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
высокоэффективная жидкостная
хроматография,
газовая хроматография,
УФспектрофотометрия,
растворение и распадаемость,
определение температуры
плавления,
содержание спирта,
тонкослойная хроматография,
ИКспектрофотометрия,
атомноабсорбционная спектрофотометрия,
определение электропроводности и рН,
истираемость таблеток,
содержание эфирных масел в лекарственнорастительном сырье,
определение соответствия размеров таблеток и капсул с помощью микрометра.
Слайд 11
ГОСУДАРСТВЕННАЯ СИСТЕМА АККРЕДИТАЦИИ И АТТЕСТАЦИИ ЛАБОРАТОРИИ
Осуществлять контроль качества
лекарственных средств имеет право лаборатория, которая аккредитована и аттестованная.
Разработаны
отраслевые нормативные документы, которые регулируют процедуру аккредитации.
Процедуру осуществляет Государственная служба по контролю качества лекарственных средств и представители Держстандарту Украины
Принимаются во внимание: помещение, приборы и оборудование, осуществления микробиологического контроля, персонал
Слайд 12
ГОСУДАРСТВЕННАЯ СИСТЕМА АККРЕДИТАЦИИ И АТТЕСТАЦИИ ЛАБОРАТОРИИ
Помещение должно иметь
отдельную комнату для осуществления необходимых анализов. Как правило отдельные
дорогие приборы устанавливаются в отдельной комнате (ИК-спектрометр, жидкостный хроматограф, УФ-спектрофотометр), приборы для фармакопейного анализа. Вытяжная система, комната для хранения образцов, комната персонала. Отдельно - микробиологическая лаборатория.
Персонал – высшее фармацевтическое, биологическое или химическое образование.
Аттестация и аккредитации подлежат вся территориальная лаборатория контроля качества лекарственных средств, лаборатории ОТК предприятий.
Слайд 13
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ХИМИКО-ФАРМАЦЕВТИЧЕСКОМ ПРЕДПРИЯТИИ.
ЗАДАНИЕ
И ФУНКЦИЯ ОТК.
ПОЛОЖЕНИЕ ОБ ОТДЕЛЕ КОНТРОЛЯ КАЧЕСТВА ПРЕДПРИЯТИЙ,
КОТОРЫЕ ПРОИЗВОДЯТ СРЕДСТВА ЛЕЧЕНИЯ (НЕЗАВИСИМО ОТ ФОРМЫ СОБСТВЕННОСТИ И ПОДЧИНЕНИЯ)
ПРИКАЗ ГОСУДАРСТВЕННОГО КОМИТЕТА МЕДИЦИНСКОЙ И МИКРОБИОЛОГИЧЕСКОЙ ПРОМЫШЛЕННОСТИ ОТ 13 ОКТЯБРЯ 1998 ГОДА № 121.
Слайд 14
СИСТЕМА КОНТРОЛЯ КАЧЕСТВА
Система контроля качества является одним из
элементов GMP (надлежащей производственной практики) в структуре Системы качества.
Эта система регламентирует процедуру и действия, которые гарантируют то, что исходные и упаковочные материалы не будут допущены к производству, а готовая продукция не будет реализована до подтверждения их соответствующего качества.
Функцию контроля качества осуществляет Отдел контроля качества. (ОКК).
Слайд 15
ОТДЕЛ КОНТРОЛЯ КАЧЕСТВА (ОКК)
ОКК предприятия является самостоятельным и
независимым от других структурным подразделением.
Структура и штаты ОКК
разрабатываются с учетом характера, объема производства, а также с учетом трудоемкости контрольной операции и утверждаются Уполномоченным лицом по качеству (заместителем директора по качеству).
ОКК, как правило, состоит из лаборатории, которая осуществляет аналитический, микробиологический и фармакологический контроль качества продукции.
Слайд 16
ОТДЕЛ КОНТРОЛЯ КАЧЕСТВА (ОКК) ПРОВОДИТ:
Отбор пробы и
входной контроль субстанций, исходного сырья, полупродуктов, материалов первичной упаковки,
комплектующих изделий, печатной продукции, которые предназначаются для основного производства.
Контроль за правильным хранением. Периодический контроль их соответствия определенным требованиям при передаче со склада на производство и из цеха в цех.
Контроль соответствия всей продукции, которая выпускается предприятием, требованиям нормативной документации.
Периодический контроль правил хранения готовой продукции.
Оценку качества и стабильности каждого наименования выпущенной продукции в течение установленного срока ее пригодности.
Оформление документации, которая подтверждает соответствие качества продукции установленным требованиям, а в случае выявления несоотвествия – оформление запрета на использование в производстве и реализацию.
Слайд 17
ОТДЕЛ КОНТРОЛЯ КАЧЕСТВА (ОКК) ПРОВОДИТ:
Оформление документов для
обоснования и выдвигания претензий поставщикам.
Контроль за выполнением работы по
помещению в карантин и учету забракованной на предприятии, а также возвращенной потребителем продукции.
Анализ рекламаций и претензий потребителей с целью выявления причины отклонений качества и принятие соответствующих корректирующих действий.
Совместно с другими подразделами предприятия – валидация оборудования и средств измерения, методики контроля, помещений лаборатории ОКК.
Выборочный контроль соблюдения технологической дисциплины и требований промышленного регламента в цехах
Совместно с производственным отделом - разработка мероприятий, направленных на предупреждение брака и повышение качества продукции.
Отбор, оформление и отправление в соответствующие государственные органы образцов продукции на контроль
Слайд 18
СТАНДАРТ GLP
Стандарт GLP («Good Laboratory Practice», Надлежащая лабораторная
практика) — система норм, правил и указаний, направленных на обеспечение
согласованности и достоверности результатов лабораторных исследований.
Главная задача GLP — обеспечить возможность полного прослеживания и восстановления всего хода исследования. Контроль качества призваны осуществлять специальные органы, периодически инспектирующие лаборатории на предмет соблюдения нормативов GLP.
GLP устанавливает очень строгие требования к ведению и хранению документации — значительно более жесткие, чем европейские стандартыGLP устанавливает очень строгие требования к ведению и хранению документации — значительно более жесткие, чем европейские стандарты серии EN 45000. Сферы применения норм GLP устанавливаются законодательно. В первую очередь это относится к разработке новых химических веществ, получению и использованию токсичных веществ и к здравоохранению.
Слайд 19
СТАНДАРТ GLP
Настоящий стандарт устанавливает принципы надлежащей лабораторной практики,
предназначенные для применения при проведении неклинических испытаний объектов, содержащихся
в лекарственных веществах, пестицидах, косметической продукции, ветеринарных препаратов, пищевых и кормовых добавках, а также химических веществах промышленного назначения. Испытуемые препараты могут быть как синтетической природы, так и биогенного происхождения, а также представлять собой живые организмы.
В комплексе со стандартами GMPВ комплексе со стандартами GMP (Надлежащая производственная практика) и GCP (Надлежащая клиническая практика) призвана стандартизовать некоторые аспекты качества медицинского обслуживания населения.
Слайд 20
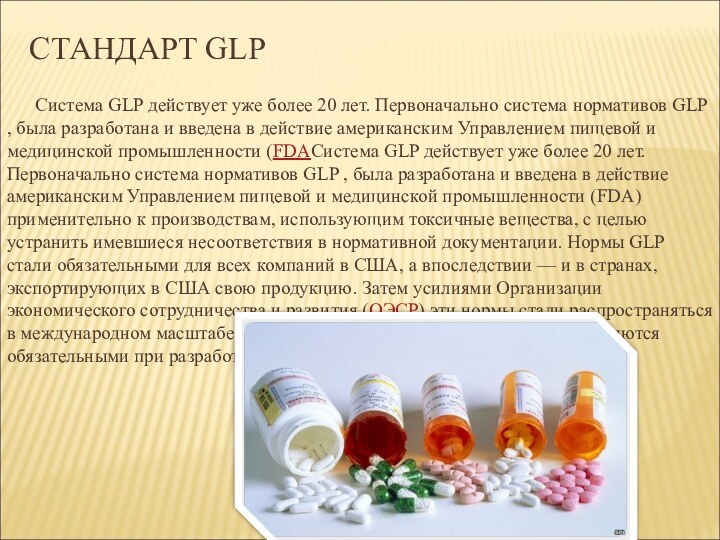
СТАНДАРТ GLP
Система GLP действует уже более 20 лет.
Первоначально система нормативов GLP , была разработана и введена
в действие американским Управлением пищевой и медицинской промышленности (FDAСистема GLP действует уже более 20 лет. Первоначально система нормативов GLP , была разработана и введена в действие американским Управлением пищевой и медицинской промышленности (FDA) применительно к производствам, использующим токсичные вещества, с целью устранить имевшиеся несоответствия в нормативной документации. Нормы GLP стали обязательными для всех компаний в США, а впоследствии — и в странах, экспортирующих в США свою продукцию. Затем усилиями Организации экономического сотрудничества и развития (ОЭСР) эти нормы стали распространяться в международном масштабе. В частности, в Германии требования GLP являются обязательными при разработке любых новых видов химической продукции.