Слайд 2
MHC (HLA-система) – обширный геномный регион (семейство генов),
расположенный на коротком плече 6-й хромосомы человека. Эти гены
имеют большое количество вариантов (аллелей), то есть обладают очень высоким полиморфизмом.
Генетика главного комплекса гистосовместимости
Слайд 3
Генетика главного комплекса гистосовместимости
Спектр аллелей каждого гена комплекса
HLA уникален для каждого организма и определяет его биологическую
индивидуальность. Существует более триллиона комбинаций, и практически невозможно найти людей, имеющих одинаковые сочетания HLA-антигенов (за исключением однояйцевых близнецов).
Слайд 4
Гены HLA группируются в подсемейства (локусы): A, B
и С кодируют антигены I класса, D - антигены
II класса. Названия генов и антигенов HLA состоят из одной или нескольких букв и цифр, например A3, B45, DR15, DQ4.
Буква обозначает ген (область и локус), а цифры - аллель этого гена (при этом цифровые обозначения присваиваются по мере открытия новых аллелей).
Слайд 5
По современным представлениям система HLA обеспечивает регуляцию иммунного
ответа, контролируя такие важнейшие физиологические функции, как взаимодействие иммунокомпетентных
клеток организма, распознавание клеток, запуск и реализация иммунного ответа. Сходный генетический регион найден у всех позвоночных и получил название «главный комплекс гистосовместимости» - Major Histocompatibility Complex (MHC).
Слайд 6
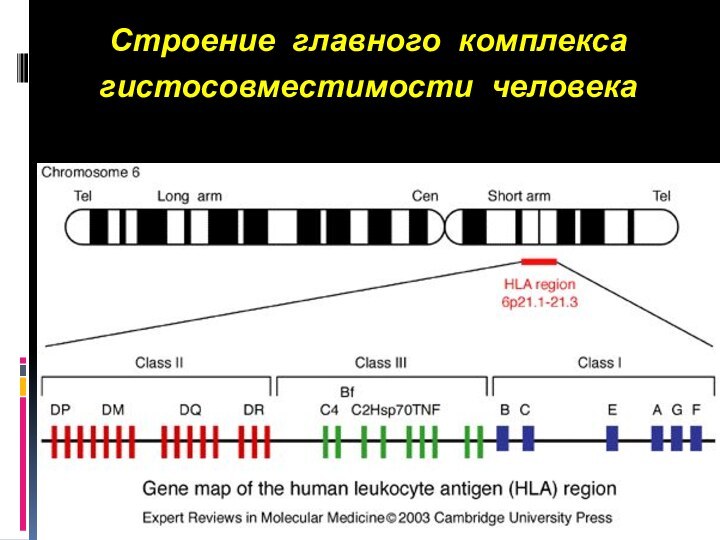
Строение главного комплекса гистосовместимости человека
Слайд 7
Упрощенная молекулярная карта главного комплекса гистосовместимости человека
Слайд 8
В соответствии с биохимическим строением и функцией HLA-антигены
подразделяются на антигены класса I, антигены класса II и
антигены класса III.
► HLA-антигены класса I кодируются генами локусов A, B и C и являются так называемыми трансплантационными антигенами. Они присутствуют на поверхности всех ядросодержащих клеток. HLA-антигены класса I необходимы для распознавания трансформированных клеток цитотоксическими Т-лимфоцитами.
Слайд 9
► HLA-антигены класса II кодируются генами локусов DR,
DP, DQ. Они располагаются в основном на мембранах B-лимфоцитов,
активированных T-лимфоцитов, лейкоцитов, моноцитов, макрофагов и дендритных клеток. Гены этого класса контролируют силу иммунного ответа.
► HLA-антигены класса III являются компонентами системы комплемента и цитокинами; кодируются генами локусов С2, С4а, С4в и др. Они контролируют синтез молекул комплемента - неспецифического фактора иммунной защиты организма.
Слайд 10
Аллельные варианты генов HLA-системы могут быть определены методом
аллель-специфичной ПЦР. В зависимости от цели исследования, проводится либо
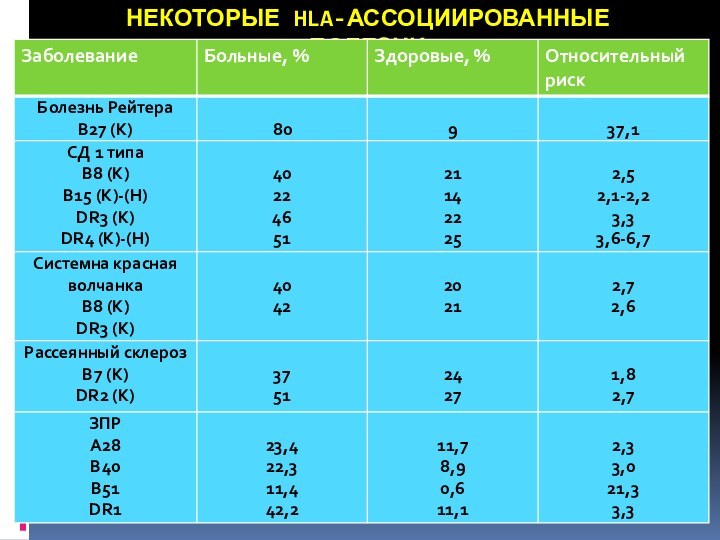
полное HLA-типирование, либо типирование отдельных семейств генов. В случае выяснения предрасположенности пациента к одному из заболеваний, связанных с определёнными сочетаниями аллелей, возможно типирование только этих вариантов генов. Например, при исследовании аллелей ряда генов HLA обнаружена взаимосвязь в виде повышенного риска возникновения таких заболеваний как сахарный диабет I типа, ревматоидные заболевания, аутоиммунный тиреоидит, восприимчивость к инфекционным заболеваниям и других.
Слайд 11
Основные принципы и механизмы ассоциации антигенов системы HLA
с заболеваниями
1. Генетический контроль иммунного ответа.
Ассоциации HLA-антигенов с
различными патологическими состояниями являются следствием аномального функционирования Ir-генов.
Будучи сцепленными с HLA-локусами, они обусловливают возникновение различных дефектов иммунитета, полагают, что сублокус HLA-D находится в I-области, в которой и расположены гены иммунного ответа, ответственные за его силу.
Слайд 12
Данные об ассоциации между МНС комплексом и болезнями
является подтверждением наличия связи генов иммунного ответа с HLA-системой.
Установлено увеличение частоты гаплотипа А1, В8, DR3 у больных с аутоиммунными заболеваниями. С указанными аллелями ассоциирована группа генов, определяющих высокую реактивность к различным агентам. У лиц с этими антигенами значительно снижена функциональная активность Т-супрессоров и высокий иммунный ответ на стимуляцию поликлональными антигенами.
С HLA-А3, В7, DR2 ассоциированы многие заболевания, для которых характерен сниженный иммунитет.
Слайд 13
2. Детерминантная теория заключается в том, что ассоциированные
с заболеванием HLA-молекулы обладают способностью связывать чужеродные пептиды или
аутоантигены в специальные конфигурации, которые запускают Т-клеточноопосредованные заболевания.
Слайд 14
3. Теория молекулярной мимикрии состоит в том, что
в результате идентичности антигенных детерминант возбудителя (вируса или бактерии)
с определенными HLA-молекулами или их фрагментами не наступает распознавание «чужого» и развитие адекватного иммунного ответа, в результате чего возбудитель «безнаказанно» поражает организм человека.
Именно с помощью данной теории объясняют развитие HLA-В27-ассоциированных заболеваний (болезни органов движения).
Поражения костно-мышечной системы вызываются микробными агентами: иерсиниями, клебсиеллами, шигеллами, сальмонеллами, хламидиями, кампилобактериями. Эти бактерии являются перекрестно реагирующими с HLA-В27, что приводит к развитию заболеваний.
Слайд 15
4. Рецепторная теория – чужеродный агент взаимодействует непосредственно
с определенными антигенами гистосовместимости, обладая повышенной тропностью к ним.
Примером может являться развитие вирусного гепатита В, ассоциированного с наличием антигенов HLA-В18 и В35.
5. Гипотеза модификации HLA-молекул заключается в следующем: антигены HLA, модифицированные инфекционным или другим агентом, распознаются в организме как «чужие» и против них развивается иммунный ответ (аутоиммунные заболевания – СД, ревматические болезни, заболевания щитовидной железы).
Слайд 16
6. Теория тимической селекции – недостаток презентации пептидов
HLA-аллелями во время тимической дифференциации, что приводит к развитию
аутоагрессии патологических Т-клеток.
Существуют и другие теории, объясняющие взаимосвязь между системой HLA и заболеваниями, которые требуют дальнейшего всестороннего дальнейшего изучения.
Слайд 17
Функциональное значение главного комплекса гистосовместимости заключается в реализации
важных биологических феноменов: трансплантации органов и тканей; генетическом контроле
иммунного ответа; межклеточном взаимодействии; осуществлении контроля активности комплемента; регуляции уровня и синтеза стероидных гормонов, процессов эмбриогенеза, уровня цАМФ; обеспечении резистентности или восприимчивости организма к ряду заболеваний.
Практическое значение. В клинической лабораторной диагностике типирование аллелей 1 класса HLA имеет важное значение в определении оптимальной гистосовместимости для поиска доноров при аллогенной трансплантации почек и костного мозга.
Клиническое значение имеет также идентификация В27 у пациентов анкилозирующим спондилитом (болезнь Бехтерева) и ряда других заболеваний из группы коллагенозов, ревматических заболеваний.
Слайд 18
Методика определения антигенов системы HLA І класса
По Терасаки
в модификации Ж. Доссе в стандартном двухступенчатом микролимфоцитотоксическом тесте.
Принцип
метода: двухэтапное влияние на лимфоциты периферической крови сначала иммунной сывороткой, которая удерживает антитела известной специфичности, а потом комплемента. Если лимфоциты имеют определенный антиген системы HLA, то состоится реакция клеточного лизиса, которая определяется проникновением в клетку красителя.
Слайд 19
Реактивы:
1.гистотипирующая панель HLA- А, В;
2. кроличий комплемент
(1мл лиофилизированного кроличьего комплемента развести в 1мл дестиллированной воды);
3.
градиент плотности «градимекс-верографин» (1,077г/см3)
4. раствор Хенкса
5. вазелиновое масло;
6. формалин 17%
7. раствор эозина К 5%.
8.раствор гепарина (1лм гепарина
(5 тис. единиц) растворить в 14мл физиологического раствора)
9. раствор NaCl 10%.
Слайд 20
Оборудование:
1. микропланшеты;
2. микрошприцы;
3. весы лабораторные ВЛТ-200;
4. центрифуга рефрижераторная
РС-6;
5. центрифуга ОПН-3;
6. камера Горяева;
7. микроскоп.
Слайд 21
Ход определения
1. Перед использованием разморозить микропланшеты, которые содержат
в каждой лунке по 1мкл анти-HLA-сыворотки в течение 10-15
минут.
2. В каждую лунку HLA-А, В планшеты добавить 1мкл суспензии лимфоцитов.
3. Инкубировать при комнатной температуре (20°) в течении 30 минут.
4. Добавить 5 мкл кроличьего комплемента.
5. Инкубировать при комнатной температуре (20°) в течение 60 минут.
6. Добавить 3 мкл 5% раствора эозина, через 5 мин. 5 мкл формальдегида (37%) для фиксации.
7. Учет реакции проводить не раньше, чем через 30 минут.
Слайд 22
В настоящее время для типирования HLA используются следующие
методы ПЦР:
1. ПЦР с
мечеными, специфичными по своей последовательности олигонуклеотидами (ПЦР-СПО);
2. ПЦР со специфическими по своей последовательности праймерами (ПЦР-СПП), которые занимают главное место в лабораторной диагностики гистотипирования для алогенной трансплантации почек и костного мозга.
Слайд 23
ПЦР с мечеными, специфичными по своей последовательности олигонуклеотидами
(ПЦР-СПО)
Вначале в ПЦР-СПО амплифицируют районы матричной ДНК отдельных
генов HLA региона. Продукты амплификации фиксируют на нейлоновой мембране и гибридизируют со специфичными по своей последовательности, химически или радиактивно мечеными, олигонуклеотидами. Определение конкретного аллеля основано на том, что при достаточном выборе олигонуклеотидов, положительная гибридизация имеет место в том случае, когда определенный олигонуклеотид комплементарен соответствующей последовательности на амплифицированных продуктах матричной ДНК.
Слайд 24
При наличии достаточного количества специфических праймеров и олигонуклеотидов
метод СПО позволяет идентифицировать все известные аллели локуса. Для
всех импринтированных генных локусов II класса существуют хорошо отработанные протоколы СПО, даже с высокой распределительной способностью.
Слайд 25
ПЦР со специфичными по своей последовательности праймерами (ПЦР-СПП)
Принцип
ПЦР-СПП (аллельспецифичная амплификация) состоит в том, что амплификация специфичного
продукта в ПЦР осуществляется только в том случае, когда 3′ - конец праймера комплементарен к целевой последовательности матричной ДНК. Одно единственное различие между последовательностями нуклеотидов матричной ДНК и соответствующего праймера мешает амплификации в ПЦР, что обусловливает высокую специфичность метода СПП в идентификации аллелей. Для контроля амплификации к каждой пробе добавляется еще одна пара праймеров. Она обеспечивает создание продукта ПЦР при любых условиях амплификации, независимо от типа HLA.
Слайд 26
В отличие от метода СПО (от 1 до
3 суток), идентификация отдельных аллелей осуществляется на основе амплификации
(гибридизация не нужна). Разделение отдельных аллелей или их групп осуществляется на основе амплификации при электрофорезе в агарозном геле, где продукты ПЦР разделяют по их длине и визуализируют в ультрафиолетовом излучении (1-2 часа).
Слайд 27
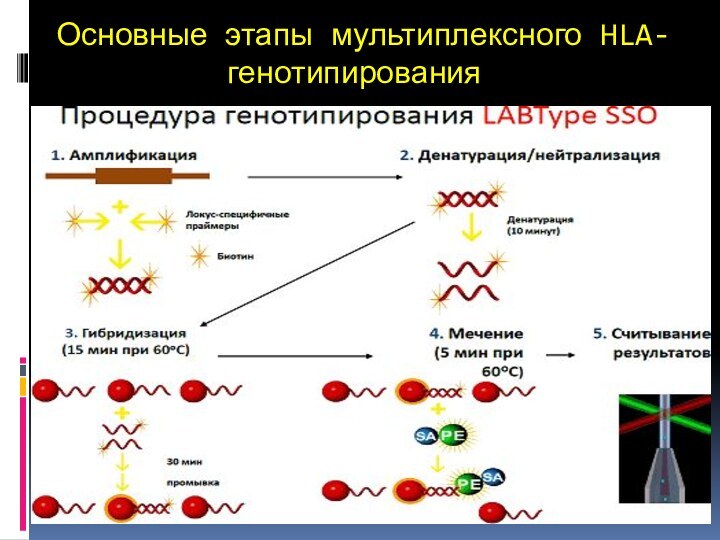
Основные этапы мультиплексного HLA-генотипирования
Слайд 28
Высокий полиморфизм делает систему HLA великолепным маркером в
популяционно-генетических исследованиях и изучении генетической предрасположенности к заболеваниям.
Слайд 29
Популяционные исследования, проведенные во многих странах мира, выявили
характерные различия в распределении HLA-антигенов в разных популяциях. Особенности
распределения HLA-антигенов используются в генетических исследованиях для изучения структуры, происхождения и эволюции различных популяций. Например, грузинская популяция относится к южным европеоидам, имеет сходные черты HLA-генетического профиля с греческой, болгарской, испанской популяциями, указывающими на общность их происхождения. Эти особенности учитываются при изучении связи HLA с заболеваниями.
Слайд 30
В популяциях, различающихся по HLA-генетическому профилю, могут выявляться
разные HLA-маркеры одной и той же болезни.
Слайд 31
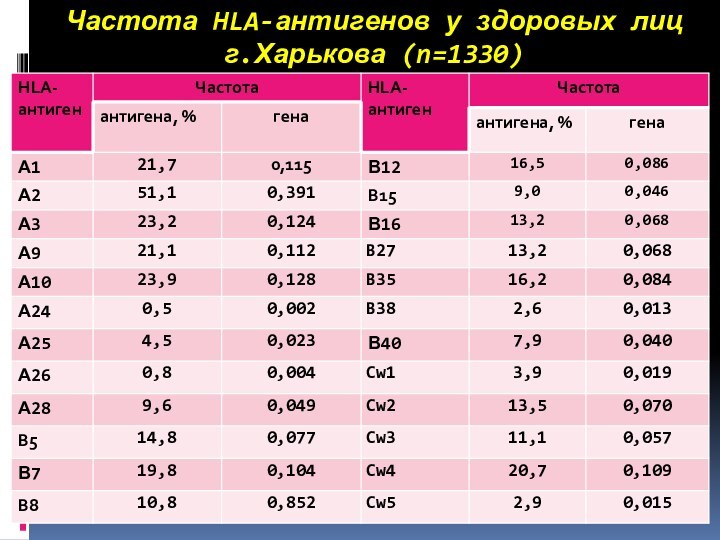
Частота HLA-антигенов у здоровых лиц
г.Харькова (n=1330)
Слайд 32
Генетическое расстояние HLA-антигенов между харьковской и другими популяциями
Слайд 33
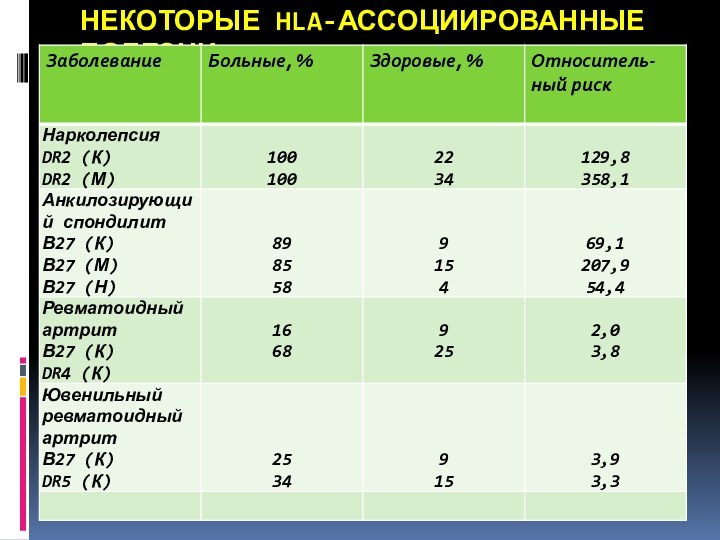
НЕКОТОРЫЕ HLA-АССОЦИИРОВАННЫЕ БОЛЕЗНИ