Слайд 2
Инфекция (от лат. infectio – заражение, загрязнение) или
инфекционный процесс – это совокупность физиологических и патологических адаптационных
и репарационных реакций, которые возникают в макроорганизме в процессе взаимодействия с патогенными микроорганизмами, вызывающими нарушения его внутренней среды и физиологических функций.
– это эволюционно сложившиеся взаимодействие восприимчивого макроорганизма и патогенных микроорганизмов в определенных условиях внешней среды.
Инфекционное заболевание – это крайняя степень развития инфекционного процесса, проявляющегося различными клиническими признаками и лабораторными изменениями.
Условия возникновения инфекционного процесса:
наличие патогенного микроорганизма;
наличие восприимчивого макроорганизма;
определенные условия внешней среды.
Слайд 3
Роль микроорганизма в развитии инфекционного процесса.
Вероятность развития инфекционного

заболевания в значительной степени определяют:
Видовые свойства возбудителя.
Количество
возбудителя – при попадании в организм незначительного числа патогенных микроорганизмов их обычно эффективно элиминируют защитные силы макроорганизма, для развития заболевания необходима инфицирующая доза возбудителя.
Инфицирующая доза возбудителя (Di) – это минимальное количество микробных клеток, способных вызвать инфекционный процесс.
Пути и место проникновения возбудителя в организм.
Входные ворота инфекции – ткани, лишенные физиологической защиты против конкретного вида микроорганизма, служат местом его проникновения в макроорганизм. Например, слизистая оболочка трахеи и бронхов являются входными воротами пневмококков, вирусов гриппа, кори и др; слизистая оболочка кишечного тракта – для шигелл, сальмонелл, холерного вибриона; цилиндрический эпителий мочеполового тракта – для гонококков, уретральных микоплазм, хламидий. Ряд возбудителей проникает в организм несколькими путями (стафилококки, протеи, чума и др.) – для них характерен пантропизм.
Скорость размножения возбудителя.
Слайд 4
Роль макроорганизма в развитии инфекционного процесса.
Возникновение инфекционного заболевания
и особенности его клинического проявления зависят от общей физиологической
реактивности организма (т.е. его способности вступать во взаимодействие с микроорганизмом и реагировать на него как на фактор, нарушающий нормальные физиологические функции)
Слайд 5
Роль факторов внешней среды в развитии инфекционного процесса.
Климатические

условия. В различных климатических зонах юга и севера наблюдается
разный уровень заболеваемости кишечными инфекциями, дифтерией, скарлатиной, респираторными вирусными инфекциями.
Температура – охлаждение, перегрев снижает резистентность макроорганизма к инфекции.
Солнечный свет благоприятно влияет на организм и в значительной степени повышает резистентность к инфекционным заболеваниям. Однако в ряде случаев длительное и интенсивное облучение сопровождается понижением устойчивости человеческого организма к ряду патогенных микроорганизмов.
Ионизирующая радиация. Повышенные дозы радиации ослабляют защитно-барьерные функции организма и значительно повышают восприимчивость к различным инфекциям.
Экологическая обстановка – загрязнение воды, воздуха, почвы, особенно в крупных городах, приводит к увеличению частоты инфекционных заболеваний.
Санитарно-гигиенические условия труда и быта.
Чрезвычайно важны и социальные факторы внешней среды: стрессовые ситуации в связи с социально-экономическими и военными конфликтами, состояние здравоохранения, доступность квалифицированной медицинской помощи.
Слайд 6
Механизмы, факторы и пути передачи инфекционного агента.
Механизм передачи
возбудителя – это эволюционно сложившийся способ перемещения возбудителя от
источника инфекции к восприимчивому организму человека или животного.
Факторы передачи – элементы внешней среды, обеспечивающие перенос возбудителя от одного организма к другому (6 основных факторов – воздух, вода, почва, пища, предметы обихода и живые переносчики).
Пути передачи – это способ проникновения возбудителя в восприимчивый макроорганизм.
Слайд 9
Экзогенная инфекция – инфекция, возникающая в результате заражения

человека патогенными микроорганизмами, поступающими из окружающей среды с пищей,
водой, воздухом, почвой, выделениями больного.
Эндогенная инфекция – инфекция, вызываемая представителями нормальной микрофлоры – условно-патогенными микроорганизмами самого индивидуума.
Аутоинфекция – разновидность эндогенной инфекции, которая возникает в результате самозаражения путем переноса возбудителя из одного биотопа в другой.
Местная (очаговая) инфекция – микроорганизмы локализуются в местном очаге. Генерализованная инфекция – инфекция, при которой возбудитель распространяется по организму лимфагенным или гематогенным путем.
Бактериемия/вирусемия – распространение возбудителя гематогенным путем, при этом кровь является механическим переносчиком возбудителя, т.к. микроорганизмы в ней не размножаются.
Токсинемия – наличие микробных токсинов в крови.
Сепсис (от греч. sepsis – гниение) – генерализованная форма инфекции, характеризующаяся размножением возбудителя в крови. Выделяют 2 формы сепсиса:
Септицемия (первичный сепсис) – возбудитель сразу из входных ворот попадает в кровь и размножается в ней.
Септикопиемия (вторичный метастатический сепсис) развивается в результате генерализации локального инфекционного процесса и характеризуется возникновением вторичных гнойных очагов во внутренних органах.
Токсико-септический шок (бактериальный) – возникает при массивном поступлении бактерий и их токсинов в кровь.
Моноинфекция вызывается одним видом возбудителя, смешанная – двумя или несколькими.
Острая инфекция протекает в короткие сроки (до 1-3 мес.).
Подострая инфекция протекает в сроки от 4 до 6 месяцев.
Хроническая инфекция характеризуется длительным пребыванием микроорганизмов в организме (более 6 мес.).
Слайд 10
Антропонозы – болезни, при которых только человек является

источником инфекции (дифтерия, коклюш, лепра).
Зоонозы – болезни, при которых
источником инфекции являются животные (бешенство, туляремия, бруцеллез).
Антропозоонозы – источником инфекции могут быть как животные, так и человек.
Сапронозы – инфекционные болезни, возбудители которых являются свободно-живущими в окружающей среде организмами (легионеллез).
Спорадическая заболеваемость – единичные, не связанные между собой заболевания.
Эпидемическая вспышка – групповые заболевания, связанные одним источником инфекции и не выходящие за пределы семьи, коллектива, населенных пунктов.
Эпидемия – широкое распространение инфекционной болезни, охватывающее население региона, страны или нескольких стран.
Пандемия – распространяется во многих странах или даже во всех частях света.
Эндемия (природно-очаговое заболевание) – постоянно регистрируемая на определенной территории заболеваемость, обусловленная социальными и природными условиями.
Экзотическая заболеваемость – заболеваемость, не свойственная данной местности, развивается в результате заноса или завоза возбудителя с других территорий.
Вторичная инфекция – к первоначальной болезни присоединяется другая, вызванная новым возбудителем.
Реинфекция – заболевание, возникающее после перенесенной инфекции в случае повторного заражения тем же возбудителем.
Суперинфекция – инфицирование макроорганизма тем же возбудителем еще до выздоровления.
Рецидив – возврат клинических проявлений болезни без повторного заражения за счет оставшихся в организме возбудителей.
Карантинные заболевания – особо опасные инфекции, система информации и меры профилактики которых обусловлена международным соглашением (конвенцией – 01.10.1952 г. Международные медико-санитарные правила). К ООИ относятся чума, холера, раньше натуральная оспа, желтая лихорадка, вирусные геморрагические лихорадки Ласса, Марбург и Эбола, малярия и другие инфекции, передаваемые комарами (лихорадки денге, Чинкунгунья, Рифт-валли, Западного Нила, западный, восточный и венесуэльский энцефаломиелиты, японский, калифорнийский, Сан-Луи и долины Муррей энцефалиты.)
Слайд 11
Периоды инфекционного заболевания.
I. Инкубационный период (от лат. incubation

– скрытый) – промежуток времени от проникновения возбудителя в
организм и появления первых клинических симптомов заболевания. Характеризуется адгезией возбудителя на чувствительных клетках и адаптацией к внутренней среде макроорганизма. Длительность инкубационного периода различна при разных инфекциях (от нескольких часов до нескольких лет) и даже у отдельных больных, страдающих одним и тем же заболеванием. Она зависит от вирулентности возбудителя и его инфицирующей дозы, локализации входных ворот, состояния организма человека перед заболеванием, его иммунного статуса. Больной не представляет опасности для окружающих, поскольку возбудитель обычно не выделяется из организма человека в окружающую среду.
II. Продромальный (начальный) период (от лат. prodromos – предвестник) – появление неспецифических симптомов заболевания. В данный период возбудитель интенсивно размножается и колонизирует ткань в месте его локализации, а также начинает продуцировать соответствующие ферменты и токсины. Клинические признаки заболевания в этот период не имеют четких специфических проявлений и зачастую одинаковы при разных заболеваниях: повышение температуры тела, головная боль, миалгии и артралгии, недомогание, разбитость, снижение аппетита и т.д. Обычно продолжается от нескольких часов до нескольких дней. При многих инфекционных заболеваниях возбудители в продромальный период не выделяются во внешнюю среду (исключение, корь, коклюш и др.).
III. Разгар болезни – появление и нарастание наиболее характерных, специфичных для конкретного инфекционного заболевания клинических и лабораторных признаков. В начале данного периода обнаруживаются специфические антитела (IgM) в сыворотке крови больного, титр которых в дальнейшем увеличивается и в конце периода синтез IgM заменяется на синтез IgG и IgА. Возбудитель продолжает интенсивно размножаться в организме, накапливаются значительные количества токсинов и ферментов. Вместе с тем, происходит выделение возбудителя из организма больного, вследствие чего он представляет опасность для окружающих.
IV. Исход заболевания:
выздоровление (реконвалесценция);
микробоносительство;
переход в хроническую форму;
летальный.
Реконвалесценция развивается после угасания основных клинических симптомов. При полном выздоровлении восстанавливаются все функции, нарушенные вследствие инфекционного заболевания. Титр антител достигает максимума. При многих заболеваниях в период реконвалесценции возбудитель выделяется из организма человека в большом количестве.
Слайд 12
Патогенность, вирулентность, единицы измерения.
Патогенность (от греч. pathos –
страдание, genos – происхождение) – потенциальная способность микроорганизмов вызывать
инфекционный процесс (генетически детерминированный, видовой признак, являющийся качественной характеристикой).
Вирулентность (от лат. virulentus – ядовитый, заразный) – фенотипическое выражение патогенности, т.е. каким образом реализуется патогенность в зависимости от условий (количественная характеристика, индивидуальный признак).
Слайд 13
Условия, влияющие на вирулентность:
условия культивирования (благоприятные или неблагоприятные);
действие
различных физических и химических фаторов (NaCl, желчь, фенол, Н2О2
и др.);
возраст культуры;
пассаж через организм восприимчивого животного.
Слайд 14
Единицы измерения вирулентности:
Dlm (Dosis letalis minima) – наименьшее
количество микроорганизмов, вызывающих не менее 95% гибели лабораторных животных.
Dl50
– летальная доза, вызывающая гибель 50% животных (наиболее объективный критерий).
Dc (Dosis cerata letalis) – смертельная доза 100% гибели животных.
Di (ID) – инфицирующая доза возбудителя.
ID50 – эффективная доза, вызывающая симптомы заболевания у 50% животных.
ID100 – симптомы у 100% животных.
Слайд 15
Факторы патогенности микроорганизмов.
Факторы патогенности – факторы инфекционного агента
(возбудителя), вызывающие серьезные нарушения в клетках или органах макроорганизма,
тем самым способствующие становлению инфекционного процесса.
В зависимости от наличия факторов патогенности все микроорганизмы подразделяются на:
патогенные (от греч. patos – болезнь) – болезнетворные, т.е. способные вызвать инфекционное заболевание;
условно-патогенные – вызывают заболевания при определенных условиях;
сапрофитные (от греч. sapros – гнилой и phyton – растения) – непатогенные/неболезнетворные, не вызывают заболевания у человека.
Слайд 16
Факторы патогенности
Патогенность как биологический признак бактерий реализуется через
их 4 свойства:
Инфекциозность,
Инвазивность,
Токсигенность,
Токсичность
Слайд 17
Под инфекциозностью (или инфективностью) понимают способность возбудителей проникать в организм
и вызывать заболевание, а также способность микробов передаваться с
помощью одного из механизмов передачи, сохраняя в этой фазе свои патогенные свойства и преодолевая поверхностные барьеры (кожу и слизистые). Она обусловлена наличием у возбудителей факторов, способствующих его прикреплению к клеткам организма и их колонизации.
Под инвазивностью понимают способность возбудителей преодолевать защитные механизмы организма, размножаться, проникать в его клетки и распространяться в нем.
Токсигенность бактерий обусловлена выработкой ими экзотоксинов. Токсичность обусловлена наличием эндотоксинов. Экзотоксины и эндотоксины обладают своеобразным действием и вызывают глубокие нарушения жизнедеятельности организма.
Слайд 18
Основные факторы вирулентности микробов
Под факторами вирулентности понимают приспособительные
механизмы возбудителей инфекционных болезней к меняющимся условиям макроорганизма.
По функциональному
значению их разделяют на четыре группы:
1) микробные ферменты, деполимеризующие структуры, препятствующие проникновению и распространению возбудителя в макроорганизме;
2) поверхностные структуры бактерий, способствующие закреплению их в макроорганизме;
3) поверхностные структуры бактерий, обладающие антифагоцитарным действием;
4) факторы патогенности с токсической функцией.
Слайд 19
К первой группе относятся:
Гиалуронидаза. Действие этого фермента

в основном сводится к повышению проницаемости тканей. Кожа, подкожная
клетчатка и межмышечная клетчатка содержат мукополисахариды и гиалуроновую кислоту, которые замедляют проникновение через эти ткани чужеродных веществ, даже в жидком состоянии. Гиалуронидаза способна расщеплять мукополисахариды и гиалуроновую кислоту, в результате чего повышается проницаемость тканей и микроорганизм свободно продвигается в ткани. Синтезируют этот фермент бруцеллы, гемолитические стрептококки, клостридии и другие микроорганизмы.
Фибринолизин. Некоторые штаммы гемолитического стрептококка, стафилококков, иерсиний синтезируют фибринолизин, который разжижает плотные сгустки крови (фибрин). Гиалуронидаза и фибринолизин увеличивают способность патогенных микробов генерализировать процесс и устраняют химико-механические препятствия на пути внедрения микробов в глубь тканей.
Нейраминидаза отщепляет от различных углеводов связанные с ними гликозидной связью концевые сиаловые кислоты, которые деполимеризуют соответствующие поверхностные структуры эпителиальных и других клеток организма, разжижают носовой секрет и муцинозный слой кишечника. Синтезируется она иерсиниями, некоторыми клостридиями, стрептококками, вибрионами др.
Слайд 20
ДНК-азы (дезоксирибонуклеазы) деполимеризуют нуклеиновую кислоту, обычно появляющуюся при
разрушении лейкоцитов в воспалительном очаге на месте внедрения микробов.
Продуцируется фермент стафилококками, стрептококками, клостридиями и некоторыми другими микробами.
Коллагеназа гидролизует входящие в состав коллагена, желатина и других соединений пептиды, содержащие пролин. В результате расщепления коллагеновых структур наступает расплавление мышечной ткани. Вырабатывают фермент клостридии.
Коагулаза. Плазма крови человека быстро свертывается вирулентными штаммами золотистого стафилококка, таким же свойством обладают некоторые штаммы кишечной палочки вследствие выработки перечисленными микроорганизмами фермента коагулазы.
Слайд 21
Вторая группа включает в себя такие структурные компоненты
микроорганизмов, как ворсинки, жгутики, пили, липотейхоевые кислоты, липопротеиды и
липополисахариды, способствующие закреплению их в макроорганизме.
Это явление названо адгезией, т. е. способностью микроба адсорбироваться (прилипать) на чувствительных клетках. Адгезивность хорошо выражена у эшерихий, которые продуцируют соответствующие белковые антигены, позволяющие бактериям прикрепляться к слизистой тонких кишок, накапливаться здесь в больших количествах, продуцировать токсины и таким образом поражать макроорганизм.
Слайд 22
Третья группа: поверхностные структуры, обладающие антифагоцитарным действием. К
ним относятся А-протеин золотистого стафилококка, М-протеин пиогенного стрептококка, vi
-антиген сальмонелл, липиды корд-фактора микобактерий туберкулеза и др. Механизм антифагоцитарного действия этих микробов объясняют не токсигенностью, а способностью блокировать антитела, способствующие фагоцитозу.
Бациллы сибирской язвы, пневмококки могут синтезировать выраженную капсулу, хорошо заметную в мазках. Доказано, что капсульное вещество — полисахарида у пневмококков, полипептид d -глутаминовой кислоты у сибиреязвенной бациллы — не простая механическая преграда для бактерицидных факторов организма, химических, лекарственных веществ, антибиотиков. Капсула подавляет фагоцитоз бактерий, обеспечивает их устойчивость к антителам и усиливает их инвазионные свойства.
Слайд 23
Четвертая группа включает в себя токсины.
Различают экзо-
и эндотоксины.
Экзотоксины — высокоактивные яды, выделяемые микроорганизмом на
протяжении его жизни в качестве продуктов обмена в окружающую среду. Экзотоксины в основном образуют грамположительные микроорганизмы (возбудители ботулизма, столбняка, газовой гангрены и др.),
Эндотоксины — менее ядовитые по сравнению с экзотоксинами вещества, образующиеся в результате распада микробной клетки. Следовательно, эндотоксины представляют собой фрагменты или отдельные химические компоненты микробных клеток. Эндотоксины образуют клетки грамотрицательных микробов (сальмонеллы, кишечная палочка, протей и др.).
Слайд 24
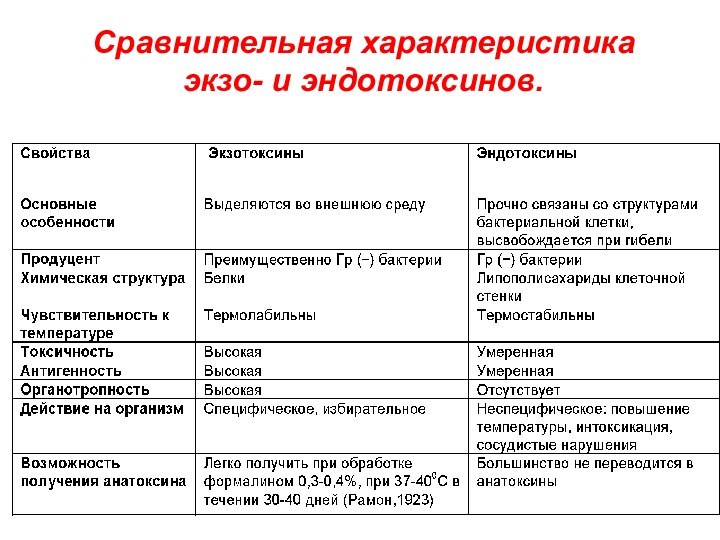
Сравнительная характеристика
экзо- и эндотоксинов.
Слайд 25
Классификация экзотоксинов по механизму действия:
Цитотоксины блокируют синтез белка

на рибосомах (например, дерматонекротоксин дифтерийной палочки, энтеротоксин золотистого стафилококка,
антиэлонгаторы синегнойной палочки).
Мембранотоксины повышают проницаемость мембраны эритроцитов (гемолизины) и лейкоцитов (лейкоцидины), вызывая гемолиз первых и разрушение вторых (например, α-токсин золотистого стафилококка, О-стрептолизин Str. рyogenes).
Токсины, активирующие пути метаболизма вторичных мессенджеров («посредников», или внутриклеточных сигнальных молекул, высвобождаемых во внутриклеточных сигнальных каскадах в ответ на стимуляцию рецепторов, что запускает те или иные физиологические изменения: рост, развитие и дифференцировка клеток и т.д.) активируют клеточную аденилатциклазу, что приводит к повышению проницаемости стенки тонкой кишки и увеличению выхода жидкости в ее просвет – диарее (холероген холерного вибриона, энтеротоксин E. coli).
Функциональные блокаторы – нейротоксины возбудителей столбняка и ботулизма блокируют передачу нервного импульса.
Активаторы иммунного ответа (эксфолиатины и эритрогенины) влияют на процесс взаимодействия клеток между собой (например, продуцируются St. aureus и Str. рyogenes).
Слайд 26
Плазмокоагулаза
Плазмокоагулазу выявляют путем внесения выделенной культуры в пробирку

со стандартной сухой цитратной плазмой кролика.
Перед употреблением в
ампулу добавляют 1 мл изотонического раствора хлорида натрия и после полного растворения ее разводят 1:5. Плазма человека малопригодна для постановки реакции плазмокоагуляции, поскольку в ней могут быть консерванты, лекарственные вещества, антитела, которые могут подавлять образование плазмокоагулазы.
Полную петлю культуры стафилококков эмульгируют в плазме и помещают в термостат на 3 часа, затем оставляют при комнатной температуре на 18-20 часов. Предварительный учет свертывания плазмы проводят через 3 ч, окончательный - на второй день.
Если выделенная культура вызывает гемолиз, коагулирует плазму и дает положительную лецитовителлазную реакцию, уже на третий день можно выдать результат на наличие S. aureus. Если культура обладает только плазмокоагулазой или только вителлазной активностью, для окончательного установления вида стафилококка необходимо определить дополнительные критерии патогенности: например, ферментацию маннита в анаэробных условиях, ДНК-азную активность, продукцию лизоцима, фосфатазы, а также определить чувствительность к новобиоцину.