Слайд 3
Нарушения белкового обмена
1. Нарушение расщепления белков и всасывания
аминокислот в ЖКТ
2. Замедление поступления аминокислот в органы и
ткани;
3.Нарушение биосинтеза белка;
4. Нарушение промежуточного обмена аминокислот;
5. Изменение скорости распада белка;
6. Патология образования конечных продуктов белкового обмена.
Слайд 4
1. Нарушение расщепления белков и всасывания аминокислот в
ЖКТ
Слайд 5
Этиология.
Причины нарушения расщепления белков и всасывания аминокислот
в ЖКТ:
1. Уменьшение секреции соляной кислоты и ферментов (при
различных формах патологии желудка и кишечника — хронических гастритах, язвенной болезни, раке)
2. Недостаточное образование аминокислот,
3. Расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и кишечника
Слайд 6
Патогенез
1. В результате стресса активируется система гипоталамус-гипофиз-кора
надпочечников
2. Увеличивается образование глюкокортикоидов и тироксина, которые стимулируют
распад белка в мышцах, желудочно-кишечном тракте, лимфоидной системе.
2. Аминокислоты усиленно выводятся из организма, обеспечивая формирование отрицательного азотистого баланса.
3. Мобилизация белка является одной из причин дистрофии, в том числе в мышцах, лимфоидных узлах, желудочно-кишечном тракте, что усугубляет нарушение расщепления и всасывания белков.
Слайд 7
Основной причиной недостаточного поступления белка в организм является
голодание
Виды белкового голодания:
1. Квшиоркор - несбалансированная алиментарная недостаточность белка
2. Алиментарная дистрофия - сбалансированная алиментарная недостаточность белка
Слайд 8
1. Квашиоркор - вид тяжёлой дистрофии. Это название
произошло от одного из языков побережья Ганы, и буквально
означает «первый-второй», и означает «отвергнутый», отражая, что состояние начинается у старшего ребенка после отлучения от груди, часто из-за того, что в семье родился еще один ребенок.
Слайд 9
Патогенез
Нарушение развития ребенка, дистрофические изменения органов и тканей,
обусловленные недостаточностью белка, ферментов, витаминов и микроэлементов из материнского
молока, необходимых для роста.
Когда ребенка кормят грудью, он получает определенные аминокислоты, необходимые для роста из материнского молока. Когда ребенка отлучают от груди, в случае, когда продукты, заменяющие материнское молоко, содержат много крахмалов и сахаров и мало белков (как это обычно случается в странах, где основная диета людей состоит из крахмалосодержащих овощей, или там, где начался массовый голод), у ребенка может начаться квашиоркор.
Слайд 10
2. Алиментарная дистрофия (алиментарное истощение, голодный отек, безбелковый
отек, отечная болезнь, голодная болезнь) — заболевание, развивающееся вследствие
продолжительного и выраженного недоедания, голодания и характеризующееся прогрессирующим исхуданием, часто сопровождающимся распространенными отеками.
Слайд 11
Этиология и патогенез
1. Основной этиологический фактор алиментарной
дистрофии — низкая калорийность пищи. Условно можно принять, что
снижение энергетической ценности пищи на 40—50% против исходной нормальной калорийности приводит к развитию болезни. Характерно резкое уменьшение содержания белка (до 20—10 г/сут) и относительное преобладание углеводов.
2. Одновременно в пище, как правило, снижается содержание аскорбиновой кислоты, витаминов В1, В2, B3, А и др.
3. Присоединение кишечных инфекций форсирует этот процесс. Встречаются редкие случаи неврогенной анорексии, при которых исхудание достигает стадии кахексии.
Слайд 12
Классификация. По тяжести выделяют 3 стадии болезни:
1. К
I стадии относят случаи, когда сильно исхудавшие люди еще
сохраняют некоторую трудоспособность; они жалуются на слабость, зябкость, учащенное мочеиспускание, усиление аппетита и жажду; у них обычно определяется умеренная гипопротеинемия за счет снижения содержания сывороточного альбумина.
2. Резкое исхудание, утрата работоспособности, но еще сохраняющаяся возможность двигаться, обслуживать себя характерны для II стадии алиментарной дистрофии. Часто у этих больных появляются периферические отеки, наблюдается дальнейшее снижение уровня сывороточного альбумина, часты гипогликемии.
3. При III стадии тяжести больной резко истощен, часто не в состоянии самостоятельно сесть в кровати, лежит, обычно неподвижно и безучастно на боку с согнутыми в коленях ногами. Появление голодной комы (даже если она развилась у больного, продолжавшего трудиться) должно указывать на наличие III стадии заболевания.
.
Слайд 13
2. Замедление поступления аминокислот в органы и ткани
Слайд 14
Этиология.
Генетически детерминированная или приобретённая дисфункция канальцевого транспортёра
(беллки-переносчики)
Слайд 15
Патогенез
Всосавшиеся из кишечника аминокислоты поступают непосредственно в
кровь и частично в лимфатическую систему. В норме аминокислоты,
всосавшиеся в кровь из кишечника, циркулируют в крови 5 — 10 мин и очень быстро поглощаются печенью и частично другими органами (почками, сердцем, мышцами).
Увеличение времени этой циркуляции указывает на нарушение способности тканей и органов (в первую очередь печени) поглощать аминокислоты. В результате в крови повышается количество протеиногенных аминов которые повреждают различные органы и системы. Формируется форма нарушений обмена — аминоацидурии.
Слайд 16
Аминоацидурия (аминокислотурия) - увеличение экскреции аминокислот с мочой
или присутствие в моче продуктов аминокислот, которые в норме
не содержатся в ней (например, кетоновые тела).
Слайд 17
Типы аминоацидурии
Тип 1. Почечные аминоацидурии развиваются при генетически
детерминированной или, реже, приобретённой дисфункции соответствующего канальцевого транспортёра.
Клиника.
Повышенная
экскрецией аргинина, лизина и орнитина.
Увеличение содержания в крови ионов аммония
Тяжёлый алкалоз, сопровождающийся рвотой, слабостью, нарушением сознания.
Тип 2. Непочечные аминоацидурии
Клиника.
Повышенная экскрецией аргинина, лизина и орнитина.
Не наблюдается увеличения содержания в крови ионов аммония
Умственная отсталость
Слайд 19
Этиология.
1. Алиментарная недостаточность (полное, неполное голодание, отсутствие
в пище незаменимых аминокислот, нарушение количественных соотношений между незаменимыми
аминокислотами, поступающими в организм). При отсутствии в клетках хотя бы одной из 20 незаменимых аминокислот прекращается синтез белка в целом.
2. Расстройство функции генетических структур, на которых происходит этот синтез
3. Нарушение регуляции биосинтеза белков. Интенсивность и направленность белкового обмена регулируют нервная и эндокринная системы, действие которых заключается, вероятно, в их влиянии на различные ферментные системы.
Слайд 20
Количественные изменения в биосинтезе белков органов и крови,
приводят к нарушению соотношений отдельных фракций белков в сыворотке
крови - диспротеинемии.
Выделяют две формы диспротеинемий:
1. Гиперпротеинемия (увеличение содержания всех или отдельных видов белков)
2. Гипопротеинемия (уменьшение содержания всех или отдельных белков).
Слайд 21
1. Гиперпротеинемия - изменения белкового состава в форме
относительного или абсолютного увеличения содержания всех или отдельных белков.
Причины гипопротеинемии:
1) Компенсаторный синтез глобулинов при нарушении синтеза альбумина, например, при хронических диффузных поражениях печени;
2) Повышенный синтеза антител, фибриногена, галтоглобина, С-реактивного белка, что наблюдается при инфекции, воспалении, некрозе и т.д.;
3) Синтез аномальных белков - парапротеинов, что характерно для плазмоцитомы, микроглобулинемии, криоглобулинемии и т.д.;
4) Переход в кровь клеточных белков.
Слайд 22
2. Гипопротеинемия - уменьшение относительного или абсолютного содержания
всех или отдельных белков.
Причины гипопротеинемий:
1) Уменьшение синтеза
белка вследствие недостатка или качественного дисбаланса аминокислот, что характерно для полного или частичного голодания, лихорадки, нарушения гидролиза белков и всасывания аминокислот;
2) Врожденные или приобретенные нарушения синтеза отдельных белков (гемофилия, гипоальбуминемия, гипогаммаглобулинемия, гипопротеинемия и т.д.);
3) Ускоренный распад отдельных белков;
4) Потеря белка во внешнюю (протеинурия при патологии почек) или внутреннюю (отек, водянка, шок и др.) среду вследствие нарушения целостности или повышения проницаемости сосудистой стенки.
Слайд 23
4. Нарушения промежуточного обмена аминокислот
Слайд 24
Этиология.
Нарушение трансаминирования может возникнуть в результате недостаточности в
организме витамина В6. Это объясняется тем, что пиридоксальфосфат является
коферментом аминотрансфераз — специфических ферментов трансаминирования между амино- и кетокислотами. Беременность, длительный прием сульфаниламидов тормозят синтез витамина В6 и могут послужить причиной нарушения обмена аминокислот.
Аминокислоты поступают в кровь и ткани из пищеварительного тракта; кроме того, они образуются при деструкции тканевых белков под действием внутриклеточных катепсинов (протеиназ). В ходе межуточного обмена аминокислоты подвергаются трансаминированию, дезаминированию, декарбоксилированию.
Слайд 25
1. Трансаминирование приводит к образованию аминокислот.
Нарушение трансаминирования.
Нарушение процесса трансаминирования в целом организме происходит при гиповитаминозе
В6, при недостатке α-кетокислот (голодание, сахарный диабет).
Нарушение трансаминирования в отдельных органах, например в печени, происходит при некрозе клеток, что сопровождается выходом трансаминаз в кровь. Такое же явление имеет место при инфаркте миокарда.
Развивается гипертрансенемия
Слайд 26
2. Дезаминирование приводит к разрушению аминокислот.
Нарушение окислительного
дезаминирования приводит к накоплению неиспользованных аминокислот, может вызвать повышение
концентрации аминокислот в крови - гипераминоацидемию.
Следствием этого является усиленная экскреция аминокислот почками (аминоацидурия) и изменение соотношения отдельных аминокислот в крови, создающие неблагоприятные условия для синтеза белковых структур.
Слайд 27
3. Нарушения декарбоксилирования.
Декарбоксилирование протекает с образованием CO2
и биогенных аминов.
Биогенные амины обладают специфической биологической активностью,
и увеличение их количества может вызвать ряд патологических явлений в организме.
Появление большого количества биогенных аминов в тканях (особенно гистамина и серотонина) может вызвать значительное нарушение местного кровообращения, повышение проницаемости сосудов и повреждение нервного аппарата
Слайд 28
5. Нарушение скорости распада белка
Слайд 29
Этиология.
Причиной нарушения скорости распада белков является повышенная
продукция катаболических гормонов. Ааболическое действие гормонов осуществляется в основном
путем активации определенных генов и усилением образования различных видов РНК (информационная, транспортная, рибосомальная), что ускоряет синтез белков; механизм катаболического действия гормонов связан с повышением активности тканевых протеиназ.
Слайд 30
Патогенез.
Ускорение распада белков сопровождается развитием в организме
отрицательного азотистого баланса в связи с преобладанием процессов распада
белков над их биосинтезом.
Азотистый баланс - разность между количеством азота, который поступает в организм, и количеством азота, выводимого из организма.
Слайд 31
Виды азотистого баланса:
1. У взрослого человека азотистый баланс
в норме близок к нулю - азотистое равновесие или
нулевой азотистый баланс.
2. Положительный азотистый баланс - состояние азотистого обмена, при котором вводимое с пищей количество азота превышает количество азота, выводимого из организма - (в норме - у растущих организмов и беременных; при патологии - после длительного голодания, при избыточной секреции инсулина, андрогенов, соматотропина, при недостатке тироксина).
3. Отрицательный азотистый баланс - состояние азотистого обмена, при котором количество азота, выводимого из организма, превышает количество азота, вводимого с пищей. Отрицательный азотистый баланс является следствием потери организмом части собственных белков.
Слайд 32
В большинстве случаев ускорение распада белков сопровождается развитием
в организме отрицательного азотистого баланса в связи с преобладанием
процессов распада белков над их биосинтезом.
Следствием отрицательного азотистого баланса являются дистрофические изменения в органах, похудание, в детском возрасте - задержка роста и умственного развития.
Слайд 33
6. Патология конечного этапа белкового обмена
Слайд 34
Конечные этапы белкового и нуклеинового обмена приводят к
формированию экскретируемых из организма азотистых соединений - аммиака, мочевины,
мочевой кислоты, креатинина, индикана.
Образование мочевины осуществляется гепатоцитами в орнитиновом цикле и имеет большое значение, так как благодаря этому процессу обезвреживается основная часть высокотоксичного аммиака, образующегося при дезаминировании аминокислот, а также поступающего в кровь из кишечника.
Экскреция мочевины из организма осуществляется с мочой (более 70%), потом (1%) и около 25% продуцируемой мочевины диффундирует в кишечник, где разлагается бактериями с образованием аммиака и снова утилизируется.
Слайд 35
Причинами понижения синтеза мочевины являются:
1. Длительное белковое
голодание (недостаток ферментов);
2. Заболевания печени (циррозы, острые гепатиты
с повреждением большого числа гепатоцитов, отравление печеночными ядами);
3. Наследственные дефекты синтеза ферментов орнитинового цикла (карбамил фосфатсинтетазы, аргининсукцинатсинтетазы и аргининсукцинатлиазы).
Слайд 36
Патогенез.
Патология конечного этапа белкового обмена может проявляться
нарушением образования конечных продуктов, либо нарушением их выведения. Проявляется
в виде гиперазотемии.
Гиперазотемия- повышение концентрации азота в крови
Слайд 37
Виды гиперазотемии:
1. Продукционная гиперазотемия. При нарушении синтеза мочевины
количество ее в крови и моче снижается, и нарастает
содержание резидуального азота (продукционная гиперазотемия).
Избыток аммиака может в некоторой степени устраняться за счет повышенного образования глутамина и присоединения к α-кетоглутаровой кислоте, которая при этом превращается в глутаминовую, и ее окисление в цикле трикарбоновых кислот резко снижается. Вследствие этого снижается образование АТФ.
Слайд 38
2. Ретенционная гиперазотемия. Другой причиной накопления азотистых метаболитов
в крови (креатинин, мочевина) является нарушение выделительной функции почек
или нарушение проходимости мочевыводящих путей. Возникающая в данном случае гиперазотемия называется ретенционной.
При этом концентрация остаточного азота в крови возрастает до 140-215 ммоль/л, а содержание небелковых азотистых продуктов в моче снижается. Ретенционная гиперазотемия является одним из факторов, играющих роль в развитии уремической комы.
Слайд 39
3. Смешанная (комбинированная) форма гиперазотемии, при которой повышенный
распад белка в тканях сочетается с недостаточным выведением азотистых
продуктов с мочой. Такое сочетание возможно при острой почечной недостаточности, развившейся на почве септического аборта, или обширном сдавлении тканей (синдром раздавливания).
К комбинированной форме гиперазотемии относится гипохлоремическая гиперазотемия, возникающая при неукротимой рвоте, стенозе привратника и профузных поносах.
Слайд 41
1. ОБЩИЙ БЕЛОК.
Нормальная концентрация общего белка в
крови: 65-85 г/л
Плазма крови человека в норме содержит более 100
видов белков. Примерно 90% общего белка составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах. Синтезируются в печени.
Слайд 42
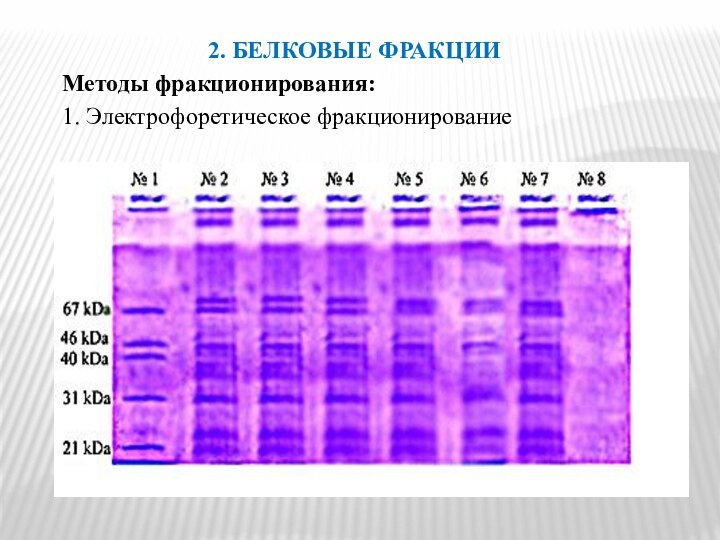
2. БЕЛКОВЫЕ ФРАКЦИИ
Методы фракционирования:
1. Электрофоретическое фракционирование
Слайд 43
ПРЕАЛЬБУМИН.
Нормальная концентрация преальбумина в крови: 0,18-0,38 г/л
Перед фракцией
альбуминов при использовании метода радиальной иммунодиффузии обнаруживается белок, получивший
название преальбумин. Содержит триптофан, синтезируется в печени и выполняет в основном транспортную функцию. В крови он ответственен за перенос ретинола, тироксина и трийодтиронина в ткани.
Слайд 44
2. АЛЬБУМИНЫ.
Нормальная концентрация альбуминов в крови: 30-50 г/л
Следующая
по подвижности фракция — альбуминовая, эта фракция синтезируется почти
исключительно в печени.
Значение альбумина в крови заключается:
1. Поддержание коллоидно-осмотического давления
2. Это богатый и быстро реализуемый резерв белка,
3. Транспортная функция – связывание и перенос длинноцепочечных жирных кислот – основная физиологическая функция сывороточного альбумина.Кроме того, альбумин переносит пигменты (билирубин), катионы (например, Ca2+ и Mg2+), анионы (Cl–), желчные кислоты, витамины, гормоны (альдостерон, прогестерон, гидрокортизон), органические красители, лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Слайд 45
3. ГЛОБУЛИНЫ.
Нормальная концентрация глобулинов в крови:
Глобулин –
это общий термин, который применяют для описания набора из
шестидесяти белков, включая антитела (или гамма-глобулины) и белок-углеводные соединения, известные как гликопротеины.
Существует четыре основные группы белков глобулинов, известных как альфа-1, альфа-2, бета- и гамма-протеины. На практике диагностически значимо только повышение уровня белковых фракций.
Слайд 46
3.БЕЛКИ ОСТРОЙ ФАЗЫ ВОСПАЛЕНЕИЯ
1. С‑РЕАКТИВНЫЙ БЕЛОК (СРБ).
Нормальная
концентрация СРБ в крови: 68‑8200 мкг/л
Это белок острой фазы,
повышение концентрации которых указывает на воспалительный процесс в организме. Данный белок нашел применение в клинической диагностике как индикатор воспаления (более чувствителен чем СОЭ). СРБ синтезируется печенью
Слайд 47
2. ТРОПОНИН.
Нормальная концентрация тропонина в крови: 0–0,028
нг/мл.
Это особый белок, содержащийся только внутри клеток сердечной мышцы
(кардиомиоцитах), он практически не определяется в крови при нормальных условиях. Однако если кардиомиоциты начинают гибнуть и разрушаться, а чаще всего это случается из-за развившегося инфаркта миокарда, то тропонин начинает проникать в общий кровоток, ввиду чего его концентрация в крови возрастает в сотни, а иногда и тысячи раз.
Эта особенность и стала ключевым фактором, позволяющим диагностировать инфаркт миокарда.
Слайд 48
Особенности тропонина
При инфаркте концентрация некоторых веществ в крови
значительно повышается, например, таких как ЛДГ, АСТ, АЛТ, ГОТ,
миоглобин и прочие. Повышение этих веществ наблюдается не только при инфаркте, но и при других состояниях, не имеющих никакого отношения к сердцу, в отличие от тропонина.
Тропонину свойственно повышаться только в случае разрушения клеток сердечной мышцы, поэтому на сегодня он лучший лабораторный показатель для диагностики инфаркта миокарда.
Через 3-4 часа от начала инфаркта уровень тропонина начинает превышать допустимые границы нормы. Тропонин будет сохраняться в кровотоке в повышенной концентрации как минимум 5-7 дней после инфаркта. Это позволяет диагностировать перенесенный инфаркт.
Слайд 49
3. ГАПТОГЛОБИН.
Нормальная концентрация гаптоглобина в крови: 0,8-2,7
г/л
Гаптоглобин – типичный представитель гликопротеинов – белков острой фазы,
синтезируется в печени, и в низких концентрациях присутствует во многих жидкостях организма – ликворе, лимфе, синовиальной жидкости, желчи.
Гаптоглобин создает комплексы с белковыми и небелковыми веществами, появляющимися при распаде клеток, в связи, с чем его количество увеличивается при воспалительных процессах.
Слайд 50
4. ЦЕРУЛОПЛАЗМИН.
Нормальная концентрация церулоплазмина в крови: 0,15-0,60
г/л
Это белок острой фазы, ликвидирует супероксидные радикалы кислорода, которые
образуются при некротическом процессе во время воспалительного процесса. Увеличиваются при воспалении.
Слайд 51
5. МИКРОАЛЬБУМИН
Моча на микроальбуминурию – показатель раннего
поражения почек, который диагностирует начальные стадии патологии сосудов (эндотелиальной
дисфункции, атеросклероза), и неизменно коррелирует с увеличением сердечно-сосудистой заболеваемости и смертности.
Микроальбуминурия – это выделение почками (путем клубочковой фильтрации) альбумина в количествах, определить которые с помощью рутинных лабораторных методов (клинический анализ мочи, например, путем осаждения сульфосалициловой кислотой) не удается - от 30 до 300 мг/сутки или от 20 до 200 мкг/минуту. При отсутствии инфекции мочевыводящих путей и острого заболевания повышенная экскреция альбуминов с мочой, как правило, отражает патологию клубочкового аппарата почек.
Слайд 52
4. БЕЛКИ, РЕГУЛИРУЮЩИЕ ОБРАЗОВАНИЕ ГЕМОГЛОБИНА
1.ФЕРРИТИН. Нормальная конц. ферритина
в крови: 12-300 нг/мл
Ферритин - основной белок хранения железа
в организме, поэтому определение содержания ферритина в сыворотке – косвенный способ измерения количества железа что хранится в организме.
2.ТРАНСФЕРРИН. Нормальная конц. трансферрина в крови: 2,20-4,0 г/л
Трансферрин синтезируется в печени и РЭС. Функции белка заключаются в связывании железа, превращении его в деионизированную форму и транспорте между тканями, в основном, между печенью и костным мозгом.
3.ГЕМОПЕКСИН. Нормальная конц. гемопоэесина в крови: 0,50‑1,15 г/л
Гемопоэксин - β-Гликопротеид, выполняющий функцию транспортного белка при переносе гемаизциркулирующей крови в паренхиму печени; Синтезируется в гепатоцитах, связывает порфирин, гемсодержащие хромопротеиды (гемоглобин, миоглобин, каталазу), доставляя их в печень, где происходит распад гема и связывание железа с ферритином.