- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Нарушения углеводного обмена
Содержание
- 6. ЭТАПЫ УГЛЕВОДНОГО ОБМЕНА
- 7. Нарушение углеводного обменаНарушение всасывания углеводовНарушение синтеза гликогенаНарушение межуточного обмена углеводов
- 8. 1. Нарушение всасывания углеводов Патогенез нарушения всасывания углеводовПри
- 9. Патология:1. Осмотическая диарея - это выделения стула
- 10. 2. Ацидоз – состояние организма, характеризующееся нарушением
- 11. 3. Гипогликемия — снижение содержания глюкозы в
- 12. 2. Нарушение синтеза гликогена в организме Гликоген является
- 13. Гликогенозы Гликогенозы наследуются по аутосомно-рецессивному типу и проявляются вскоре после рождения.
- 14. Гликогеноз I типа (болезнь фон Гирке)- врожденный
- 15. Гликогеноз II типа (болезнь Помпе) наблюдается при
- 16. Гликогеноз III типа (болезнь Форбса-Кори) возникает при
- 17. Гликогеноз IV типа (болезнь Андерсена) возникает при
- 18. 3. Нарушение межуточного обмена углеводов. Гипергликемии Гипергликемия -
- 19. 1. Алиментарная гипергликемия. Развивается при приеме больших количеств
- 20. 2. Эмоциональная гипергликемияПатогенез:Стрессор через соответствующие анализаторные структуры
- 21. 3. Гормональная гипергликемия. Патогенез:Гормональная гиперглкемия наблюдается при
- 22. Механизм гипогликемического действия инсулина (влияние на углеводный
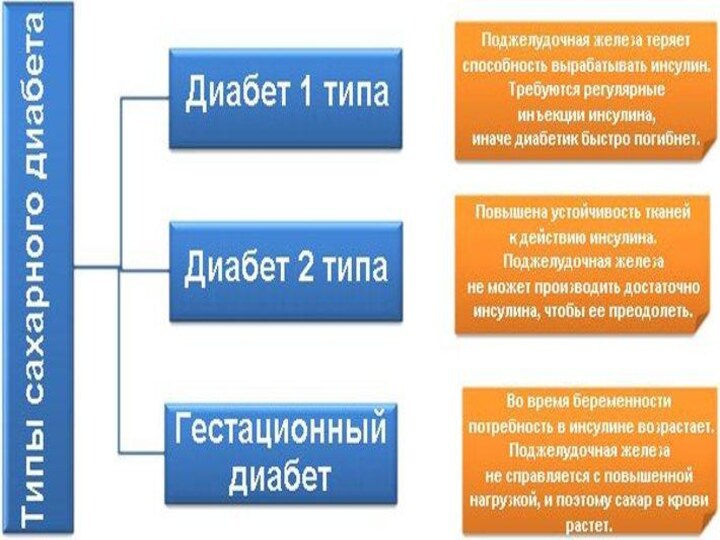
- 25. 1. Этиология и патогенез сахарного диабета 1
- 26. 3. Повреждающим эффектом обладают клетки иммунной системы:
- 27. Патогенез сахарного диабета I типа:1. Патогенез сахарного
- 28. 4. В условиях энергетической недостаточности и дефицита
- 29. 2. Этиология и патогенез сахарного диабета 2
- 30. Патогенез сахарного диабета II типа:1. Инсулинорезистентность. Инсулинорезистентность
- 31. 4. В печени СЖК препятствуют связыванию инсулина
- 32. 3. Гестационный сахарный диабет Са́харный диабе́т бере́менных (гестацио́нный
- 33. Патогенез. Во время беременности, по мере созревания
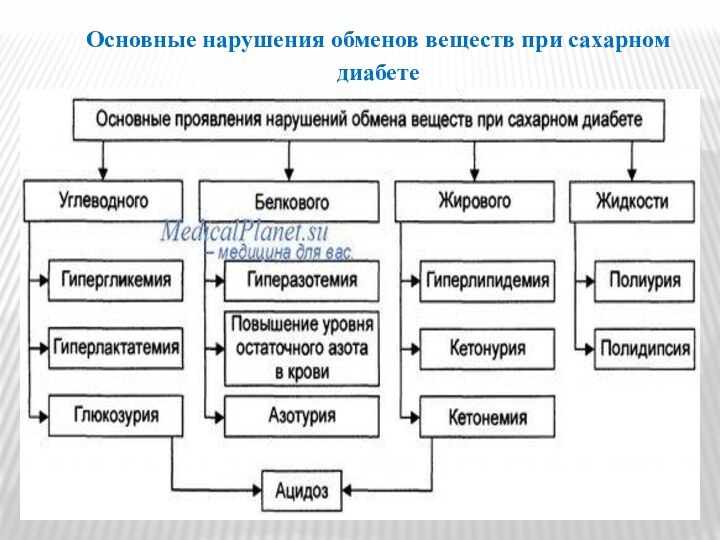
- 34. Основные нарушения обменов веществ при сахарном диабете
- 35. Нарушение углеводного обмена. В гепатоцитах, миоцитах и
- 36. Нарушение белкового обменаИз-за недостаточности инсулина снижается синтез
- 37. Нарушение жирового обменаВ жировой ткани уменьшается синтез
- 38. Нарушение водно-солевого балансаПромежуточные и конечные продукты обмена
- 39. Полиурия может быть вызвана диабетом разных типов,
- 40. Полидипсия— это симптом, который проявляется в виде
- 41. Показатели углеводного обмена
- 42. 1. ГЛЮКОЗА Нормальная концентрация глюкозы в крови:
- 43. 2. НАГРУЗОЧНЫЕ ПРОБЫ С ГЛЮКОЗОЙПри скрытых формах
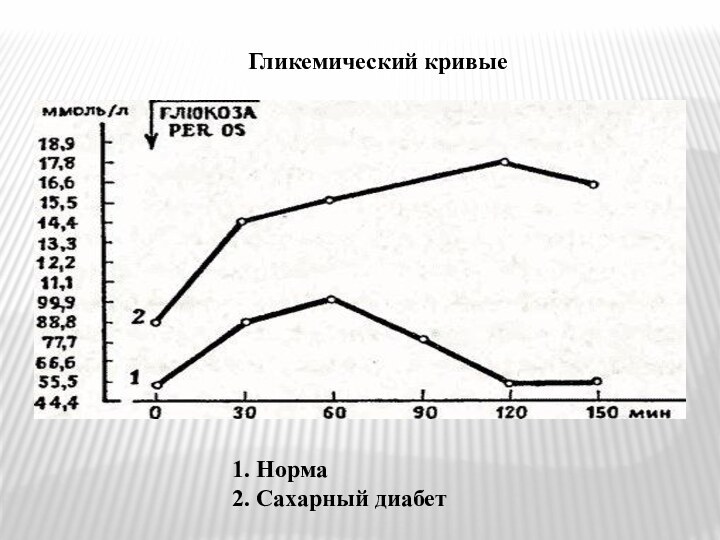
- 44. Гликемический кривые1. Норма2. Сахарный диабет
- 45. 3. ФРУКТОЗА. Нормальная концентрация фруктозы в крови: 0,055‑0,333 ммоль/л
- 46. 4. ГЛИКОЗИЛИРОВАННЫЙ ГЕМОГЛОБИН (HbA1C). Нормальная концентрация HbA1C
- 47. Этот процесс значительно ускоряется при повышенной концентрации
- 48. 5. МОЛОЧНАЯ КИСЛОТА (ЛАКТАТ)Нормальная концентрации лактата в
- 49. Скачать презентацию
- 50. Похожие презентации
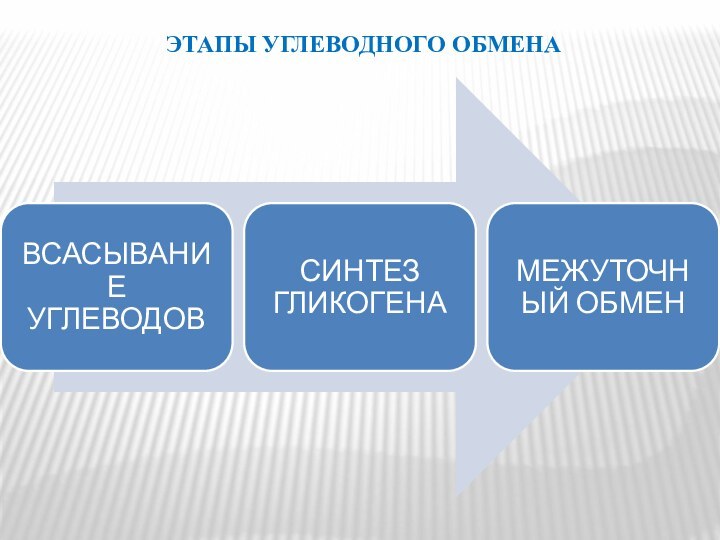
ЭТАПЫ УГЛЕВОДНОГО ОБМЕНА








































Слайд 7
Нарушение углеводного обмена
Нарушение всасывания углеводов
Нарушение синтеза гликогена
Нарушение межуточного
обмена углеводов
Слайд 8
1. Нарушение всасывания углеводов
Патогенез нарушения всасывания углеводов
При врожденном
или приобретенном недостатке одного или нескольких ферментов гидролиза дисахаридов
развивается дисахаридазная недостаточность.Причины: Дисахариды блокируют места всасывания моносахаридов, поэтому всасывание моносахаридов нарушается.
Слайд 9
Патология:
1. Осмотическая диарея - это выделения стула в
количестве более 10 г/кг/сут. Клинические проявления: частый и жидкий
стулПатогенез: Непереваренная лактоза поступает в толстую кишку, где расщепляется бактериями до молочной кислоты (лактат) и уксусной кислоты. Повышение лактозы и органических кислот нарушает осмолярность в просвете кишки, нарастает секреция жидкости, объем химуса, увеличивается моторика кишечника, развивается осмотическая диарея.
Слайд 10 2. Ацидоз – состояние организма, характеризующееся нарушением кислотно-щелочного
баланса организма со смещением в сторону увеличения кислотности и
уменьшению рН его среды.Патогенез: Ионы водорода, образующиеся при расщеплении органических кислот, поступают в кровоток. Основной причиной развития состояния является аккумуляция продуктов окисления органических кислот, которые в норме быстро выводятся из организма.
Слайд 11
3. Гипогликемия — снижение содержания глюкозы в крови
менее 3,33 ммоль/л.
Патогенез: При уменьшении всасывания углеводов возникает недостаток
глюкозы.4. Уменьшение массы тела.
Патогенез: На синтез глюкозы путем глюконеогенеза расходуются жиры и белки, в результате чего уменьшается масса тела
Слайд 12
2. Нарушение синтеза гликогена в организме
Гликоген является депонированной
формой глюкозы. Усиление синтеза гликогена ведет к его избыточному
накоплению в органах и тканях и их повреждению. Это происходит при гликогенозах (гликогенной болезни), в основе которых лежит врожденный дефицит ферментов, катализирующих распад или синтез гликогена.
Слайд 13
Гликогенозы
Гликогенозы наследуются по аутосомно-рецессивному типу и проявляются вскоре
после рождения.
Слайд 14 Гликогеноз I типа (болезнь фон Гирке)- врожденный дефицит
в печени и почках фермента глюкозо-6-фосфатазы.
Патогенез:
При недостаточности
глюкозо-6-фосфатазы в клетках печени и почек (особенно в ядре клеток) накапливается гликоген. Печень и почки увеличиваются в размере.
Развивается гипогликемия.
В крови возрастает содержание молочной кислоты,
Развивается метаболический ацидоз.
Больные дети отстают в физическом развитии и, как правило, рано умирают от интерферентных заболеваний или от ацидотической комы.
Слайд 15 Гликогеноз II типа (болезнь Помпе) наблюдается при дефиците
кислой а-1,4-глюкозидазы. Этот фермент содержится в лизосомах.
Патоегез:
В
лизосомах клеток различных тканей и органов накапливается гликоген, который оттесняет цитоплазму, заполняет всю клетку и разрушает ее. Симптомы гликогеноза появляются через несколько суток или недель после рождения. Отложение гликогена в языке ведет к его увеличению, в диафрагме — к нарушению дыхания и т.д.
Ведущим симптомом является увеличение сердца (кардиомегалия) вследствие отложения в нем гликогена.
Эта форма гликогеноза наиболее злокачественная и больные дети рано умирают от сердечной недостаточности, но может быть диагностирована путем амниоцентеза в пренатальном периоде.
Слайд 16 Гликогеноз III типа (болезнь Форбса-Кори) возникает при недостаточности
фермента амило-1,6-глюкозидазы,
Патогенез:
Развивается гипогликемия,
Развивается мышечная слабость,
Развивается кетоз
Слайд 17
Гликогеноз IV типа (болезнь Андерсена) возникает при дефиците
фермента D-1,4- трансферазы,
Патогенез:
В печени, селезенке и других тканях
накапливается измененный гликоген — с малым числом точек ветвления. Функция органов, в особенности печени, нарушается.
Признаки гликогеноза проявляются вскоре после рождения.
Развиваются цирроз печени и желтуха, выражена гипогликемия.
Больные дети обычно погибают на первом году жизни, так как в отличии от выше описанных гликогенозов практически не поддается лечению.
Слайд 18
3. Нарушение межуточного обмена углеводов. Гипергликемии
Гипергликемия - повышение
уровня сахара крови выше нормального. В зависимости от этиологических
факторов различают следующие виды гипергликемий:
Слайд 19
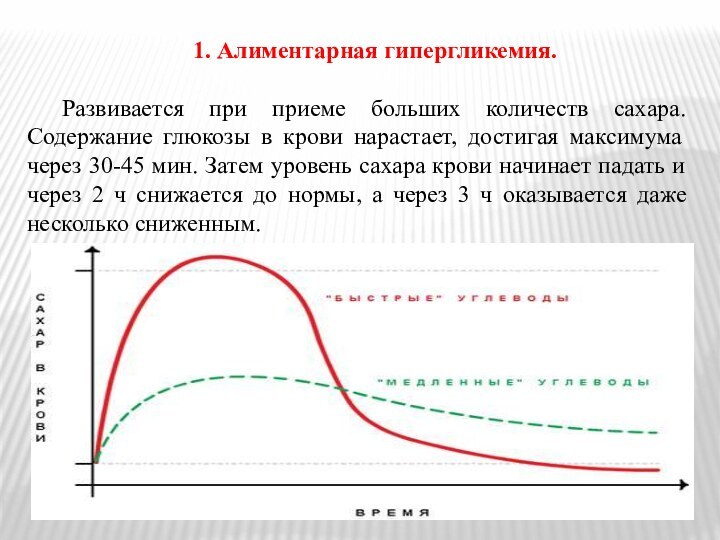
1. Алиментарная гипергликемия.
Развивается при приеме больших количеств сахара.
Содержание глюкозы в крови нарастает, достигая максимума через 30-45
мин. Затем уровень сахара крови начинает падать и через 2 ч снижается до нормы, а через 3 ч оказывается даже несколько сниженным.
Слайд 20
2. Эмоциональная гипергликемия
Патогенез:
Стрессор через соответствующие анализаторные структуры воздействует
на кору головного мозга. Далее через таламус сигнал поступает
к гипоталамусу. Гипоталамус релизинг – гормонами активирует эндокринную систему гипофиза и надпочечниковГипофиз производит АКТГ (адренокортикотропный гормон). Адренокортикотропный гормон действуя на кору надпочечников, активирует выработку глюкокортикоидных гормонов, одним из представителей которых является кортизол – «гормон стресса» и минералокортикоидов, основным из которых является альдостерон.
Альдостерон поднимает артериальное давление, обеспечивая быстрейшее поступление кислорода и питательных веществ к активным структурам организма. Глюкокортикоиды повышают уровень глюкозы в крови
Резко усиливает клеточный метаболизм, подготавливая организм к борьбе со стрессором.
Слайд 21
3. Гормональная гипергликемия.
Патогенез:
Гормональная гиперглкемия наблюдается при недостаточности
гормона инсулина. Инсулин образуется и запасается b-клетками островков Лангерганса
поджелудочной железы. Разрушается он ферментом, «инсулиназа».Угнетение секреции. Главным ингибитором секреции инсулина является сам инсулин, циркулирующий в крови, а также гипергликемические гормоны: глюкагон, адреналин, АКТГ, кортизол, СТГ, ТТГ.
Стимуляция секреции. Стимулятор образования инсулина — глюкоза крови. Эффект глюкозы прямой, она проникает в клетки.
Слайд 22
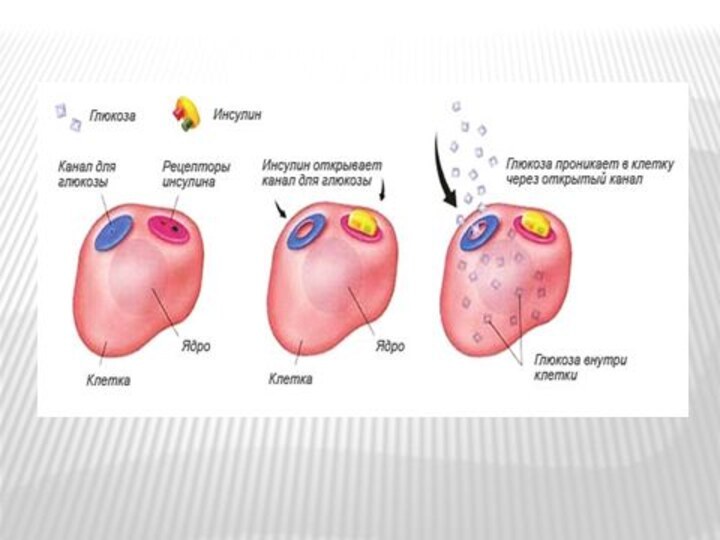
Механизм гипогликемического действия инсулина
(влияние на углеводный обмен).
1.
Инсулин облегчает перенос глюкозы через клеточную мембрану в инсулин-зависимых
органах (мышцах, жировой ткани, лейкоцитах, корковом слое почек), так как мембраны многих клеток служат барьером для свободного передвижения глюкозы из внеклеточной жидкости в клетку.2. Инсулин взаимодействует с рецептором мембраны, приводя к изменению ее проницаемости.
3. Инсулин снимает тормозящее влияние гипергликемических гормонов на внутриклеточную гексокиназу, фосфорилирующую глюкозу
4. Инсулин изменяет активность внутриклеточных ферментов, стимулируя анаболические реакции.
5. Инсулин стимулирует синтез гликогена (активирует глюкокиназу),
6. Инсулин увеличивает поступление глюкозы в мышцы и жировую ткань, где стимулирует ее превращение в гликоген и жир.
Слайд 25
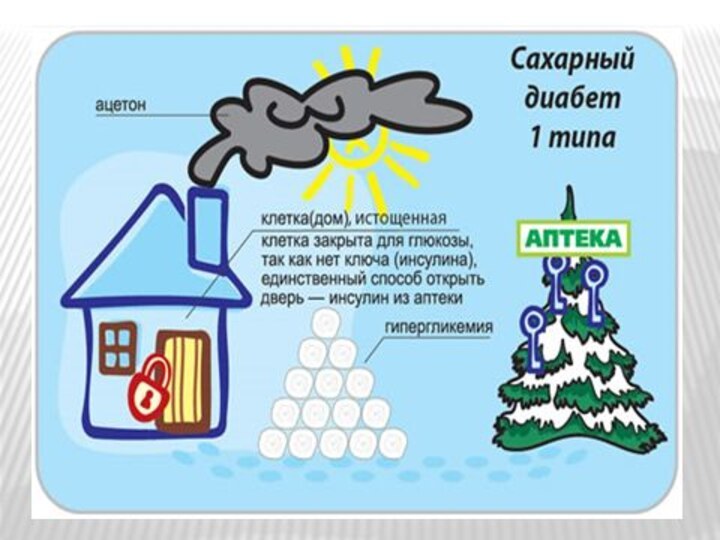
1. Этиология и патогенез сахарного диабета 1 типа.
Этиология
сахарного диабета 1 типа:
1. У больных выявляются «диабето-генные» гены
системы главного комплекса гистосовместимости (HLA), расположенного на 6-й хромосоме: В8, В15, Dw3, DRw3, Dw4, DRw4.2. Повреждающим эффектом являются вирусы эпидемического паротита, кори, врожденной краснухи, аденовирусы, вирусы Коксаки, вирусы осповакцинации. Эти вирусы инициируют повреждение β –клеток поджелудочной железы у лиц с генетической предрасположенностью к такому повреждению. Развивается инсулит, который является морфологическим отражением аутоиммунных процессов.
Слайд 26 3. Повреждающим эффектом обладают клетки иммунной системы: моноциты
и макрофаги, цитотоксические Т-лимфоциты, К- и NK-клетки, цитотоксические антитела,
относящиеся к lgG-классу, а также цитокины — интерлейкин-1, фактор некроза опухолей α, γ-интерферон.4. В результате длительного деструктивного процесса к моменту полной клинической картины 85—90 % β -клеток уже разрушены, что приводит к абсолютной недостаточности выработки инсулина.
Слайд 27
Патогенез сахарного диабета I типа:
1. Патогенез сахарного диабета
1 типа основывается на абсолютном дефиците инсулина.
2. Блокирование
процесса поступления глюкозы в мышечную и жировую ткани (так называемые "инсулинзависимые ткани") способствует развитию энергетической недостаточности, из-за чего увеличивается протеолиз и липолиз, приводящие к потере массы тела.3. Повышение уровня сахара в крови вызывает гиперосмолярность, сопровождающийся выраженным обезвоживанием и осмотическим диурезом.
Слайд 28 4. В условиях энергетической недостаточности и дефицита инсулина
стимулируется продукция гормонов (кортизол, глюкагон, соматотропин), которые стимулируют процесс
глюконеогенеза. Активация липолиза приводит к повышению концентрации свободных жирных кислот.5. При недостатке инсулина подавляется липосинтетическая способность печени, а свободные жирные кислоты включаются в кетогенез.
6. Постепенно накопление кетоновых тел приводит к возникновению диабетического кетоза, а в последующем - и кетоацидоза.
7. При прогрессирующем нарастании ацидоза и явлений обезвоживания возникает коматозное состояние, которое заканчивается смертью при отсутствии адекватной регидратации и инсулинотерапии.
Слайд 29
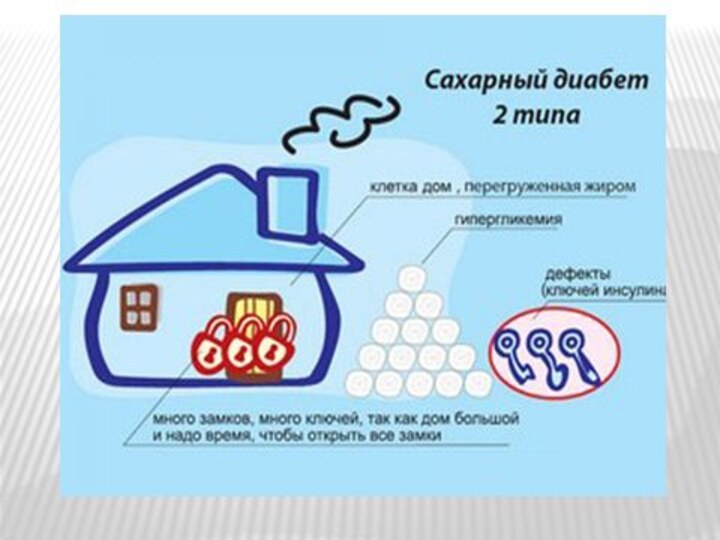
2. Этиология и патогенез сахарного диабета 2 типа.
Этиология
сахарного диабета II типа:
1. У больных выявляются «диабетогенных» генов
в 11 хромосоме. 2. Провоцирующие факторы: переедание и связанное с ним ожирение Избыточное потребление пищи приводит к гиперсекреции инсулина, что способствует липогенезу и ожирению и со временем может вызвать декомпенсацию β-клеток.
3. Диабет 2 типа обусловлен недостаточным сахаропонижающим эффектом биологически активного инсулина из-за генетического дефекта в инсулинзависимых тканях.
Слайд 30
Патогенез сахарного диабета II типа:
1. Инсулинорезистентность. Инсулинорезистентность –
это состояние, характеризующееся недостаточным биологическим ответом клеток на инсулин
при его достаточной концентрации в крови, которая возникает в результате снижения концентрации специфических транспортеров глюкозы.2. Ожирение, особенно висцеральное. Это обусловлено особенностями висцеральных адипоцитов. Адипоциты характеризуются сниженной чувствительностью к антилиполитическому действию инсулина и повышенной чувствительностью к липолитическому действию катехоламинов.
3. В висцеральной жировой ткани активизируется процесс липолиза, что приводит к поступлению большого количества свободных жирных кислот в кровоток.
Слайд 31 4. В печени СЖК препятствуют связыванию инсулина с
гепатоцитами, что способствует гиперинсулинемии, а также подавляют печеночный глюконеогенез
и гликогенолиз, в результате чего повышается продукция глюкозы печенью.5. Высокая концентрация СЖК в периферическом кровотоке препятствует утилизации глюкозы миоцитами, что приводит к гипергликемии и компенсаторной гиперинсулинемии.
6. Глюкозотоксичность. Гипергликемия неблагоприятно влияет на уровень секреторной активности β-клеток. Длительно, на протяжении многих лет и десятилетий существующая гипергликемия приводит к истощению продукции инсулина β-клетками и у пациента появляются симптомы дефицита инсулина — похудение, кетоз при сопутствующих инфекционных заболеваниях.
Слайд 32
3. Гестационный сахарный диабет
Са́харный диабе́т бере́менных (гестацио́нный са́харный
диабе́т) — состояние, характеризующееся гипергликемией, возникающей на фоне беременности
у некоторых женщин и обычно спонтанно исчезающее после родов.Этиология.
К причинам развития ГД относят:
плацентарный синтез стероидных гормонов;
повышенный уровень кортизола;
изменение метаболизма и тканевого эффекта инсулина;
разрушение инсулина почками;
активация инсулиназы плаценты.
Слайд 33
Патогенез.
Во время беременности, по мере созревания плаценты,
постепенно нарастает инсулинорезистентность.
Основную роль в этом процессе играют
фетоплацентарные гормоны (плацентарный лактоген и прогрестерон) и гормоны матери (кортизол, эстрогены, пролактин), концентрация которых в крови также возрастает с увеличением сроков беременности. Инсулинорезистентность усугубляется увеличением калорийности принимаемой матерью пищи, снижением физической активности, и прибавкой веса.
Слайд 35
Нарушение углеводного обмена.
В гепатоцитах, миоцитах и липоцитах
снижается активность глюкокиназы — уменьшается синтез и увеличивается распад
гликогена;Усиливается глюконеогенез,
Повышается активность глюкозо-6-фосфатазы, увеличивается поступление глюкозы в кровь.
В мышцах уменьшается, образование и усиливается распад гликогена,
Увеличивается поступление молочной кислоты в кровь; уменьшается синтез и усиливается распад белка, увеличивается выход аминокислот в кровь.
Из за нарушения транспортных белков нарушается диффузия глюкозы в жировую и мышечную ткани после еды
Тормозятся пентозофосфатный путь окисления глюкозы и образование НАДФ+. Нарушается работа цикла Кребса, окислительное фосфолирирование и возникает дефицит АТФ.
Развиваются гипергликемия, аминоацидемия и лактацидемия (молочнокислый ацидоз).
Слайд 36
Нарушение белкового обмена
Из-за недостаточности инсулина снижается синтез белка
(нарушается сборка рибосом, снижается транспорт аминокислот в клетки (особенно,
валина, лейцина, изолицина), уменьшается синтез ДНК, РНК и миодическая активность ряда клеток.Преобладают процессы распада белка, особенно в мышцах, что сопровождается увеличением аминокислот,ионовК+ и мочевины в крови и моче и отрицательным азотистым балансом.
Клинически проявляется падением массы тела (I тип), понижением пластического, в том числе регенераторного, потенциала организма, развиваются вторичные иммунодефициты и феномен «ленивых фагоцитов».
Слайд 37
Нарушение жирового обмена
В жировой ткани уменьшается синтез триглицеридов
и усиливается липолиз, при этом в крови повышается концентрация
свободных жирных кислот (СЖК), снижается масса тела (I тип ).В печени увеличивается содержание СЖК, меньшая часть которых используется на синтез триглицеридов и вызывает жировую инфильтрацию печени.
Большая часть СЖК в отсутствие инсулина окисляется в печени. Образуются кетоновые тела — ацетоуксусная и β -оксимасляная кислоты и ацетон.
Гиперлипидемия приводит к угнетению использования мышцами глюкозы, а, следовательно, способствует накоплению глюкозы в крови.
Избыток ацетоуксуеной кислоты идет на синтез холестерина, развивается гиперхолестеринемия.
В этих условиях в печени усиливается синтез ЛПОНП и ЛПНП.
Слайд 38
Нарушение водно-солевого баланса
Промежуточные и конечные продукты обмена жиров,
углеводов и белков, накапливаясь в крови, приводят к обезвоживанию.
Полидипсия и жажда обусловлены пересыханием слизистых оболочек горла и рта.Слайд 39 Полиурия может быть вызвана диабетом разных типов, количество
мочи в ряде случаев может достигать до 10 литров.
Иногда происходит увеличение плотности мочи, что свидетельствует о содержании в ней глюкозы.У больных, испытывающих непреходящую сильную жажду, очень часто диагностируют несахарное мочеизнурение (несахарный диабет).
При этой форме диабета полиурия отличается низкой плотностью урины.
Слайд 40 Полидипсия— это симптом, который проявляется в виде неестественной
жажды, утоляемой только потреблением воды в количестве, сильно превышающим
естественное (два литра в сутки для взрослого).По выраженности данного синдрома можно определить тяжесть состояния больного, а также стадию первичной болезни. Например, появление или усиление полидипсии при инсулинозависимом сахарном диабете указывает на дальнейшее повышение уровня сахара в крови.
Основные причины полидипсии:
Обезвоживание (может быть вызвано обильной рвотой, длительным поносом, а также чрезмерным потовыделением).
Чрезмерно повышенное выделение мочи (чаще всего происходит при инсулинонезависимом сахарном диабете).
Повышенное количество глюкозы в крови (при сахарном диабете 1 типа) или хлорида натрия (при повышенной функции коры надпочечников).
Слайд 42
1. ГЛЮКОЗА
Нормальная концентрация глюкозы в крови: 3,9
5,5 ммоль/л
Наиболее распространенный углевод в животном организме — глюкоза.
Она играет роль связующего звена между энергетическими и пластическими функциями углеводов, поскольку из глюкозы могут образовываться все другие моносахариды, и наоборот — различные моносахариды могут превращаться в глюкозу. В промежуточном обмене глюкоза используется для образования гликогена, глицерина и жирных кислот, аминокислот, глюкуроновой кислоты и гликопротеинов.
Слайд 43
2. НАГРУЗОЧНЫЕ ПРОБЫ С ГЛЮКОЗОЙ
При скрытых формах сахарного
диабета концентрация глюкозы в крови не является определяющей в
постановке диагноза. В этом случае лучше пользоваться нагрузочными пробами.ТЕСТ ТОЛЕРАНТНОСТИ К ГЛЮКОЗЕ (ГТТ)
Нормальная концентрация ГТТ в крови
Слайд 46
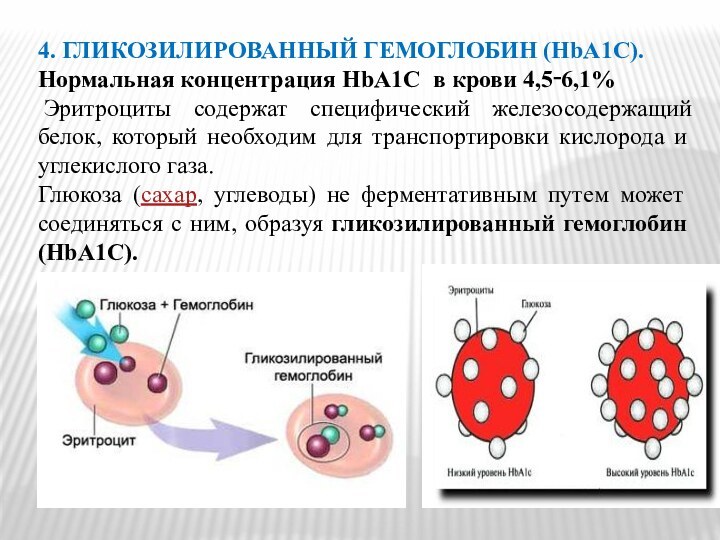
4. ГЛИКОЗИЛИРОВАННЫЙ ГЕМОГЛОБИН (HbA1C).
Нормальная концентрация HbA1C в
крови 4,5‑6,1%
Эритроциты содержат специфический железосодержащий белок, который необходим для
транспортировки кислорода и углекислого газа. Глюкоза (сахар, углеводы) не ферментативным путем может соединяться с ним, образуя гликозилированный гемоглобин (HbA1C).
Слайд 47 Этот процесс значительно ускоряется при повышенной концентрации сахара
(гипергликемия).
Средняя продолжительность существования эритроцитов в среднем около 95
– 120 дней, поэтому уровень HbA1C отображает интегральную концентрацию глюкозы на протяжении последних 3 месяцев. \Норма гликозилированного гемоглобина в крови 4 – 6% от общего его уровня и соответствует нормальному содержанию сахара в 3–5 ммоль/л.