- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Наследственные нейромышечные заболевания
Содержание
- 2. Понимание ведущей роли генетических факторов в этиологии
- 3. Конец XX века и начало нового тысячелетия
- 4. В
- 5. Идентификация мутантных генов и первичных биохимических нарушений,
- 6. На этой основе были сформированы новые
- 7. В основе болезней экспансии, лежат динамические
- 8. Патогенетический механизм нейродегенеративных болезней, обусловленных экспансией
- 9. Подобные болезни получили название конформационных. К
- 10. При наследственных заболеваниях с пароксизмами, гипер- или
- 11. К каналопатиям относятся миотонии, периодические параличи, наследственные формы абсанс эпилепсии и мигрени
- 12. Нервно-мышечные заболевания характеризуются нарушением движений и прогрессирующей
- 13. Наследственные болезни мышц, мышечные дистрофии и миопатии
- 14. Клиническая классификация прогрессирующих мышечных дистрофий (ПМД) основана
- 15. Морфологически в мышечных волокнах при миопатиях выявляются
- 16. Биохимически в сыворотке крови увеличено содержание саркоплазматических
- 17. Наиболее распространенной и злокачественной формой нервно-мышечной патологии детского возраста является прогрессирующая Х-сцепленная псевдогипертрофическая миодистрофия Дюшенна/Беккера
- 18. Первые признаки миодистрофии Дюшенна появляются в
- 19. Патологический процесс носит восходящий характер. Первыми поражаются
- 21. Характерно лицо «сфинкса», «миопата» - гипертелоризм, недостаточность
- 22. Больные миодистрофией Дюшенна сохраняют способность к ходьбе
- 23. Миодистрофия Беккера – это более мягкий вариант
- 24. В некоторых случаях дюшенно-подобные миодистрофии наследуются по
- 25. Конечностно-поясные миодистрофии – это гетерогенная группа
- 26. Больные начинают испытывать затруднения при беге и
- 27. Генетическое разнообразие наследственных конечностно-поясных миодистрофий очень велико.
- 28. При некоторых формах конечностно-поясная миодистрофия сочетается с
- 29. В самостоятельную клиническую группу традиционно выделяют врожденные
- 30. Патологические процессы при некоторых врожденных непрогрессирующих миопатиях обусловлены отложением в миофибриллах гистологически идентифицируемых аномальных образований
- 31. При немалиновой миопатии в мышечных клетках пациентов
- 32. Определенные гистологические аномалии выявляются также у больных миотубулярной миопатией и болезнью центрального стержня
- 33. Нерастворимые включения в мышечных клетках характерны и
- 34. В особую группу выделяют медленно прогрессирующие митохондриальные
- 35. Наследственные дефекты различных мышечных ферментов являются причиной
- 36. В настоящее время расшифрована молекулярно- генетическая природа
- 37. Оказалось, что белковые продукты многих генов, связанных
- 38. Основными функциями подобных белков являются: стабилизация сарколеммы
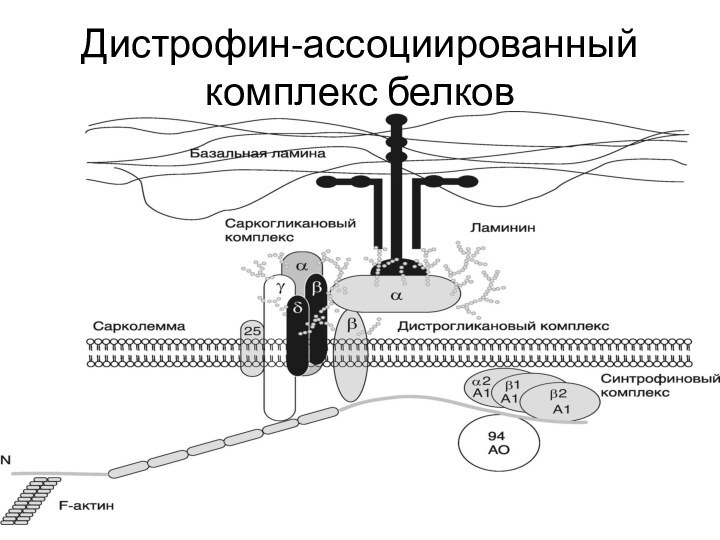
- 39. К подобным белкам относится дистрофин –
- 40. Дистрофин-ассоциированный комплекс белков
- 41. N-концевой домен дистрофина связан с цитоскелетом мышечного
- 42. В области цистеин-богатого домена формируются кальциевые каналы
- 43. Эти белки, в свою очередь, разделяют на
- 44. При миодистрофии Дюшенна/Беккера, также как при аутосомно-рецессивных
- 45. При миодистрофии Дюшенна/Беккера разрушение дистрофин-ассоциированного комплекса
- 46. Разрушение дистрофинового комплекса за счет специфических мутаций
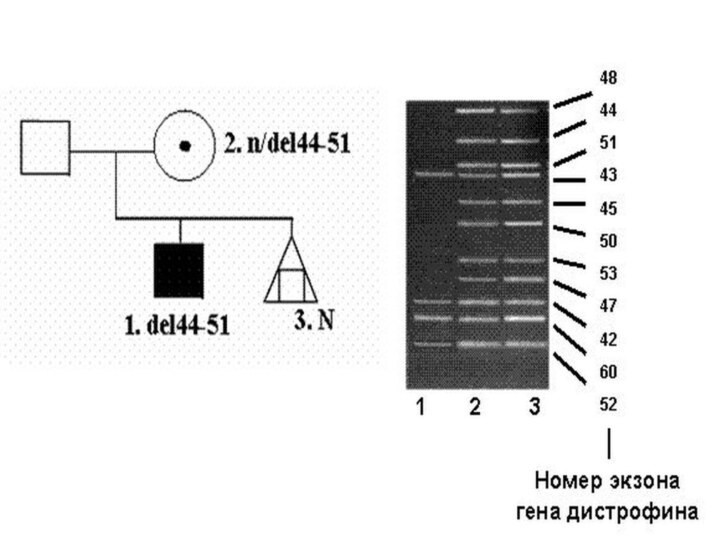
- 47. В 65-70% случаев у больных миодистрофией Дюшенна/Беккера
- 48. Различия заключаются в том, что при миодистрофии
- 49. В гене DMD идентифицированы также относительно небольшие
- 50. Молекулярная диагностика делеций в гене DMD проводится
- 52. Разрушение дистрофин-ассоциированного комплекса белков при
- 53. Дистрофин-ассоциированный комплекс белков
- 54. Мутации в генах дистрогликанов не обнаружены.
- 55. Дистрогликанопатии (5 нозологических форм) Миодистрофия врожденная,
- 56. Некоторые формы дистальных миопатий обусловлены мутациями в
- 57. Кавеолинопатии (7нозологических форм) Миодистрофия конечностно-поясная, аутосомно-доминантная,
- 58. Инактивирующие мутации в гене плектина, участвующего в
- 59. Сарколеммные миопатии (20 нозологических форм)Дистрофинопатии (миодистофия Дюшенна/Беккера)Саркогликанопатии
- 60. Наследственная недостаточность белков внеклеточного матрикса, взаимодействующих с
- 61. К матриксным миопатиям относятся также аутосомно-доминантные врожденные
- 62. Матриксные миопатии (4 нозологические формы) Миодистрофия врожденная,
- 63. Нарушения структуры белков ядерной ламины миофибрилл ассоциированы
- 64. При наиболее распространенной Х-сцепленной форме заболевания мутантным
- 65. Более редкие аутосомные формы миодистрофии Эмери-Дрейфуса обусловлены
- 66. Нарушения структуры белков ядерной ламины миофибрилл –
- 67. Мутации в гене ламина A/C, приводят к
- 68. Хорошо известная клиницистам немалиновая, или нитчатая миопатия
- 69. Миопатия немалиновая небулин – интегральный компонент тонких
- 70. Миотилиновые, титиновые и телетониновые конечностно-поясные миопатии1А: миотилин
- 71. Саркомерные миопатии (15 нозологических форм) Немалиновая
- 72. При целом ряде миопатий причиной дистрофических процессов
- 73. Определенные гистологические аномалии характерны для пациентов с
- 74. В первом случае – это рецептор 1
- 75. Для ряда миопатий, дебютирующих в позднем возрасте
- 76. Причиной развития патологических процессов в данных случаях
- 77. Конформационные болезни мышц десминовые миопатии, обусловленные накоплением
- 78. Биохимическая классификация миодистрофий и миопатий (60 нозологических
- 79. Таким образом, различные нарушения могут приводить к
- 80. Однако классификации наследственных болезней мышц, основанные на
- 81. Миодистрофии конечностно-поясные Доминантные 1А - миотилин
- 82. Лице-лопаточно-плечевая мышечная дистрофия Ландузи-Дежерина – третье по
- 83. Преимущественно поражается мускулатура лица, плечевого пояса и
- 84. В области локализации мутантного локуса FSHD1 (4q35-qter),
- 85. В норме количество копий этого повтора варьирует
- 86. Предполагается, что мутации, вызывающие лице-лопаточно-плечевую миодистрофию, нарушают
- 87. Сложные эпигенетические механизмы вовлечены в реализацию этого
- 88. Спинальные амиотрофии – это гетерогенная группа наследственных
- 89. Наиболее распространенной аутосомно-рецессивной формой поражения периферического двигательного
- 90. Основными клиническими проявлениями СМА являются слабость и
- 91. СМА делят на 3 формы: болезнь Верднига-Гоффмана,
- 92. Болезнь Верднига-Гоффмана может проявляться уже во внутриутробном
- 93. Развиваются вялые, преимущественно проксимальные парезы конечностей, глубокие
- 94. При СМА II ребёнок может научиться сидеть
- 95. Болезнь Кугельберга-Веландер характеризуется более медленным течением сходных
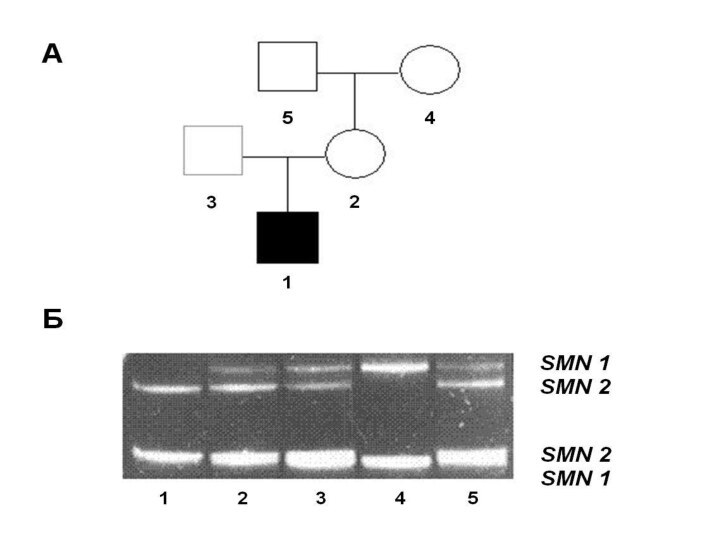
- 96. Все клинические типы СМА обусловлены мутациями в
- 98. При инактивации Smn-белка периферические двигательные нейроны теряют
- 99. В непосредственной близости от гена SMN1 идентифицирован
- 100. Характер экспрессии двух гомологичных генов SMN1 и
- 101. Поэтому присутствие у больных СМА трех и
- 102. Одна из главных стратегий лечения СМА направлена
- 103. Боковой амиотрофический склероз (БАС) характеризуется своеобразным сочетанием
- 104. БАС начинается в среднем возрасте и в
- 105. Для наследственных форм БАС характерна большая генетическая
- 106. Наследственные полиневропатии
- 107. Наследственные полиневропатии составляют до 60-70% всех
- 108. Клинически характеризуются прогрессирующей слабостью и атрофией дистальной
- 109. Патогенетически моторно-сенсорная невропатия делится на 2 основных
- 110. Для второго типа характерно первичное поражение аксонов, нормальная скорость проведения импульса, морфологически сохранность структуры миелина
- 111. Из сравнительно редких синдромов, отличающихся от классического
- 112. Для моторно-сенсорных полинейропатий характерна огромная генетическая гетерогенность.
- 113. Наиболее частыми являются аутосомно-доминантные демиелинизирующие полинейропатии, связанные с нарушением синтеза миелина периферических нервов
- 114. Тип 1А, обусловлен гиперпродукцией интегрального белка компактного
- 115. При типе 1B дефектным оказывается структурный белок
- 116. Относительно редкие аксональные формы аутосомно-доминантной болезни Шарко-Мари-Тута,
- 117. Синдром Дежерина-Сотта также генетически гетерогенен, но не
- 118. Наследственные миотонии и миоплегии (нервно-мышечные каналопатии)
- 119. Ионные каналы участвуют в поддержании мембранного потенциала,
- 120. Дефектная работа ионных каналов в кардиомиоцитах ассоциирована
- 121. Феномен миотонии заключается во внезапном тоническом спазме
- 122. Известны две клинические формы: аутосомно-доминантная врождённая миотония
- 123. Обе формы обусловлены мутациями в гене
- 124. Наследственная пароксизмальная миоплегия характеризуется приступами резкой слабости,
- 125. Аутосомно-доминантная гипокалиемическая форма, или болезнь Шахновича-Вестфаля встречается
- 126. Краниальная мускулатура, как правило, не страдает, сознание
- 127. Гиперкалиемическая форма пароксизмальной миоплегии, или болезнь Гармстропа
- 128. При гипокалиемическом параличе, обусловленном мутациями в гене
- 129. Мутации в гене SCN4 (17q23.1), кодирующем альфа-4-субъединицу
- 130. В результате дефекта натриевого канала происходит усиление
- 131. Наследственные миастении
- 132. В разделе наследственных нейромышечных заболеваний традиционно рассматривают
- 133. Миастения клинически характеризуется нарастающей при выполнении движений
- 134. Различают миастению генерализованную и локальную с поражением
- 135. Опасны миастенические кризы, когда внезапно развиваются генерализованная
- 136. Как и для многих других аутоиммунных заболеваний,
- 137. В патогенезе аутоиммунной реакции основную роль играет
- 138. Патогенетическая терапия: антихолинэстеразные препараты (прозерин, оксазил, каллимин),
- 139. Редкие врожденные миастенические синдромы – это моногенные
- 140. Пресинаптический миастенически синдром, сопровождающийся эпизодической атаксией, обусловлен
- 141. Постсинаптический синдром по характеру кинетического дефекта ацетилхолинового
- 142. И в том, и в другом случае
- 143. При этом причиной развития варианта с быстрым
- 144. При варианте с медленным потоком мутации в
- 145. В некоторых случаях у больных с врожденным
- 146. Синаптический вариант врожденного миастенического синдрома обусловлен недостаточностью
- 147. При нарушении структуры коллагена Q не происходит встраивания ацетилхолинэстеразы в базальную пластинку синаптической щели
- 148. Скачать презентацию
- 149. Похожие презентации
Понимание ведущей роли генетических факторов в этиологии и патогенезе многих болезней нервной системы сформировалось в первой половине прошлого века, и немаловажную роль в этом сыграли работы выдающегося отечественного невропатолога С. Н. Давиденкова.















































































































































Слайд 3 Конец XX века и начало нового тысячелетия ознаменовался
бурным развитием молекулярной генетики человека, важнейшие достижения которой нашли
практическое воплощение во многих областях медицины, в том числе и в неврологииСлайд 4 В 1990-2000 годы,
получившие название «Десятилетие мозга», фактически произошла смена фундаментальных концепций,
касающихся молекулярных основ этиологии и патогенеза наследственных болезней нервной системыСлайд 5 Идентификация мутантных генов и первичных биохимических нарушений, ответственных
за развитие многих десятков подобных заболеваний, привела к возможности
их патогенетической классификацииСлайд 6 На этой основе были сформированы новые неизвестные
ранее классы заболеваний, такие как болезни экспансии, конформационные болезни
мозга, наследственные каналопатии и др.Слайд 7 В основе болезней экспансии, лежат динамические мутации, обусловленные
нестабильностью расположенных в значимых областях генов тринуклеотидных сателлитных повторов.
В настоящее время описаны около 30 болезней экспансии, большинство из них затрагивают нервную системуСлайд 8 Патогенетический механизм нейродегенеративных болезней, обусловленных экспансией CAG-или
GCG-повторов, расположенных в кодирующих областях генов, связан с изменением
конформации белков и внутриклеточным накоплением нерастворимых белковых комплексов с последующей гибелью клеток по типу апоптозаСлайд 9 Подобные болезни получили название конформационных. К ним относятся
некоторые миопатии, синдромы паркинсонизма, амилоидные нейропатии, наследственные формы болезни
Альцгеймера и Паркинсона, прионные болезни, боковой амиотрофический склероз и др.Слайд 10 При наследственных заболеваниях с пароксизмами, гипер- или гипо-возбудимостью
вовлеченных в патологический процесс тканей, обнаружены мутации в генах
ионных каналов – ионопатии или каналопатииСлайд 11 К каналопатиям относятся миотонии, периодические параличи, наследственные
формы абсанс эпилепсии и мигрени
Слайд 12 Нервно-мышечные заболевания характеризуются нарушением движений и прогрессирующей атрофией
мышц. Выделяют: прогрессирующие мышечные дистрофии (миопатии); спинальные амиотрофии; наследственные
полиневропатии; миотонии и миоплегииСлайд 14 Клиническая классификация прогрессирующих мышечных дистрофий (ПМД) основана на
характере распространения мышечных атрофий и парезов – конечностно-поясные, лице-лопаточно-плечевые,
дистальные, окулофаренгиальные.Слайд 15 Морфологически в мышечных волокнах при миопатиях выявляются дистрофические
и некротические изменения, разрастание соединительной ткани, диффузная разнокалиберность миоцитов.
Признаки денервации на ЭМГ отсутствуютСлайд 16 Биохимически в сыворотке крови увеличено содержание саркоплазматических ферментов
– креатинфосфокиназы (КФК), альдолазы, лактатдегидрогеназы и др. Эти нарушения
свидетельствуют о гибели миоцитов и на 1-1,5 года опережают появление клинических симптомовСлайд 17 Наиболее распространенной и злокачественной формой нервно-мышечной патологии детского
возраста является
прогрессирующая Х-сцепленная псевдогипертрофическая миодистрофия Дюшенна/Беккера
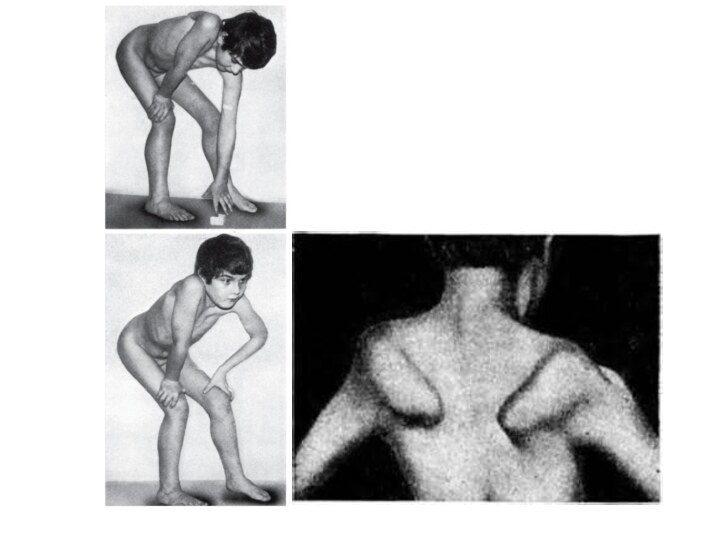
Слайд 18 Первые признаки миодистрофии Дюшенна появляются в возрасте 2-7
лет. При начале ходьбы отмечаются неловкость в движениях, быстрая
утомляемость. Постепенно появляются затруднения при подъёме по лестнице, вставании из положения на корточках, беге, ходьбеСлайд 19 Патологический процесс носит восходящий характер. Первыми поражаются мышцы
тазового пояса и проксимальных отделов нижних конечностей, затем мышцы
плечевого пояса и проксимальных отделов верхних конечностей. В процесс вовлекаются длинные мышцы спины, формируются поясничный гиперлордоз, «осиная талия», крыловидные лопатки, симптом свободных надплечий, «утиная походка»Слайд 21 Характерно лицо «сфинкса», «миопата» - гипертелоризм, недостаточность мимической
мускулатуры. Возникают вторичные деформации позвоночника, грудной клетки, ретракции сухожилий,
контрактуры суставов. Примерно у четверти больных диагностируется олигофрения в степени дебильностиСлайд 22 Больные миодистрофией Дюшенна сохраняют способность к ходьбе до
10-12-летнего возраста, после чего передвигаются только с помощью инвалидной
коляски. Погибают в возрасте 18 – 25 лет от интеркуррентных заболеваний, не оставляя потомства.Слайд 23 Миодистрофия Беккера – это более мягкий вариант Х-сцепленной
прогрессирующей мышечной дистрофии. В настоящее время убедительно доказано, что
обе формы миодистрофии обусловлены разными мутациями в одном и том же гене – DMD (Xp21.2)Слайд 24 В некоторых случаях дюшенно-подобные миодистрофии наследуются по аутосомно-рецессивному
типу. К подобным заболеваниям относится, в частности, врожденная прогрессирующая
миодистрофия Фукуяма, сочетающаяся с умственной отсталостьюСлайд 25 Конечностно-поясные миодистрофии – это гетерогенная группа заболеваний с
преимущественной локализацией дистрофического процесса в мышцах плечевого и тазового
поясаСлайд 26 Больные начинают испытывать затруднения при беге и ходьбе
в 15-20 лет, однако способность к самостоятельному передвижению может
сохраняться до 30 лет. Клиническая картина соответствует форме ДюшеннаСлайд 27 Генетическое разнообразие наследственных конечностно-поясных миодистрофий очень велико. Идентифицированы
мутантные гены для четырех аутосомно-рецессивных и десяти аутосомно-доминантных вариантов
этих заболеванийСлайд 28 При некоторых формах конечностно-поясная миодистрофия сочетается с выраженной
патологией других систем, например с буллезным эпидермолизом или контрактурами
суставов и кардиомиопатией - миодистрофия Эмери-ДрейфусаСлайд 29 В самостоятельную клиническую группу традиционно выделяют врожденные непрогрессирующие
миопатии. Наиболее частой из них является мерозин-дефицитная миопатия. Характерной
чертой врожденных миопатий Бетлема и Ульриха является их сочетание с контрактурами суставовСлайд 30 Патологические процессы при некоторых врожденных непрогрессирующих миопатиях обусловлены
отложением в миофибриллах гистологически идентифицируемых аномальных образований
Слайд 31 При немалиновой миопатии в мышечных клетках пациентов присутствуют
нитеобразные патологические фибриллярные структуры, причиной развития которых является латеральная
экспансия Z-дисковСлайд 32 Определенные гистологические аномалии выявляются также у больных миотубулярной
миопатией и болезнью центрального стержня
Слайд 33 Нерастворимые включения в мышечных клетках характерны и для
других миопатий, дебютирующих в более позднем возрасте. Примерами являются
десминовая миопатия, миопатия с инклюзионными тельцами и локальная окулофарингеальная миопатияСлайд 34 В особую группу выделяют медленно прогрессирующие митохондриальные миопатии,
клиническая картина которых складывается из слабости мышц, начинающейся с
мышц тазового пояса, и постепенной их атрофииСлайд 35 Наследственные дефекты различных мышечных ферментов являются причиной развития
относительно доброкачественных метаболических миопатий, таких как мышечный гликогеноз –
болезнь Мак-Ардла, миопатия напряжения и другиеСлайд 36 В настоящее время расшифрована молекулярно- генетическая природа многих
наследственных форм мышечных дистрофий и миопатий, что позволяет проводить
их биохимическую классификациюСлайд 37 Оказалось, что белковые продукты многих генов, связанных с
наследственными болезнями мышц, ассоциированы с мембранами мышечных волокон и
часто, хотя и не всегда, выполняют тамструктурную роль. Условно их можно отнести к сарколеммным миопатиям
Слайд 38
Основными функциями подобных белков являются:
стабилизация сарколеммы мышечного
волокна за счет связывания цитоскелета с внеклеточным матриксом
обеспечение
трансмембранного информационного потока формирование нейромышечного синапса
Слайд 39 К подобным белкам относится дистрофин – стержневидный белок,
принадлежащий к
спектрин/α-актининовому суперсемейству белков цитоскелета
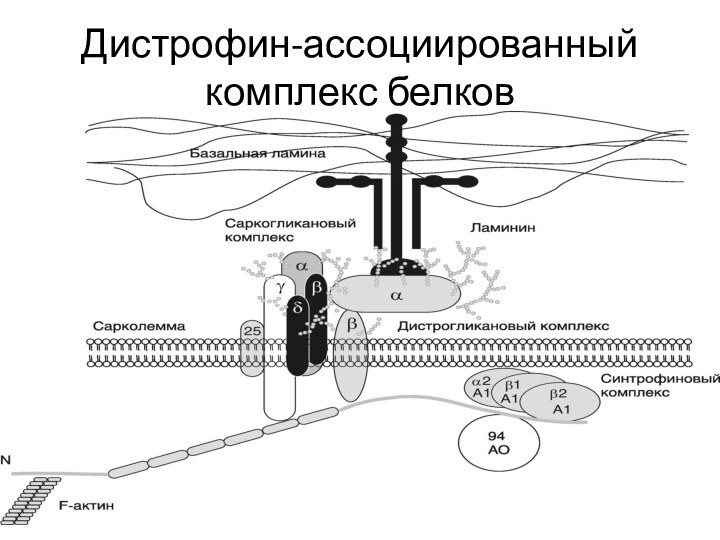
Слайд 41 N-концевой домен дистрофина связан с цитоскелетом мышечного волокна.
Затем идет самый крупный стержневидный домен, обеспечивающий гибкость молекулы.
Последние два домена – цистеин-богатый и С-концевой наиболее значимы в функциональном отношенииСлайд 42 В области цистеин-богатого домена формируются кальциевые каналы и
осуществляется связь дистрофина, а значит и цитоскелета мышечного волокна
с внеклеточным матриксом через трансмембранный комплекс дистрофин-ассоциированных белковСлайд 43 Эти белки, в свою очередь, разделяют на два
субкомплекса – саркогликановый и дистрогликановый. В области С-концевого домена
располагается синтрофиновый комплекс, функции которого особенно важны для формирования нейромышечного синапсаСлайд 44 При миодистрофии Дюшенна/Беккера, также как при аутосомно-рецессивных дюшенно-подобных
и некоторых конечностно-поясных миодистрофиях происходит разрушение дистрофин-ассоциированного комплекса белков
Слайд 45 При миодистрофии Дюшенна/Беккера разрушение дистрофин-ассоциированного комплекса белков происходит
за счет мутаций в гене дистрофина.
Таким образом эти заболевания
относятся к дистрофинопатиям
Слайд 46 Разрушение дистрофинового комплекса за счет специфических мутаций в
гене DMD является одним из центральных звеньев в этиологии
некоторых наследственных форм дилатационных кардиомиопатий , которые также могут быть отнесены к дистрофинопатиямСлайд 47 В 65-70% случаев у больных миодистрофией Дюшенна/Беккера диагностируются
протяженные внутригенные делеции, затрагивающие несколько соседних экзонов гена DMD,
причем эти делеции характерны для обеих форм заболеванияСлайд 48 Различия заключаются в том, что при миодистрофии Дюшенна
делеции сопровождаются сдвигом рамки считывания, и дистрофин у больных
вообще не образуется. При форме Беккера делеции не нарушают рамку считывания, дистрофин синтезируется, но имеет аномалииСлайд 49 В гене DMD идентифицированы также относительно небольшие перестройки
и нонсенс-мутации, в то время как миссенс-мутации встречаются редко
Слайд 50 Молекулярная диагностика делеций в гене DMD проводится с
использованием мультиплексной ПЦР, что позволяет во многих семьях высокого
риска проводить профилактику заболевания на базе пренатальной диагностикиСлайд 52 Разрушение дистрофин-ассоциированного комплекса белков при аутосомно-рецессивных дюшенно-подобных
и некоторых конечностно-поясных миодистрофиях происходит за счет мутаций в
генах саркогликанов – SGCG, SGCA, SGCB и SGCD. Это саркогликанопатииСлайд 54 Мутации в генах дистрогликанов не обнаружены. Но при
врожденных миодистрофиях, сопровождающихся тяжелой умственной отсталостью, найдены мутации в
генах ферментов, участвующих в процессинге дистрогликанов. Это дистрогликанопатии
Слайд 55
Дистрогликанопатии
(5 нозологических форм)
Миодистрофия врожденная, прогрессирующая с
умственной отсталостью, тип Фукуяма, аутосомно-рецессивная
Уолкера-Варбурга синдром
Миодистрофия конечностно-поясная,
аутосомно-рецессивная, 2I Миодистрофии врожденные 1С и 1D,
с неврологическими аномалиями
Слайд 56 Некоторые формы дистальных миопатий обусловлены мутациями в гене
кавеолина – основного белка кавеоловых мембран сарколеммы мышечного волокна
и взаимодействующего с ним белка - дисферлина.Эти миодистрофии получили название кавеолинопатии
Слайд 57
Кавеолинопатии
(7нозологических форм)
Миодистрофия конечностно-поясная, аутосомно-доминантная, 1C
миопатия
дистальная
болезнь волнистых (rippling) мышц
Миодистрофия конечностно-поясная, аутосомно-рецессивная, 2B
Миопатия дистальная, Миоши
Слайд 58 Инактивирующие мутации в гене плектина, участвующего в связи
цитоскелета мышечного волокна с мембраной, приводят к необычной форме
миодистрофии, сочетающейся с буллезным эпидермолизом
Слайд 59
Сарколеммные миопатии
(20 нозологических форм)
Дистрофинопатии (миодистофия Дюшенна/Беккера)
Саркогликанопатии (4 формы
конечностно-поясных миодистофий)
Дистрогликанопатии (5 форм миодистофий с неврологическими аномалиями)
Кавеолинопатии (7
форм конечностно-поясных и дистальных миодистофий)Плектинопатия (миодистофия с буллезным эпидермолизом)
Слайд 60 Наследственная недостаточность белков внеклеточного матрикса, взаимодействующих с дистрогликановым
комплексом, является причиной развития врожденных аутосомно-рецессивных болезней мышц, среди
которых наиболее частой является мерозин-дефицитная миопатия, обусловленная мутациями в гене мерозина, или ламинина 2 – LAMA2 (6q22,33)Слайд 61 К матриксным миопатиям относятся также аутосомно-доминантные врожденные миопатии
Бетлема и Ульриха. Эти заболевания обусловлены дефектами трех разных
α-субъединиц микрофибриллярного коллагена VI типа, выполняющего в мышцах роль моста между клетками и внеклеточным матриксом
Слайд 62
Матриксные миопатии
(4 нозологические формы)
Миодистрофия врожденная, мерозин-дефицитная, аутосомно-рецессивная
Миопатия врожденная, интегрин α7 β1D-дефицитная, аутосомно-рецессивная
Миопатия Бетлема, доброкачественная,
врожденная с контрактурами Миодистрофия Ульриха, врожденная, склероатоническая
Слайд 63 Нарушения структуры белков ядерной ламины миофибрилл ассоциированы с
другой группой мышечных дистрофий, получивших название ламинопатии. Это различные
формы мышечной дистрофии с контрактурами суставов и кардиологическими дефектами проводимости Эмери-ДрейфусаСлайд 64 При наиболее распространенной Х-сцепленной форме заболевания мутантным оказывается
ген EMD (Xq28) ядерного ламина-ассоциированного белка, получившего название эмерин
Слайд 65 Более редкие аутосомные формы миодистрофии Эмери-Дрейфуса обусловлены мутациями
в гене LMNA (1q22), кодирующем синтез двух филаментных белков
ядерной ламины – ламина A и C. Оба эти белка взаимодействуют с эмериномСлайд 66 Нарушения структуры белков ядерной ламины миофибрилл – ламинопатии
(3 нозологические формы)
миодистрофия с контрактурами Эмери-Дрейфуса, Х-сцепленная
миодистрофия с
контрактурами Эмери-Дрейфуса, аутосомно-рецессивная, аутосомно-доминантная Слайд 67 Мутации в гене ламина A/C, приводят к 13
заболеваниям, включающим наряду с мышечными дистрофиями различные варианты липодистрофии,
полинейропатии, мандибулоакральной дисплазии и целую серию прогерических синдромовСлайд 68 Хорошо известная клиницистам немалиновая, или нитчатая миопатия также
представляет собой генетически гетерогенную группу заболеваний. Данная разновидность миопатий
обусловлена дефектами основных структурных белков тонких и толстых нитей саркомера
Слайд 69
Миопатия немалиновая
небулин – интегральный компонент тонких (актиновых)
и толстых (миозиновых) филамент саркомера
тропомиозин 2 – основной
белковый компонент толстых филамент саркомератропомиозин 3 – главный белковый компонент латеральных Z-дисков
тропонин T1 - член Ca+-зависимого тропонинового комплекса, взаимодействующего с тропомиозиновым димером саркомера
α-актин – основной белковый компонент тонких филамент саркомера
Слайд 70
Миотилиновые, титиновые и телетониновые конечностно-поясные миопатии
1А: миотилин –
гигантский саркомерный белок, содержащий несколько Ig-подобных доменов, ассоциированный с
актиновыми филаментами в комплексе с альфа-актинином2J: титин или коннектин – гигантский
белок, занимающий половину саркомера между Z- и M-слоями
2А: калпаин-3 – мышечная протеаза, лиганд титина
2G: телетонин – саркомерный 19-кД белок, располагающийся в Z-дисках, субстрат титина
Слайд 71
Саркомерные миопатии
(15 нозологических форм)
Немалиновая миопатия
(6 нозологических форм)
Миотилиновые, титиновые и телетониновые конечностно-поясные
миопатии (9 нозологических форм)
Слайд 72 При целом ряде миопатий причиной дистрофических процессов является
накопление в цитоплазме и/или в ядрах мышечных клеток гистологически
идентифицируемых включений, молекулярные механизмы формирования которых могут быть совершенно различнымиСлайд 73 Определенные гистологические аномалии характерны для пациентов с болезнью
центрального стержня и миотубулярной миопатией. В обеих случаях дефектными
оказываются белки, участвующие в контроле дифференцировки мышечных волоконСлайд 74 В первом случае – это рецептор 1 рионадина
– кальций высвобождающего канала саркоплазматического ретикулума скелетных мышц, во
втором – мышечная тирозин-серин-фосфатаза, участвующая в дифференцировке мышечных клетокСлайд 75 Для ряда миопатий, дебютирующих в позднем возрасте и
сочетающихся с нарушениями сердечной проводимости, аритмиями и рестриктивной сердечной
недостаточностью, характерно присутствие нерастворимых цитоплазматических и ядерных включений в мышечных клеткахСлайд 76 Причиной развития патологических процессов в данных случаях являются
нарушения конформации определенных мышечных белков, то есть это конформационные
болезни мышц
Слайд 77
Конформационные болезни мышц
десминовые миопатии, обусловленные накоплением цитоплазматических филаментных
включений
миопатии с инклюзионными тельцами, при которых наблюдается
отложения β-амилоида в дегенерирующих мышечных волокнах конечностно-поясная миодистрофия с ранним началом костной болезни Пагета и деменцией, обусловленная дефектом системы убиквитин-зависимой деградации белков
окулофарингеальная миопатия, при которой
тубулофиламентные включения образуются за счет увеличения длины полиаланиновой цепочки в поли(А)-связывающим белке 2
Слайд 78
Биохимическая классификация миодистрофий и миопатий
(60 нозологических форм)
Сарколеммные миопатии
(20)
Матриксные миопатии (4)
Ламинопатии (3)
Саркомерные миопатии (15)
Дефекты дифференцировки
(2)Конформационные болезни мышц (6)
Митохондриальные миопатии
Метаболические миопатии
Слайд 79 Таким образом, различные нарушения могут приводить к развитию
сходных патологических процессов в мышцах. При постановке дифференциального диагноза
миопатии, наряду с клиническими критериями, решающую роль играет гистологический и гистохимический анализ биоптатов мышц больногоСлайд 80 Однако классификации наследственных болезней мышц, основанные на морфологических
и патогенетических критериях, далеко не всегда совпадают. Это хорошо
видно на примере клинически сходных наследственных КПМД, к развитию которых могут приводить дефекты структурных белков сарколеммы, саркомеров, ядерной ламины, а также некоторых других мышечных белков
Слайд 81
Миодистрофии конечностно-поясные
Доминантные
1А - миотилин
1B
- ламин A/C
1C - кавеолин-3
Рецессивные
2A
- калпаин-3 2B - дисферлин
C,D,E,F – саркогликаны
2G - телетонин
2H -убиквитин лигаза
2I – гликозил-трансфераза
2J - титин