Слайд 2
ПЛАН ЛЕКЦИИ
ЧТО ТАКОЕ ИММУНИТЕТ, ЕГО ВИДЫ.
ХАРАКТЕРИСТИКА ВРОЖДЕННОГО И
ПРИОБРЕТЕННОГО ИММУНИТЕТА.
ВИДЫ И СВОЙСТВА АНТИГЕНОВ.
СОСТАВ И СТРОЕНИЕ ИММУННОЙ СИСТЕМЫ.
МЕХАНИЗМ
ФОРМИРОВАНИЯ ИММУННОГО ОТВЕТА, ХАРАКТЕРИСТИКА ЕГО СТАДИЙ.
РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА
НАРУШЕНИЯ ИММУНИТЕТА, ИХ ВИДЫ.
ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ.
АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ.
Слайд 3
Латинское слово immunis употреблялось
в медицине
древнего Рима (устойчивый к
болезни, чистый).
В
настоящее время понятие иммунитет
включает в себя способ защиты организма от
чужеродных патогенов и обеспечение
генетической целостности особи.
Латинское слово immunis употреблялось
в медицине древнего Рима (устойчивый к
болезни, чистый).
В настоящее время понятие иммунитет
включает в себя способ защиты организма от
чужеродных патогенов и обеспечение
генетической целостности особи.
Слайд 4
различают:
Врожденный или естественный иммунитет
II. Специфический иммунный
ответ (истинный или приобретенный иммунитет)
Слайд 5
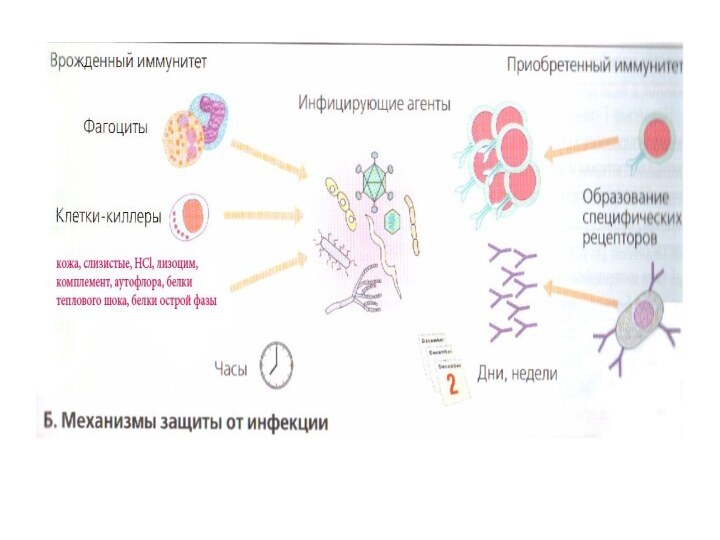
I. Врожденный (естественный) иммунитет
В основе
его лежат воспаление и фагоцитоз, включаются быстро.
Ранее
считалось, что фагоцитоз неспецифичен, сейчас доказано, что фагоциты с помощью рецепторов распознают молекулы присущие только микроорганизмам и отсутствующие у многоклеточных и таким образом отличают микробы от клеток своего организма.
Слайд 6
Неспецифическая резистентность или система врожденного иммунитета
обусловлена наследственными анатомо-физиологическими особенностями организма (см. учебник).
Факторы естественной резистентности включаются в защиту сразу после преодоления возбудителем кожных или слизистых оболочек и внедрения его во внутреннюю среду организма. В течение первых 4-х часов после внедрения микроба, они являются практически единственными защитниками организма.
Слайд 7
II. Специфический иммунный ответ (истинный или приобретенный иммунитет)
иммунитет адаптивный или приобретенный, вырабатывается в процессе жизни индивида.
активируется после размножения лимфоцитов и их дифференцировки в эффекторные клетки.
в его основе – способность лимфоцитов распознавать антигены (их в природе ≈ 1018) и организовывать их деструкцию.
Иммунитет = распознавание аг+ деструкция.
Слайд 9
Антигены – это генетически чужеродные вещества,
вызывающие иммунный ответ.
Слайд 10
Основные свойства полного антигена:
макромолекулярность ( не менее 10
кДа )
генетическая чужеродность.
объемность (молекула не м. б. антигенной
, если имеет плоскостную структуру, н-р желатина – высокомолекулярный белок, но он лишен третичной структуры и не может участвовать в реакциях типа «ключ-замок»).
это белки и белоксодержащие соединения.
Слайд 11
Молекула полного аг состоит из 2-х частей –
информационной и несущей. Информационная часть (аг детерминанта) определяет специфичность
антигена, несущая - способствует проникновению аг в организм.
Эпитоп - наименьшая распознаваемая единица Аг.
У одного «большого» Аг может быть
множество различных эпитопов. Чем сложнее
молекула тем с большей вероятностью она
проявит себя как иммуноген.
Слайд 12
Неполные антигены (гаптены) – это низкомолекулярные небелковые молекулы,
состоящие из информационной части, они приобретают антигенные свойства в
соединении с белками организма.
Слайд 13
Иммунная система
Это система, обеспечивающая иммунитет, эволюционно она
формировалась для защиты макроорганизма от любых объектов, чужеродных в
антигенном отношении.
Органы иммунной системы подразделяются на центральные и периферические.
Слайд 14
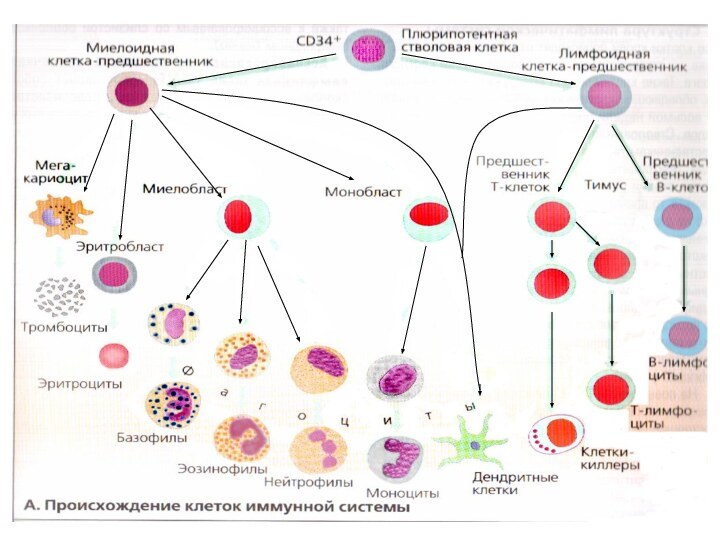
Центральные органы – костный мозг и тимус.
В
них происходит лимфопоэз – это дифференцировка лф из стволовой
кроветворной клетки до зрелого неиммунного лф (в костном мозге идет антигеннезависимое созревание Влф, в тимусе – Тлф );
Зрелые неиммунные лф по-английски называют наивные или девственные.
Периферические органы – селезенка, лимфатические узлы и лимфоидные образования в коже и слизистых.
В них происходит контакт лф с аг, после чего лимфоцит вступает в иммуногенез, т.е. начинает пролиферировать и продуцировать эффекторные молекулы, это антигензависимый этап созревания лимфоцитов.
Слайд 15
Основные функции иммунной системы
1. Защита от «чужого»,
2.
Удаление «модифицированного своего» (опухолевые, инфицированные, стареющие и другие клетки),
3.
Регуляция роста и развития клеток и тканей.
Слайд 16
Клетки иммунной системы
(см.учебник)
Антигенпредставляющие клетки: макрофаги, дендритные клетки, В
- лф ;
Регуляторные клетки: Т-хелперы и Т-reg;
Эффекторные клетки: плазматические
клетки, цитотоксические Т-лф (К-клетки), ТГЗТ-лф, натуральные киллеры (NK-клетки), моноциты/макрофаги, тучные клетки, гранулоциты – нейтрофильные, эозинофильные и базофильные.
Клетки памяти: Т- и В-клетки памяти.
Слайд 18
Молекулы клеточных мембран лимфоцитов
Выделяют 4 основных типа молекул:
CD-молекулы
(cluster of differentiation – кластеры дифференцировки).
Они
позволяют различать клетки между собой, служат адгезивными и костимулирующими молекулами, рецепторами сигналов апоптоза, маркёрами активации лф.
Слайд 19
Молекулы клеточных мембран лимфоцитов
2. TCR
– специфический рецептор Т-
лимфоцитов для распознавания и
связывания определенного антигена.
TCR бывает 2-х типов:
αβ - распознаёт эпитоп на фоне мембранных молекул МНС,
γδ - распознаёт аг вне связи с другими молекулами (так же как и ВCR)
Слайд 20
3. ВCR – специфический рецептор В-лимфоцитов для распознавания
и связывания определенного антигена (ВСR это молекула Ig).
TCR
и ВCR синтезируются во время лимфопоэза, т.е. в отсутствие антигена.
Каждый лимфоцит экспрессирует только один вариант антигенсвязывающего рецептора и предназначен только для одного конкретного антигена.
Молекулы клеточных мембран лимфоцитов
Слайд 21
4. Антигены главного комплекса гистосовместимости – МНС (major
histocompatibility complex), у человека они называются – Human leukocytes
antigens – HLA, у представителей других видов называются иначе, н-р у мышей – Н2, у собак –DLA.
Называются так, поскольку способны
вызывать сильную реакцию отторжения при
пересадке тканей в пределах одного вида.
Молекулы клеточных мембран лимфоцитов
Слайд 22
Гены МНС расположены на 6 хромосоме Спектр
MHC определяет биологическую
индивидуальность организма.
Молекулы класса I -
на всех ядросодержащих клетках (кроме трофобластов).
Молекулы класса II - на иммунокомпетентных клетках (макрофаги, моноциты, Т- и В-лимфоциты).
В представлении антигена лимфоцитам участвуют HLA-1 и HLA-2 .
Слайд 23
Гуморальные факторы
специфического иммунитета – это
антитела
(иммуноглобулины)
цитокины
см.учебник
Слайд 24
ИММУННЫЙ ОТВЕТ
это процесс взаимодействия клеток иммунной системы,
который индуцируется антигеном и приводит к образованию антител или
иммунных лимфоцитов.
по механизму формирования различают 2 типа иммунного ответа: клеточный и гуморальный.
Слайд 25
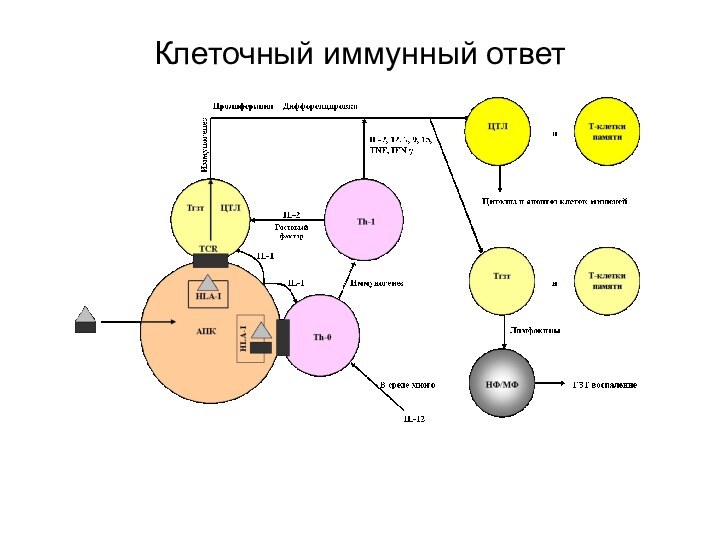
Клеточный иммунный ответ
Формируется в основном на АГ вирусов,
опухолевых клеток и пересаженных
чужеродных клеток, а также клеток,
инфицированных микробами или вирусами.
Его основные эффекторные клетки – Т-лф:
цитотоксические Тлф (ЦТЛ),
Тлф (ТГЗТ), отвечают за гиперчувствительность замедленного типа,
Т-клетки памяти.
Слайд 26
Гуморальный иммунный ответ
Это основа антитоксического,
антибактериального и антигрибкового иммунитета.
В его развитии
участвуют В-лф: они превращаются в плазматические клетки, синтезирующие антитела и В-клетки памяти.
Слайд 27
Развитие пути иммунного ответа
зависит от:
Природы антигена.
Участия в презентации антигена молекул HLA-1
или HLA-2.
От вида Т-хелперов и от цитокиновых сигналов активации.
Слайд 28
Т-хелперы бывают 1-го и 2-го типа и
образуются из
наивного Т-лимфоцита (Тх-0).
Th1 или Т-хелперы 1- го типа
выделяют ИЛ - 2, 7,9,12,15, γ-ИФН и TNF-α. Эти цитокины – основные участники клеточного иммунного ответа и соответствующего воспаления.
Th2 выделяют ИЛ – 2, 4, 5, 6, 10, 13, 14 и др., участвующие в гуморальном иммунном ответе.
Слайд 29
стадии иммунного ответа
1. Эндоцитоз антигена, его обработка
и презентация лимфоцитам;
2. Распознавание антигена лимфоцитами;
3. Активация лимфоцитов;
4. Клональная
экспансия или пролиферация лимфоцитов;
5. Созревание эффекторных клеток и клеток памяти.
6. Деструкция антигена.
Слайд 30
1.Стадия поглощения, переработки и презентации антигена
Антиген проникает
во внутреннюю среду организма. Его поглощают дендритные клетки и
макрофаги, по «дороге» расщепляющие АГ (ДК способны мигрировать в лимфоузлы, поэтому в первичном иммунном ответе они являются основной АПК).
расщепленный аг загружается на молекулу HLA и выводится на поверхность клетки для презентации лимфоцитам.
при связывании аг с рецептором лф активируется и с этого момента начинается иммунный ответ.
Вероятность контакта специфических клонов лф (т.е. лф с рецептором, комплементарным данному антигену) с АПК крайне
мала, но существует механизм улавливания циркулирующих
лимфоцитов:
Слайд 31
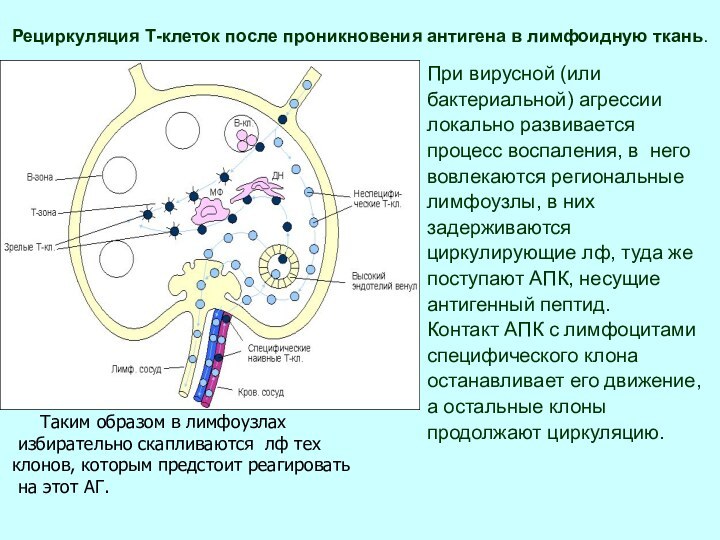
Рециркуляция Т-клеток после проникновения антигена в лимфоидную ткань.
При
вирусной (или
бактериальной) агрессии
локально развивается
процесс воспаления, в
него
вовлекаются региональные
лимфоузлы, в них
задерживаются
циркулирующие лф, туда же
поступают АПК, несущие
антигенный пептид.
Контакт АПК с лимфоцитами
специфического клона
останавливает его движение,
а остальные клоны
продолжают циркуляцию.
Таким образом в лимфоузлах
избирательно скапливаются лф тех
клонов, которым предстоит реагировать
на этот АГ.
Слайд 32
2. Стадия распознавания антигена
Т-хелперы могут
узнать чужеродный АГ на поверхности макрофага только на фоне
собственной HLA-молекулы (так называемое двойное распознавание) ⇒ соединение антигена с HLA необходимо.
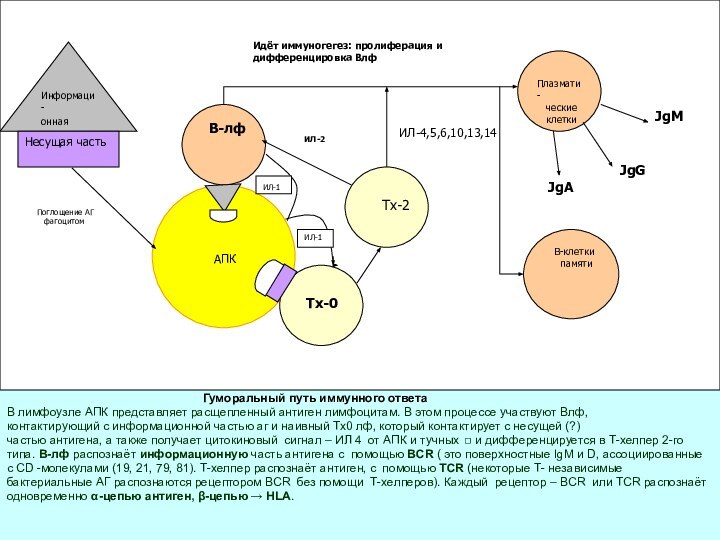
Гуморальный путь иммунного ответа
В лимфоузле АПК представляет расщепленный антиген лимфоцитам. В этом процессе участвуют Влф,
контактирующий с информационной частью аг и наивный Тх0 лф, который контактирует с несущей (?)
частью антигена, а также получает цитокиновый сигнал – ИЛ 4 от АПК и тучных ◻ и дифференцируется в Т-хелпер 2-го
типа. В-лф распознаёт информационную часть антигена с помощью BCR ( это поверхностные IgM и D, ассоциированные
с CD -молекулами (19, 21, 79, 81). Т-хелпер распознаёт антиген, с помощью TCR (некоторые Т- независимые
бактериальные АГ распознаются рецептором BCR без помощи Т-хелперов). Каждый рецептор – BCR или TCR распознаёт
одновременно α-цепью антиген, β-цепью → HLA.
Идёт иммуногегез: пролиферация и дифференцировка Влф
Поглощение АГ
фагоцитом
Слайд 35
3.Стадия активации.
Ещё во время распознавания и В-лф и
Т-лф
должны получить три стимула – один
специфический и
2 неспецифических:
специфический сигнал – связывание АГ с BCR или TCR
неспецифические сигналы активации:
а) взаимодействие лф с цитокинами
б) сигнал от костимулирующих молекул.
Слайд 36
Механизм активации
Для пролиферации требуется экспрессия
генов, кодирующих ИЛ-2 (ключевой ростовый фактор)
После
активации Тх2 выделяют цитокины - модуляторы клеточного ответа.
Тх1 секретируют цитокины – опосредующие гуморальный ответ.
Слайд 37
4.Стадия клональной пролиферации.
После распознавания антигена и
активации В- и Т-лф начинают размножаться (пролиферировать). Этот процесс
регулируется цитокинами.
Слайд 38
5.Стадия дифференцировки.
Цитокины Тх1 стимулируют в лимфоузлах
и селезенке размножение и созревание Т-лф
(ЦТЛ
или ТГЗТ) в зрелые клетки и Т-клетки памяти
Цитокины Тх2 способствуют образованию из В-лф плазматических клеток, которые мигрируют в костный мозг и слизистые оболочки, и там синтезируют антитела. Часть активированных Влф сохраняется как долгоживущие В-клетки памяти.
Слайд 39
Очередное воздействие того же
Аг вызывает более быстрый и выраженный (по сравнению с
первичным) вторичный ответ. Иммунологическая память сохраняется длительно.
Слайд 40
6.Стадия деструкции антигена
происходит с привлечением неспецифических факторов
защиты.
Деструкция антигена при клеточном ответе:
а) цитолиз клеток-мишеней лимфоцитами
б) индукция апоптоза лимфоцитами
в) фагоцитоз клеток - мишеней
ТГЗТ-лф с помощью цитокинов (ИФН-γ и МИФ) привлекают фагоциты в очаг воспаления и активируют их. Активированные макрофаги и нейтрофилы уничтожают клетки-мишени.
Слайд 41
Механизмы деструкции антигена при гуморальном иммунном ответе
а) Комплемент-зависимый
лизис иммунных комплексов АГ+АТ;
б) Фагоцитоз и расщепление растворимых ИК
макрофагами;
в) Антителозависимая клеточная цитотоксичность (АЗКЦ):
АТ опсонизируют клетки-мишени, затем клетки-киллеры (NК-клетки, моноциты/макрофаги, гранулоциты) присоединяются к Fc-фрагменту антитела и разрушают клетку-мишень.
IgG в гуморальном ответе могут нейтрализовать вирусы, но
только находящиеся в межклеточном пространстве.
Вирионы внутри ◻ для них недоступны, ⇒ главными
эффекторами противовирусного иммунитета являются Тлф.
г) простая нейтрализация антигена при связывании его антителом.
Слайд 42
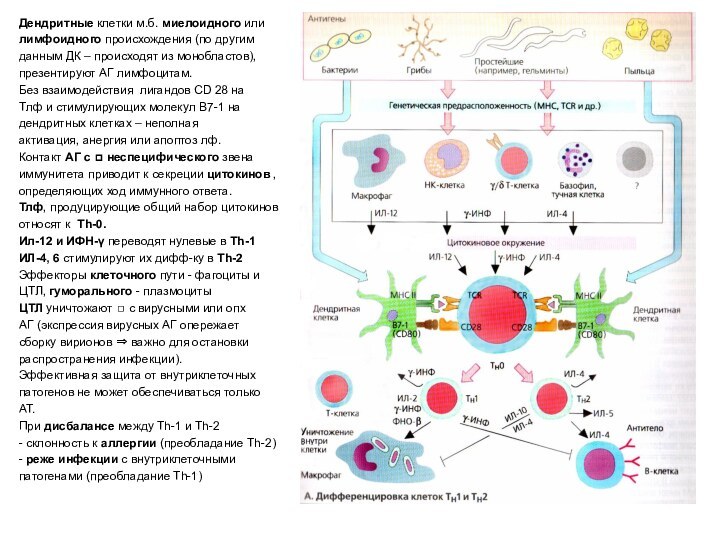
Дендритные клетки м.б. миелоидного или
лимфоидного происхождения (по
другим
данным ДК – происходят из монобластов),
презентируют АГ
лимфоцитам.
Без взаимодействия лигандов CD 28 на
Тлф и стимулирующих молекул B7-1 на
дендритных клетках – неполная
активация, анергия или апоптоз лф.
Контакт АГ с ◻ неспецифического звена
иммунитета приводит к секреции цитокинов ,
определяющих ход иммунного ответа.
Тлф, продуцирующие общий набор цитокинов
относят к Th-0.
Ил-12 и ИФН-γ переводят нулевые в Th-1
ИЛ-4, 6 стимулируют их дифф-ку в Th-2
Эффекторы клеточного пути - фагоциты и
ЦТЛ, гуморального - плазмоциты
ЦТЛ уничтожают ◻ с вирусными или опх
АГ (экспрессия вирусных АГ опережает
сборку вирионов ⇒ важно для остановки
распространения инфекции).
Эффективная защита от внутриклеточных
патогенов не может обеспечиваться только
АТ.
При дисбалансе между Th-1 и Th-2
- склонность к аллергии (преобладание Th-2)
- реже инфекции с внутриклеточными
патогенами (преобладание Th-1)
Слайд 43
Регуляция иммунного ответа
Внутрисистемная (или саморегуляция)
Печеночная
Нейро-эндокринная
Генетическая
См учебник.
Слайд 44
Регуляторные Т-клетки
Будучи частью популяции CD4+-Tлф, они поддерживают согласие
между иммунной системой и организмом, подавляя чрезмерную активность и
пролиферацию эффекторных лф.
Определяют реакцию иммунной системы на инфекцию, опухолевые клетки, трансплантат, клетки плода при наступлении беременности и т. д
Слайд 45
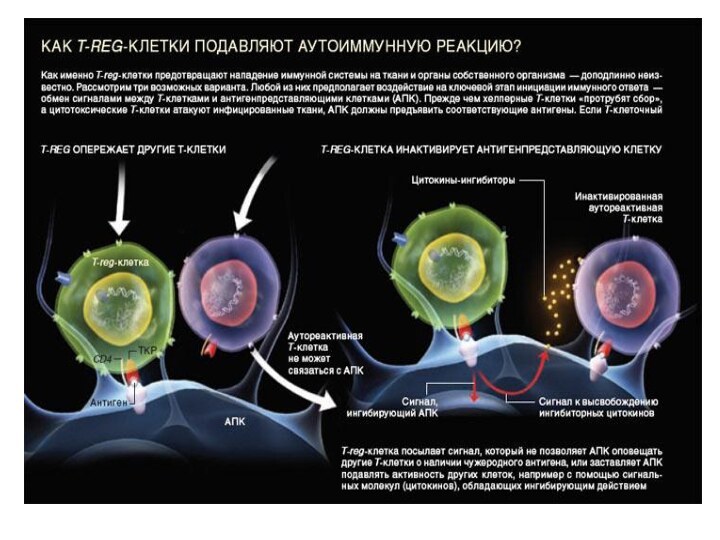
Свойства Т-reg
T-reg-клетки подавляют аутоиммунную реакцию,
улучшают иммунологическую память
и помогают организму, противостоять повторному заражению патогенными микробами,
защищают
от уничтожения полезные бактерии, населяющие кишечник.
способствуют нормальному протеканию беременности, причиной спонтанных абортов у некоторых женщин оказывается низкая активность T-reg-клеток.
Отрицательные свойства: помогают раковым клеткам избежать атаки со стороны иммунной системы.
Слайд 46
Свойства Т-reg
На поверхности данных клеток присутствуют молекулы CD25,
а внутри содержится много белка Foxp3, регулирующего работу определенных
генов и синтез кодируемых ими белков. Изменение экспрессии любого клеточного гена может повлиять на функционирование всей клетки.
Фактор Foxp3 перенастраивает клеточные гены таким образом, что Т-клетки превращаются в T-reg.
Слайд 47
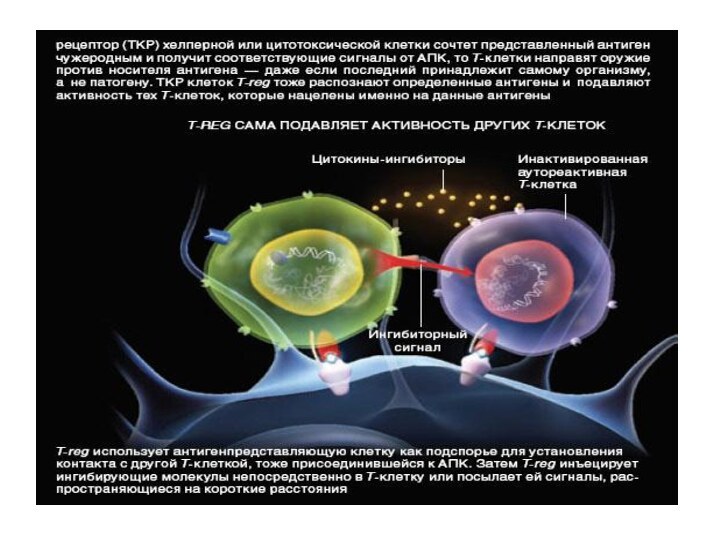
Механизм подавления аутоиммунной активности
T-reg,
блокируют амплификацию
клеток иммунной системы, секрецию сигнальных молекул – цитокинов.
иммунитета:
иммунодефицитные состояния,
аутоиммунные заболевания
аллергии.
Иммунодефициты -
состояния, обусловленные функциональной недостаточностью иммунной системы вследствие отсутствия или снижения уровня одного или нескольких факторов иммунитета.
Клинические проявления:
снижение резистентности к инфекциям,
доброкачественные или злокачественные
(лимфомы, лимфосаркомы) опухоли.
Слайд 51
Классификация иммунодефицитов
По происхождению:
Первичные (врожденные, или наследственные, часто
связаны с Х-хромосомой и наследуются мальчиками от матерей);
Вторичные (приобретенные).
По
локализации дефекта:
дефицит фагоцитов;
дефицит антител;
дефицит адгезивных молекул;
дефект NK клеток;
дефицит системы комплемента;
дефицит В-лф;
дефицит Т-лф;
комбинированные иммунодефициты.
Слайд 52
Вторичные иммунодефициты
Причины развития
1.Возраст. У младенцев и
стариков ослаблен гуморальный и клеточный иммунный ответ.
2.Нарушение питания -
недостаток белков, витаминов и минералов.
3.ИР - нарушает созревание клеток-предшественниц иммуноцитов.
4.Лекарственные препараты - можно создать любой иммунодефицит .
5.Инфекции. Иммуносупрессия – защитный механизм ряда инфекционных возбудителей, позволяющий им выживать и размножаться в агрессивной среде организма. Наиболее тяжелые вторичные иммунодефициты вызывают ВИЧ, вирусы герпеса.
7.Опухоли (болезнь Ходжкина, миелома, лейкозы). Однако спорным остается вопрос – иммунодефицит - это причина или следствие развития опх?
8.Внутриутробная гипоксия 1 и 2 триместров беременности (предположительный механизм – преимущественная эритроидная диф-ка СКК в ущерб лимфоидным клеткам; эритробласты м. ингибировать пролиферацию В-лф), известно, что стимуляция эритроидного ростка у взрослых также приводит к иммунодепрессии
Слайд 53
Аутоиммунные заболевания

обусловлены иммунным ответом на антигены собственных тканей
Основные механизмы развития аутореактивности:
1. Нарушение регуляции иммунитета при функциональной слабости Т-reg
2.Нарушение клональной делеции и активация сохранившихся аутореактивных В- и Т-клеток при инфицировании микроорганизмами, имеющими общие с хозяином (перекрестные) антигены Например – ревматизм – инфекционно-аллергическое поражение сердца и суставов как результат стрептококковой инфекции.
3.Поликлональная активация В-лф вирусами (мононуклеоза, гепатита).
4.Поступление в кровоток антигенов тканей, в норме изолированных от иммунной системы (мозг, хрусталик, щитовидная железа, тестикулы), например, при травме.
5.Молекулярная аномалия и связанная с этим выработка аутоантител. Например, ревматоидный артрит, когда вырабатываются аутоантитела к дефектному IgG (обнаружен дефект гликозилирования Fc фрагментов антител этого класса ⇒ аномальные молекулы образуют м/д собой конгломераты с сильными иммуногенными свойствами).
6.Представление антигена клетками, неспециализированными для этой функции. Примером является тиреоидит как результат аномальной экспрессии HLA - 2 на клетках щитовидной железы.
7. Уничтожение «своей» клетки, несущей чужеродные антигены (аг вирусов, лекарств).
Слайд 54
Проблемы гетерологичного иммунитета
После перенесенной инфекции образуются

◻ памяти, но они узнают не весь АГ, а
его эпитоп – небольшие пептиды. Ряд вирусов имеют сходные консервативные последовательности пептидов и Т ◻ памяти будут распознавать сходный вирус ⇒ гетерологичный иммунный ответ. При этом эффекторные клетки менее эффективны.
Тлф активируются раньше, чем Влф и выделяют множество цитокинов ⇒ повреждение самого организма.
+ пример: инфицирование людей, зараженных ВИЧ, но еще не имеющих клинических проявлений СПИДа, флавивирусом GBV-C (близким «родственником» гепатита С), во многих случаях предотвращает развитие СПИДа. Одно из вероятных объяснений состоит именно в изменении ответа активированных T-клеток на новую инфекцию. Вирус ВИЧ подавляет иммунную реакцию на себя, однако реакция на флавивирус может протекать нормально, и при наличии гетерологичного иммунитета это сказывается и на ВИЧ.
- пример при вакцинации - в отличие от живых вирусов, ответ на убитые вирусы или их части, имеющиеся в вакцинах, вызывают большую активацию T-х2, а не 1, как это происходит в естественной ситуации; увеличенное количество T-х 2 среди клеток памяти (а значит, их усиленная активация при реальной инфекции) приводит к ухудшению способности бороться с вирусом и, главное, склоняет иммунную систему в целом к аллергическим и, возможно, аутоиммунным реакциям.