Слайд 2
ПОНЯТИЕ ОБ ЭПИЛЕПСИИ
Эпилепсия – неврологическое заболевание (гетерогенный симптомокомплекс)
проявляющееся непредсказуемо повторяющимися судорожными припадками (приступами). Более 40 форм.
Распространенность
– 0,8-1% населения, второе по частоте неврологическое заболевание после инсульта.
Судорожный припадок – временное изменение поведения и сознания, вызванное патологическим синхронным ритмичным разрядом группы нейронов головного мозга.
Источник припадков при эпилепсии – кора головного мозга.
NB! ПСС подавляют судорожные припадки, но не препятствуют эпилептогенезу и не обладают профилактическим действием!
Слайд 3
Парциальные – эпилептическая активность исходит из участка коры
(очага).
Простые – сознание сохранено (минимальное распространение аномальных разрядов).
Сложные –
аномальные разряды захватывают долю (в пределах одного полушария, чаще височную) и лимбическую систему. Утрата или затемнение сознания в сочетании с нецеленаправленными движениями, моторные автоматизмы.
Вторично генерализованые.
Генерализованные – эпилептическая активность захватывает всю кору обоих полушарий.
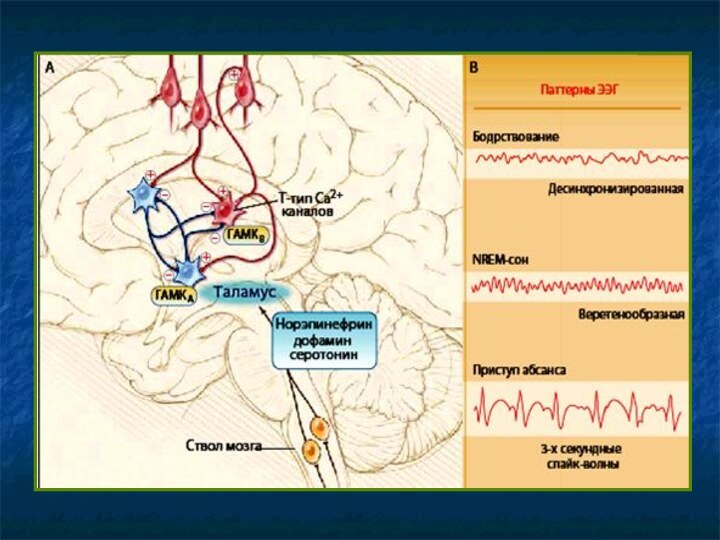
Абсанс (petit mal) – кратковременная утрата сознания (до 40 с) с последующей амнезией. Возникает в детстве, до 100-н раз/сут. ЭЭГ – характерные волны (ν=2,5-3,5 Гц).
Тонико-клонические (grand mal) – общее напряжение мышц (тоническая фаза) сменяется чередованием их сокращения и расслабления (клоническая фаза).
Миоклонические – резкие короткие (до 1 с) мышечные сокращения локальные или генерализованные.
КЛАССИФИКАЦИЯ СУДОРОГ
Слайд 4
ИСТОРИЯ ПСС
1857 г. – бромид калия (сэр Чарльз
Локок).
1912 г. – первое применение фенобарбитала.
1938 г. – моделирование
судорог электрическим разрядом – Мерритт и Патнам – открыт фенитоин – первый ПСС без седативного действия.
1935-1965 гг. – 13 новых ПСС (химически родственны фенобарбиталу – гидантоины, оксазолидиндионы, cукцинимиды).
1960-1990-е гг. – карбамазепин (1974), вальпроевая кислота (1978).
С 1990-х – новый скачок в создании ПСС – габапентин (1993), ламотригин (ламотриджин) (1994), фелбамат (1993), топирамат (1996), леветирацепам (1999), тиагабин (1998), зонисамид (2000).
Слайд 5
ПАТОГЕНЕЗ СУДОРОГ
Парциальные припадки – нейроны участка коры деполяризуются
и генерируют высокочастотные ПД, не возникающие в норме. Избирательное
их угнетение должно обеспечивать купирование судорог.
Цель – замедлить деинактивацию быстрых натриевых каналов нейрона → подавление высокочастотной импульсации и судорог.
NB! На низкочастотную импульсацию длительность инактивации существенно не влияет, с этим связана избирательность действия ПСС для лечения ПС – карбамазепина, ламотриджина, фенитоина, вальпроата.
Усиление активности ГАМК – подавление и ПС и ГТКС.
Слайд 6
Первично генерализованные припадки
Абсансы – реципрокное возбуждение коры и
таламуса. Характерна синхронность разрядов на обширном участке коры, которую
обеспечивает таламус (возможно + ствол мозга).
Док-во – низкочастотная стимуляция срединных структур таламуса вызывает корковые разряды пик – волна (спайк-волны, ν=3 Гц), типичные для абсансов (эквивалент на ЭЭГ).
Возникновение спайк-волн обеспечивается
Двусторонними возбуждающими импульсами кора – таламус.
Особыми свойствами нейронов таламуса – значительным входящим током Са2+ через каналы Т-типа – обеспечивает вспышки разрядов в нейронах и усиливает периодические таламические разряды.
NB! Торможение Са2+ тока через Т- каналы – основной механизм действия для ПСС эффективных при абсансах: этосуксимида, триметадиона, вальпроата.
Слайд 8
Общее свойство разных ПСС – подавление потенциалзависимых ионных
каналов:
при ПС – Na+-каналов,
при абсансах – Са2+-каналов.
Слайд 9
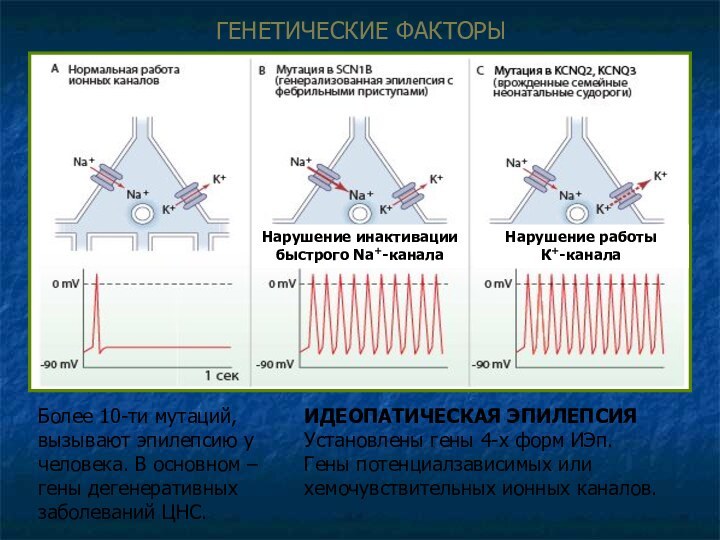
ГЕНЕТИЧЕСКИЕ ФAКТОРЫ
Более 10-ти мутаций, вызывают эпилепсию у человека.
В основном – гены дегенеративных заболеваний ЦНС.
ИДЕОПАТИЧЕСКАЯ ЭПИЛЕПСИЯ
Установлены гены
4-х форм ИЭп.
Гены потенциалзависимых или хемочувствительных ионных каналов.
Нарушение инактивации
быстрого Na+-канала
Нарушение работы
К+-канала
Слайд 11
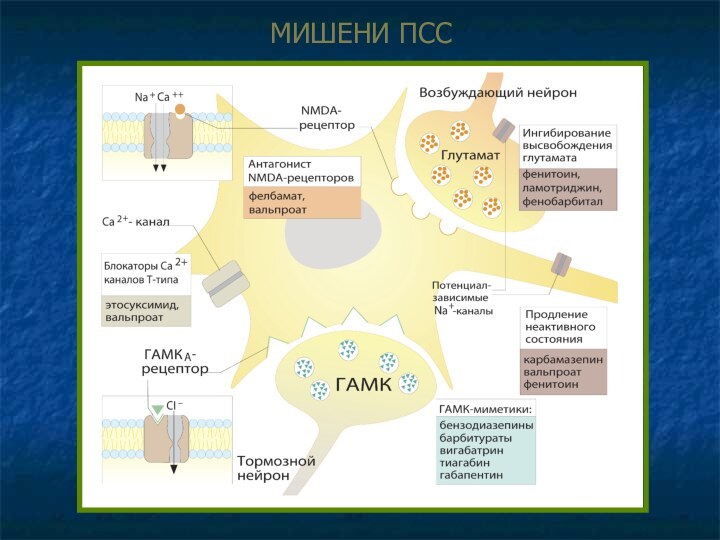
МЕХАНИЗМЫ ДЕЙСТВИЯ ПСС
Облегчение ингибиторной (ГАМК-зависимой) передачи (генерализованные и
парциальные судороги).
Прямое действие на комплекс ГАМКр-Cl¯- канал
Аллостерическое усиление эффектов
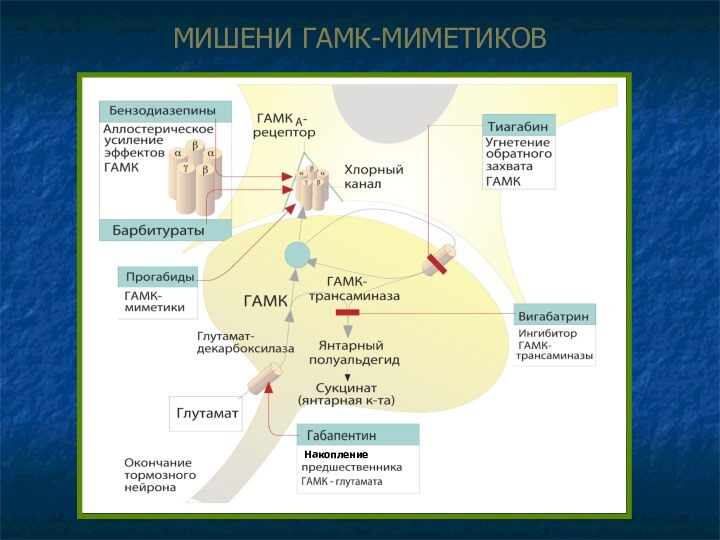
ГАМК – бензодиазепины, барбитураты.
Агонисты ГАМКр – прогабиды (топирамат).
Влияние на обратный захват и метаболизм ГАМК
Угнетение обратного захвата, увеличение концентрации в синаптической щели – тиагабин.
Ингибирование разрушения ГАМК, накопление в везикулах – вигабатрин.
Накопление предшественника ГАМК (глутамата) в нейроне, ускорение синтеза ГАМК – габапентин.
Слайд 12
МИШЕНИ ГАМК-МИМЕТИКОВ
Накопление
Слайд 13
Подавление возбуждающей (глутаматергической) передачи.
Блокада АМРА-рецепторов (ионотропных глутаматных р-ров,
чувствительных к действию альфа-амино-3-гидрокси-5-метил-4-изоксазол-пропионовой кислоты) – частично фенобарбитал и
топирамат.
Блокада NMDA-рецепторов (открывают Na+- и Са2+-токи в нейрон) – вальпроат, фелбамат, ремацемид (изучается).
Ингибирование высвобождения глутамата – фенитоин, ламотриджин, фенобарбитал.
Модификация ионных токов
Пролонгирование инактивации потенциал-зависимых Na+- каналов c увеличением рефрактерности – фенитоин, карбамазепин, ламотриджин, частично – фенобарбитал, вальпроат, топирамат. Итог – подаление быстрых, повторяющихся разрядов отдельных нейронов.
Угнетение низкопорогового Ca2+-тока (Т-типа) в таламических нейронах – этосуксимид, вальпроат, диметадион (абсансы).
МЕХАНИЗМЫ ДЕЙСТВИЯ ПСС
Слайд 14
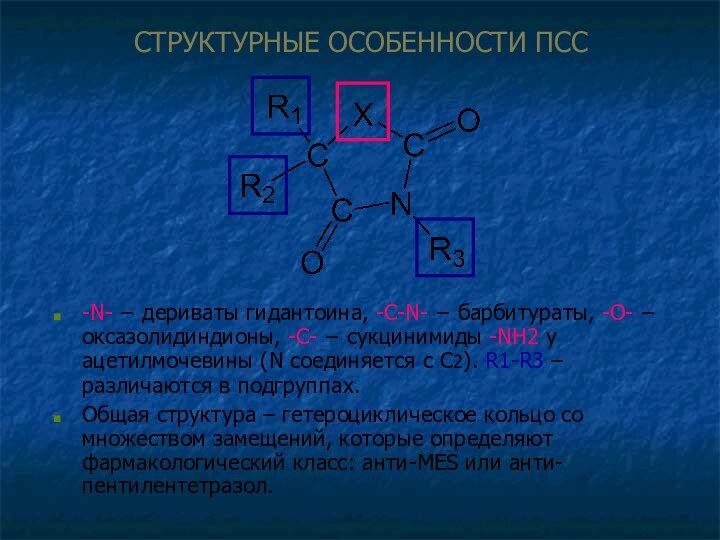
СТРУКТУРНЫЕ ОСОБЕННОСТИ ПСС
-N- − дериваты гидантоина, -C-N- −
барбитураты, -O- − оксазолидиндионы, -C- − сукцинимиды -NH2 у
ацетилмочевины (N соединяется с С2). R1-R3 – различаются в подгруппах.
Общая структура – гетероциклическое кольцо со множеством замещений, которые определяют фармакологический класс: анти-MES или анти-пентилентетразол.
Слайд 15
ФАРМАКОКИНЕТИКА ПСС
F = 80-99%.
Незначительно связываются с БПК. Исключение
– фенитоин, вальпроат (вытесняют др. ЛС), бензодиазепины (концентрации низки).
Распределение – жидкие среды.
Для большинства CL низкий.
Т1/2 ~ 12 ч (среднего и пролонгированного действия).
Метаболизм – печень, линейная кинетика, исключение – фенитоин (0-порядка в высоких дозах).
Фенобарбитал и карбамазепин – мощные индукторы микросомальных ферментов.
Выведение – печень, в т.ч. метаболиты; почки.
Слайд 16
ОСНОВЫ ПРОТИВОСУДОРОЖНОЙ ТЕРАПИИ
ПСС выбирают в зависимости от вида
припадка, а не от причины или формы эпилепсии.
Предпочтительна монотерапия.
Сочетают
ПСС с разными механизмами действия.
Подбор дозы или изменение схемы – определение [C] в плазме крови (ориентировочный характер).
Главный критерий – эффективность и переносимость.
Комплаентность!
Длительность лечения – годы, отмена – медленная (месяцы), при быстрой – синдром отмены.
Слайд 17
ФАРМАКОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ ПСС
Прямая зависимость [С] в плазме крови
– эффект.
ТИ для большинства ПСС низкий, часты токсические эффекты.
Вероятность
побочных эффектов ПСС – 15%.
Синдром отмены зависит от клинического течения эпилепсии и групповой принадлежности ЛС. Наиболее тяжелый – барбитураты, бензодиазепины (отмена месяцы).
Передозировка – респираторная депрессия, лечение – симптоматическое.
Тератогенность – риск пороков развития выше в 2 раза. Фенитоин – гидантоиновый синдром плода, вальпроат – spina bifida (риск – 1-2%). Беременным – снизить дозу ПСС до минимальной эффективной, уменьшить количество ПСС.
Слайд 18
ПАРЦИАЛЬНЫЕ И ГЕНЕРАЛИЗОВАННЫЕ
ТОНИКО-КЛОНИЧЕСКИЕ СУДОРОГИ
Фенитоин (проЛС для парентерального
применения – фосфенитоин).
Механизм действия:
[Cтер] – связывается с инактивированными Na+-каналами,
продлевает их инактивацию – блокирует продолжительные высокочастотные разряды ПД.
[Cвысокие] – снижение спонтанной импульсной активности, сенсибилизация к ГАМК, подавляет высвобождение серотонина и НА (нарушает Cа2+-токи в нейрон), усиливает захват дофамина, снижает активность МАО, стабилизирует мембраны.
Слайд 19
Фармакокинетика
Адсорбция зависит от ЛФ (перорально F – высокая,
в/м – преципитаты, только фосфенитоин!).
Кинетика элиминация – зависит от
дозы.
При [C] < 10 мкг/мл – Т1/2=12-24 ч, Сss достигается ч/з 5-7 сут.
При высоких [C] возрастает Т1/2 (кинетика 0-порядка), достижение Сss – 4-6 недель.
ВД – 300 мг/сут, разовое увеличение дозы не более 25-30 мг через ∆Т= 5 Т1/2.
NB! Между дозой и сывороточной концентрацией нет линейной зависимости даже в терапевтическом диапазоне.
NB! Даже при минимальном увеличении дозы возможны токсические эффекты.
Метаболизм – печень, выведение – почки.
Применение – ПС и Г (первично и вторично) ТКС.
Побочные эффекты:
Нистагм, диплопия и атаксия.
Гипертрихоз и гиперплазия десен.
Периферическая нейропатия.
Гематологические нарушения – анемии или нейтропении.
Слайд 20
Карбамазепин
Механизм действия – похож на фенитоин.
Применение – ЛС
выбора при ПС, начальная терапия ГТКС. В терапевтических дозах
седации не вызывает.
Другие показания – МДП, невралгия тройничного нерва.
Фармакокинетика
Высокая F, Сmax через 6-8 ч.
Vd = 1 л/кг, связывание с БПК ~ 70%, СL = 1 л/кг/сут.
Индуцирует микросомальные ферменты печени (IIIA4 цит.Р450) → Т1/2 начальный = 36 ч затем 20 ч и менее.
Полностью метаболизируется, в т.ч. в активные метаболиты.
Выведение – почки.
Побочные эффекты – см. фенитоин.
Слайд 21
Фенобарбитал – производное барбитуровой кислоты (рКа=7,4).
ЛС выбора для
грудных детей.
Механизм действия:
Аллостерическое усиление эффектов ГАМК (увеличивает время открытия
Cl-канала).
Ингибирование высвобождения глутамата.
Селективно подавляет активность аномальных нейронов, блокируя высокочастотные повторяющиеся разряды за счет блокады Na+ и Са2+ (L- и N-типы) токов (высокие [C]).
Фармакокинетика
Высокая F.
Выведение -- ¼ с мочой (зависит от рН), остальное метаболизируется в печени – индуцирует глюкуронилтрансферазы, а также изоферменты подсемейств IIC и IIIA цит. Р450.
Применение – ПС и ГТКС.
Побочные эффекты:
Сонливость (быстро толерантность).
Нистагм, атаксия, парадоксальное возбуждение.
Слайд 22
Вигабатрин
Механизм действия:
Необратимо ингибирует ГАМК-аминотрансферазу, повышает синаптическую концентрацию ГАМК.
Фармакокинетика
Высокая
F, Т1/2=6-8 ч.
Выведение -- кинетика линейная, с мочой (неактивные
метаболиты).
Применение – ПС.
Токсичность:
Сонливость, головокружение, прибавка в весе.
Психозы.
Длительное применение – необратимое сужение полей зрения (30%).
Слайд 23
Ламотриджин
Механизм действия:
Подавляет фоновые (повторяющиеся) быстрые разряды в нейронах
за счет инактивации Na+-каналов.
Возможно блокирует потенциал-зависимые Са2+-каналы.
Фармакокинетика
Высокая F,
Vd=1-1,4 л/кг, Т1/2=24 ч.
Выведение – кинетика линейная, метаболизируется за счет глюкуронизации, с мочой.
Применение – ПС.
Побочные эффекты:
Сонливость, диплопия, головная боль.
Кожные сыпи.
Слайд 24
ГЕНЕРАЛИЗОВАННЫЕ СУДОРОГИ
Этосуксимид – средство выбора при абсансе.
Механизм действия:
Снижает
низкопороговые токи Са2+ (Т-типа), которые в таламических нейронах играют
роль водителей ритма, генерируя ритмические корковые импульсы абсанса.
Фармакокинетика
Высокая F, Vd=0,7 л/кг (не проникает в жировую ткань), не связывается с БПК, Т1/2=40 ч.
Выведение – кинетика линейная, CL=0,25 л/кг/сут., метаболизируется гидроксилированием, с мочой.
Применение – абсанс.
Побочные эффекты:
Раздражение ЖКТ.
Сонливость, головная боль.
Слайд 25
Вальпроат натрия и вальпроевая кислота
Механизм действия (предполагаемый):
Блокирует высокочастотные
повторяющиеся разряды нейронов за счет блокады Na+- токов.
Увеличивает содержание
ГАМК (ингибирует ГАМК-Т) (высок.[C]).
Увеличивает проводимость для К+.
Фармакокинетика
Высокая F, рКа=4,7 (в крови ионизирован), на 90% связывается с БПК, Vd=0,15 л/кг, Т1/2=9-18 ч.
Выведение – кинетика линейная, при высоких концентрациях – 0-порядка, метаболизируется.
Применение
Абсанс при генерализации судорог (ЛС выбора), миоклонус, ГТКС и атонические С, иногда ПС.
Другие – МДП, профилактика приступов мигрени.
Подавляет метаболизм фенитоина, карбамазепина, фенобарбитала.
Побочные эффекты:
Раздражение ЖКТ.
Сонливость, тремор, аллопеция, стимуляция аппетита.
Гепатотоксичность.
Слайд 26
Бензодиазепины
Диазепам, Лоразепам – эпилептический статус.
Клоназепам – абсанс, миоклонус.
Клоразепат
– ПС, Нитразепам – миоклонус.
NB!
Выраженное седативное действие.
Толерантность.
Мишень – бензодиазепиновый
ГАМК-рецептор.
Фармакокинетика – хорошо всасываются, распределяются, интенсивно метаболизируются с образованием множества активных метаболитов, Т1/2=20-40 ч.
Слайд 27
СРЕДСТВА КУПИРОВАНИЯ ЭПИЛЕПТИЧЕСКОГО СТАТУСА
ПСС вводят только в/в (не
в/м!).
Варианты начального лечения:
Диазепам – в/в до 20-30 мг, продолжительность
действия – 30-40 мин (угнетает дыхание), затем фенитоин.
Только фенитоин в ВД = 13-18 мг/кг со скоростью не более 50 мг/мин, в/в, медленно на физрастворе (не глюкозе!) или фосфенитоин (ниже активность на 25-30%, ниже риски).
Лоразепам – действует длительнее диазепама.
При неэффективности – фенобарбитал по 100-200 мг в/в до 400-800 мг. Осложнение – респираторная депрессия.
Резистентность – общая анестезия.
Эффективность – 44-65%.
Слайд 28
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ БОЛЕЗНЕЙ
Слайд 29
ДЕГЕНЕРАТИВНЫЕ БОЛЕЗНИ ЦНС
Характеризуются прогрессирующей и необратимой гибелью нейронов
в определенных отделах головного и спинного мозга.
Гибель нейронов
базальных ядер – нарушения движения.
Болезнь Паркинсона.
Болезнь Гентингтона.
Гибель нейронов коры и гипокампа – когнитивные расстройства.
Болезнь Альцгеймера.
Гибель спинальных, стволовых, корковых мотонейронов – мышечная слабость.
Боковой амиотрофический склероз.
NB! Фармакотерапия только симптоматическая, на течение не влияет
Слайд 30
ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ НДБ
Избирательность поражения.
Генетическая детерминированность.
Б-нь Гентингтона – аутосомно-доминантное
наследование.
Другие – не доказана.
Нейротоксическое действие возбуждающих медиаторов.
Нейротоксические эффекты глутамата
с уровня NMDA-рецепторов (избыточный вход Ca2+).
Энергетический обмен и возраст.
Свободнорадикальное окисление.
Слайд 31
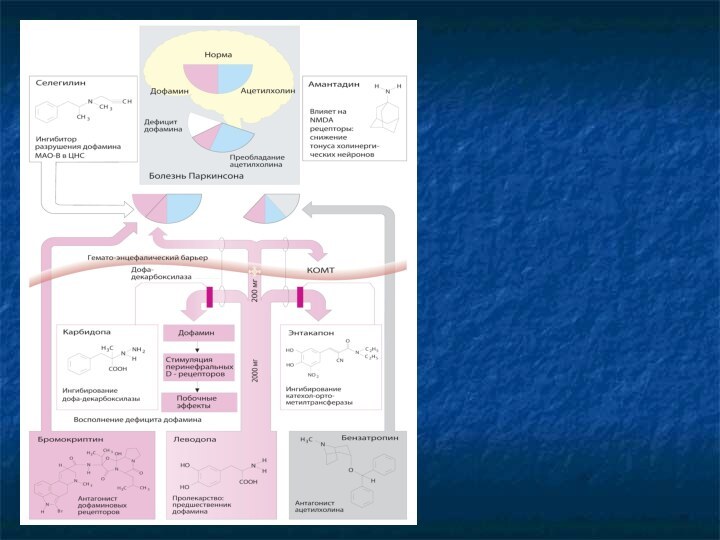
БОЛЕЗНЬ ПАРКИНСОНА
Паркинсонизм – синдром (описан в 1817 г.
Джеймсом Паркинсоном), который складывается из 4-х характерных признаков:
Гипокинезия (замедление
и бедность движений)
Ригидность (повышенный мышечный тонус)
Тремор покоя
Расстройства постуральных рефлексов (нарушения походки и равновесия)
Без лечения быстро прогрессирует (5-10 лет – тяжелая инвалидность).
Патогенез – гибель дофаминергических нейронов компактной части черной субстанции, посылающих импульсацию к стриатуму (хвостатому ядру и скорлупе).
Главная a-wbz стриопаллидарной системы – коррекция команд, поступающих от коры головного мозга к спинальным мотонейронам.











![Противосудорожные средства ФАРМАКОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ ПССПрямая зависимость [С] в плазме крови – эффект.ТИ для большинства](/img/tmb/15/1477828/0165e5c96c31e6f47ef5ec582d80e9ea-720x.jpg)