Слайд 2
Биологиялық жүйелерге ИС әсер еткенде пайда болатын өзгерістер

радиобиологиялық эффекттер деп аталады. Организмнің биологиялық жүйе ретіндегі күрделілігі
радиобиологиялық эффекттердің әртүрлілігін анықтайды. Олардың жіктемесінің критерийлеріне қалыптасу деңгейі, пайда болу мерзімі, орналасуы, сәулелену дозасымен байланыс сипаты, сәулеленген организм үшін маңызы, тұқым қуалау мүмкіндігі және басқалары жатады.
1.1. Радиобиологиялық эффекттердің жіктемесі
1.1.1. Қалыптасу деңгейі. Молекулярлық деңгейде биожүйелердің сәулеленуі биомолекулалардың сәуленің өзімен немесе судың радиолиз өнімімен әрекеттесу нәтижесіндегі өзгерістер жиынын шақырады. Мұндай өзгерістерге алшақтау, тігістер, биополимер молекулаларында мономер тізбектілігінің өзгеруі, олардың фрагменттерді жоғалтуы, тотықтырғыш модификациясы, басқа молекулалармен аномалиялық химиялық байланыстың түзілуі жатады. зақымданған биомолекулалардың үлесі олардың молекулярлы массасымен оң байланысты. Мысалы, 10 Гр дозада сәулеленгеннен кейін жасушада олигосахаридтер молекулаларының 0,015%, 0,36% - аминқышқылы, 1% - ақуыз және 100% нуклеин қышқылы зақымданған болып шығады.
Слайд 3
ДНК осалдығымен және генетикалық матрица ролімен биожүйенің аса
жоғары иерархиялық деңгейінде қалыптасатын, радиобиологиялық эффекттердің негізі ретінде ДНК
зақымдануының жетекші ролі байланысты. Митоз кезінде жасушада ДНК зақымдануы хромосомалық аберрациямен көрінеді, олардың негізгі түрлері хромосома фрагментациясы, хромосомалық көпірлердің, дицентриктер, сақиналы хромосомалар, ішілік- және хромосомааралық алмасулардың қалыптасуы болып табылады. Бірақ көптеген жасушалар сәулеленуден соң митозға және хромосомалық аберрацияға дейін өледі.
Жасушалық деңгейде ИС әсері жасушалардың интерфазалық немесе репродуктивтік өлімін, митоздың уақытша блокталуын және летальді емес мутацияны шақырады.
Жүйелік деңгейде ИС әсері цитопениялық эффектпен сипатталады оның негізінде жасушалардың өлімі және митоздың радиациялық блогы жатыр.
Организм және популяция деңгейінде туындайтын радиобиологиялық эффекттер төменде аталған критерилерге сәйкес жіктелінеді.
Слайд 4
1.1.2. Пайда болу мерзімі
Осы белгі бойынша организмде және

популяцияда туындайтын радиобиологилық эффекттер жақын және алыс деп бөлінеді.
Жақындағы эффекттер сәулеленуден соң бірнеше айдан кеінігі мерзімде көрінеді организмнің әртүрлі тіндік жүйесінде цитопениялық жағдайдың дамуымен байланысты. Жедел сәулелік реакция, жедел сәулелік ауру, сәулелік алопеция, сәулелік дерматит жақындағы эффекттерге мысал бола алады.
Алыстаған эффекттер сәулеленуден жылдар өткеннен кейін, жедел зақымданудың негізгі клиникалық белгілерінің толық регрессиясы көрінісінде пайда болады. Сәулеленумен себептік байланысына қарамастан, алыстаған радиобиологиялық эффекттер радиациялық әсерге спецификалық болып табылмайды – бұл патология сәулелік емес факторлармен де шақырылады. Сәулеленудің алыстаған зардаптарына ісіктер, гемобластоздар, гипопластикалық, дистрофиялық, склероздық үрдістер мысал болып табылады. оцессы. Бұл салдарлардың интегральді көріністері организмнің өмір сүру ұзақтығының қысқаруы болып табылады. Сүтқоректілердің сыртқы жалпы бір ретті сәулеленуі жағдайында бұл эффект әрбір грейге орташа түрлік өмір сүру ұзақтығының 2-6% құрайды, алайда сәулеленудің аз дозасында (4-15 сГр –ден төмен) ол көрінбейді.
Слайд 5
1.1.3. Локализация
Радиобиологиялық эффекттер олар тіркелетін ағза немесе дене

мүшесіне қарай жіктелуі мүмкін. Мұндай жіктеу сау тіндерді мұқият
қалқалаумен ісікке шалдыққан дененің аймағы жоғары дозада сәулеленгенде, онкологиялық ауруларды емдеу тәжірибесінде аса өзекті. Ағзаның немесе дене сегментінің жергілікті сәулеленуінде ИС зақымдаушы әсері дәл осы жерде күштірек көрінеді (мұндай эффект ИС жергілікті әсері деп аталады). Бірақ өзгерістер сәулеленбеген тіндерде де дамиды. Мұндай жағдайда ИС дистанционды әсері туралы айтады. Оған сәулеленгеннен кейін қалқаланған қол-аяқтың сүйек кемігінде миелокариоциттер санының азаюы мысал бола алады. Бұл эффект сәулеленуге ұшыраған қан түзу тінінің бос қалған аймақтарына формалық элементтердің миграциясынан, сәулеленгенене қалқаланған тіндерге қанмен келетін «радиотоксиндермен», подавлением митоздық белсенділіктің тежелуінен, физиологиялық стресстен болады. Осы факторлар сәулелену аймағындағы тіндерге де әсер етеді, бірақ мұнда ИС тікелей әсері басым болады.
Слайд 6
ИС жергілікті әсері жақындағымен бірге, алыстаған радиобиологиялық эффекттер
туындауында маңызды болып келеді. Сол себепті, канцерогенді эффекттің қаупін
бағалау үшін әрбір ағзаға арналған шамасы 1–ден төмен өлшеуші коэффициент бар. Ағзаның сәулеленуінің эквиваленттік дозасын оған сәйкес өлшеуші коэффициентке көбейту арқылы ағзаның сәулеленуінің эффективті дозасын алады. Сәулеленуге ұшыраған ағзаларға эффективті дозаларын қосып, организмнің біркелкі емес сәулеленунің эффективті дозасын алады. Соңғысы организмнің біркелкі емес сәулеленунің эквиваленттік дозасына тең.
1.1.4. Сәулелену дозасымен байланыс сипаты
Бұл критерий бойынша радиобиологиялық эффекттер стохастикалық (ықтимал) және стохастикалық емес (детерминиленген) болып бөлінеді.
Слайд 7
Стохастикалық эффекттің белгілері (1) табалдырықсыздық және (2) альтернативті

сипат болып табылады. Стохастикалық эффекттің табалдырықсыздығы сәулеленудің қанша болса
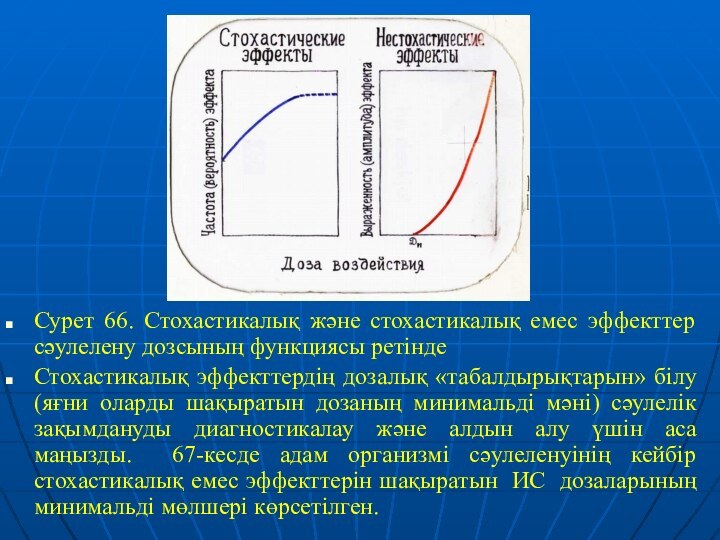
да аз дозасы олардың пайда болу жиілігіне әсер ете алады дегенді білдіреді. Альтернативті сипаты стохастикалық эффекттер «барлығы немесе ештеңе» заңына бағына отырып, «айқындылық» сияқты көрсеткішпен сипаттала алмайтындығында көрінеді. Стохастикалық эффекттің мысалы жасушалық деңгейде жасушаның өлімі бола алады; организм деңгейінде – қатерлі ісіктің дамуы. Сәулелену дозасының өсуімен бірге, стохастикалық эффекттің пайда болу мүмкіндігі артады (сурет 66, солдан), бірақ оның сапасы өзгеріссіз қалады. Біршама үлкен дозада сәулеленген организмдердің бір бөлігі оларда сәйкес стохастикалық эффекттің дамуына дейін өледі, бұл графиктегі пунктирмен көрсетілген «үстіртті» түсіндіреді.
Стохастикалық емес эффекттің белгілері (1) табалдырықтық сипат және (2) амплитуданың сәулелену дозасымен градиенттік байланысы болып табылады. Егер сәулелену дозасы табалдырықтық шамадан (Дп) артық болса, онда стохастикалық емес эффект 100% мүмкіндікпен туындайды, оған қоса оның амплитудасы дозаның артуымен бірге біркелкі өседі. (сурет 66, оңнан).
Слайд 8
Сурет 66. Стохастикалық және стохастикалық емес эффекттер сәулелену
дозсының функциясы ретінде
Стохастикалық эффекттердің дозалық «табалдырықтарын» білу (яғни оларды
шақыратын дозаның минимальді мәні) сәулелік зақымдануды диагностикалау және алдын алу үшін аса маңызды. 67-кесде адам организмі сәулеленуінің кейбір стохастикалық емес эффекттерін шақыратын ИС дозаларының минимальді мөлшері көрсетілген.
Слайд 9
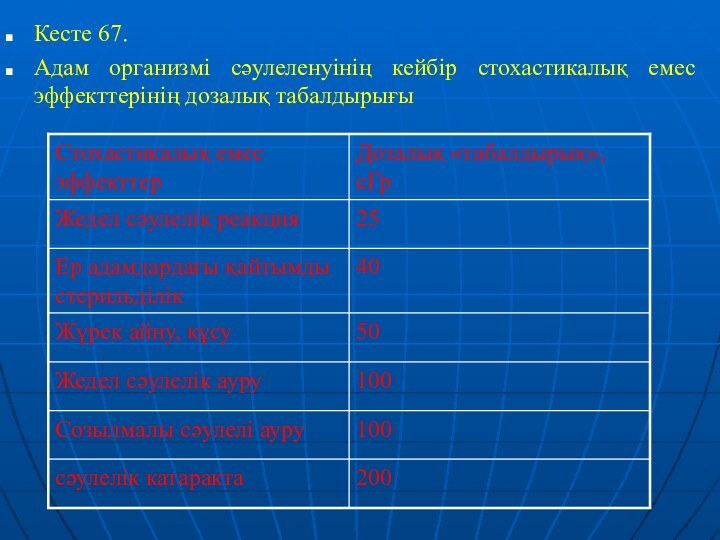
Кесте 67.
Адам организмі сәулеленуінің кейбір стохастикалық емес
эффекттерінің дозалық табалдырығы
Слайд 10
1.1.5. Сәулеленген организм тағдыры үшін маңызы
Радиобиологиялық эффекттер биологиялық

объектке жағымсыз түрде әсер етеді. Бұл ережеден айрықшылық горметикалық
эффект болып табылады. Радиациялық гормезис аз дозада сәуленуінің әсерінен организмнің өмірге бейімділігінің артуымен көрінеді. Мұндай феноменнің мүмкіндігі туралы келесі фактылер қарастырылады.
Тұқымдарды өсу энергиясы және өнгіштігі оларды егіс алдында сәулеленуінен жоғарылауы мүмкін.
Жануарларды табиғи радиациялық ортадан оқшаулау жағдайында өсіру бақылау деңгейіне қатысты бейспецификалық резистенттіліктің төмендеуімен жүреді.
Табиғи радиациялық ортаның жоғары деңгейі (жылына 175 мЗв дейін) бар территория тұрғындарында бақылау популяциясына қарағанда, жоғары ісіктік аурушаңдылық байқалмайды. Өйткені аурушаңдылықтың жоғарылауы жоғары деңгейде сәулеленумен байланысты, ол ИС канцерогенді әсерінің табалдырықсыздығы туралы гипотезадан шығады, бұл фактты организмнің бейспецификалық резистенттілігіне ИС аз дозасының стимулдеуші әсері (горметикалық эффект) жорамалынсыз түсіндіру мүмкін емес.
Слайд 11
Организмнің аз дозада сәулеленуімен болатын, радонды ванна қабылдау
организмнің функционалды жағдайына және резистенттілігіне оң әсер етеді.
Горметикалық
эффекттің шындылығын барлық мамандар мойындамайды. Келесі ұрпаққа тұқым арқылы берілу мүмкіндігі. Адам организмінің жасушаларының генетикалық аппаратындағы өзгерістер ұрпақпен берілуі мүмкін, егер бұл өзгерістер жыныс жасушаларында пайда болған жағдайда ғана болады. Соматикалық жасушалардың мутациялары клеток табиғи жағдайда тұқым қуаламайды (организмді клондау кезінде мүмкін). Сондықтан соматикалық (соматикалық жасушаларда туындайтын) және генетикалық (ИС жыныс жасушаларына әсер етуі нәтижесінде) радиобиологиялық эффекттерді ажырату аса маңызды. Организмнің жалпы сәулеленуінде соматикалық және генетикалық эффекттердің де пайда болуын күтуге болады.
Слайд 12
Сәулеленудің барлық генетикалық эффекттері туа пайда болған белгілер
түрінде көрінеді. Сонымен қатар, туа пайда болған белгілердің барлығы
дерлік сәулеленудің генетикалық эффекттері болып табылмайды. Жапониядағы атомдық бомбалу кезінде ұрықталуға дейін сәулеленген ата-аналардың балаларын бақылауда туа пайда болған ақаулар жиілігінің аса жоғарылауын анықталмады. Сонымен бірге, эмбрион немесе ұрыққа сәулелік әсердің дозасы бойынша тең жағдайында мұндай ақаулардың қаупі өте жоғары – әсіресе жүктіліктің 8-ден 15-ші аптасындағы мерзімдегі жүкті әйелдің сәулеленуі кезінде. Соңғы жағдайында туа пайда болған өзгерістер ұрық сәулеленуінің генетикалық емес, соматикалық эффекті нәтижесінде болады.
Слайд 13
1.2. 2.Сұрақ. иондаушы сәуле әсер етуінде биологиялық сатының
бастапқы кезеңдері. Сәулеленуге жасушалардың реакциясы.
1.2.1. Сәуле әсерінің бірінші сатысы
Иондаушы сәуленің биологиялық объектке әсіренде бірнеше кезеңді ажыратады.
Физикалық үрдістер сатысында биологиялық молекулалар құралатын қайсыбір атоммен энергияның жұтылу мүмкіндігі бірдей болғандықтан, затта кездейсоқ таралған, иондалған және қозған атомдар және молекулалар түзіледі.
Физико-химиялық құбылыстар сатысында жұтылған энергия макромолекулярлық құрылымдармен орын ауыстырады және жеке биомолекулалар арасында таралады, бұл химиялық байлансытардың олардың беріктігі төмен жерлерде үзілуімен байланысты. Сондықтан, физикалық сатыда әртүрлі молекулярлық құрылымдармен энергияның жұтылуы таңдаулы емес болғанымен, физико-химиялық сатының аяғында байланыстардың үзілуі белгілі бір құрылымдарда басым анықталады.
Слайд 14
Ақуыздық молекулаларда бұл қосарланған арильді радикалдардан тұратын аминқышқылдары

(мысалы, триптофан), тиолды және дисульфидті топтар; нуклеин қышқылдарында –
бұл азотты (ең алдымен, пиримидиндік) негіздер. Химиялық байланыстардың үзілісі өте жоғары химиялық белсенділікпен ерекшеленетін бос радикалдардың түзілуіне әкеледі.
Химиялық саты кезінде түзілген бос радикалдар өзара және басқа молекулалармен химиялық реакцияға түседі.
Аталған эффекттер ақуыздардың макромолекулаларымен, нуклеопротеидтердің, жасушаішілік мембрана құрылымдарымен энергия жұтылуының нәтижесі болуы мүмкін. Мұндай жағдайда сәулелердің тікелей әсері туралы айтылады. Сәулелер энергиясы радиолизге ұшырайтын су молекулаларымен де жұтылуы мүмкін. Су радиолизінің химиялық жоғары белсенді өнімдерімен биомолекулалардың зақымдалуы сәуленің тікелей емес әсері деп аталады.
Қарастырылған сәулелер әсерінің кезеңдері біріншілік деп аталады. Олар өте қысқа уақыт аралығында (шамамен 1 миллисекунд) жүзеге асады, және тірі, тірі емес материяға да сәулелер әсері үшін ортақ болып табылады.
Слайд 15
Биологиялық кезеңді екіншілік радиобиологиялық эффекттер құрайды, олар барлық
ұйымдастырылу дейгейінде байқалады, біршама ұзақ уақытты алады және кейде
өмір бойы созылады (кесте. 68).
Кесте 68.
Биологиялық жүйеге сәуле әсер етуінің негізгі сатылары
Слайд 17
1.2.2. Биожүйелердің сәулелік зақымдануының молекулярлық механизмдері
Сәуле әсерінің алғашқы
кезеңінде зақымдалған кіші мөлшерлі молекулалардың салыстырмалы саны зор емес.
10 Гр дозада сәулеленуде(сүтқоректілер үшін абсолютті летальді доза) жасушадағы молекулалар санының зақымдалған бөлігі көмірсулар үшін 0,015%, нуклеотидтерге - 0,023%, аминоқышқылдарына - 0,36% құрайды. Жасушадағы молекулалар зақымдалуының осындай көп емес саны жасуша тіршілік әрекетіне әсер ете алмайды. Егер бұл кіші молекулалар полимерлі қосылыстартардың компоненттері болса, олардың салыстырмалы зақымдануы одан да аз болып шығады. Бірақ, бір макромолекулаға есебінде, молекулярлық массасы үлкен полимерлерде зақымданғандардың саны айтарлықтай көп болуы мүмкін. Ақуыздар ерітіндісінде олардың осындай дозада сәулеленуінде 100 молекулаға 1 зақымданудан келеді, ал ДНК молекуласында (МВ - 6.106 дапьтон) - 1 молекулаға 220. ДНК әрбір молекуласында шамамен 10 нуклеотид зақымданады.
Слайд 18
Сәулеленген жасушада биологиялық маңызды ДНК өзгеруі болып табылады.

Бұл ДНК тізбегінің бір және екі үзілісінің негізінде жатқан
зақымданулар: пуриндік және пиримидиндік негіздердің химиялық модификациясы, олардың ДНК тізбегінен ажырауы, макромолекулада фосфоэфирлік байланыстың бұзылысы, дезоксирибозаның ыдырауы. Одан басқа, екіншілік радикалдармен және ферменттермен шабуыл кезінде ДНК осалдығын жоғарылататын, ДНК-мембранды комплекстің зақымдануы, ДНК-ақуыз байланысының бұзылуы, ДНК-ДНК және ДНК-ақуыз жалғауы, бұл биополимердің екіншілік, үшіншілік және төртіншілік құрылымының бұзылуы байқалады.
Липидті фракцияда оттегі қатысуында босрадикалды үрдістердің белсенуі нәтижесінде перекисьтік тотығу өнімдері, бірінші кезекте перикисьтер және қанықпаған май қышқылдарының гидроперекисьтері жинақталады. Бірқатар жағдайда липидтердегі тотықтырғыш үрдістер тізбектік сипат қабылдауы Липидтер жасушаішілік мембрананың құрылымдық компоненттері болып табылады, және олардың зақымдануы жасушада метаболизмдік үрдістердің бұзылуына әкеледі, сәулелік зақымданудың патогенезінде маңызды орын алады.
Слайд 19
Липидтердің перекиьтік тотығуының кейбір өнімдерінің (гидроперекисьтер, перекись, эпоксид,

альдегид, кетондар) айқын радиомиметикалық қасиеттері бар: олардың әсерінен жасушада
көп жағынан сәулеленудің өзімен шақырылатынға ұқсас зақымдану пайда болады. мұндай өнімдер біріншілік радиотоксиндер деген атау алды. Липидті радиотоксиндер жасуша ішілік мембрана қасиетін, олардың өткізгіштігін өзгертеді, ферменттердің босап шығуына әкеледі. Олар биохимиялық үрдістердің реттелуін бұзады, жасушаның ультрақұрылымының терең бұзылысын шақырады.
Липидтердің перекисьтік тотығу үрдісінің белсенуіне жасушаның өзіндік тотығуға қарсы жүйесінің белсендігінің төмендеуі әсер етеді. Бұл жасушада бірінші кезекте фосфолипидтер болып табылатын, антитотықтырғыштардың радиациялық зақымдануы себебінен болады, сондай-ақ тізбектік тотығу реакциясының белсенуі нәтижесінде фосфолипидтердің бұзылуы да орын алады.
Біріншілік радиотоксиндерге, сонымен бірге, сәулеленген жасушада түзілетін тотығу өнімдері фенол – хинондар және семихинондар жатқызылады.
Слайд 20
Өзгерістер жасушаның басқа да молекулярлы компоненттерінде анықталады. Азотты
негіздердің бұзылуы және РНК тізбегінің үзілуі, мукополисахаридтердің, негізінен, гиалурон
қышқылының ыдырауы, ферменттердің біріншілік (вследствие избирательного поражения отдельных аминокислот) және екіншілік құрылымдарының бұзылуы, олардың функционалдық қасиеттерінің және химиялық сипатының өзгеруі т.б. байқалады.
1.3. Сәулеленуге жасушалардың реакциясы
Жасушалар өмірдің негізгі ұяшықтары болып табылады, оларда зақымдануға әкелетін, кейін биологиялық ұйымдастырылудың одан жоғары – тіндік, ағзалық, жүйелік, организмдік деңгейлерінде көрінетін, сәулелік әсердің бастапқы эффекттері қалыптасады. Сондықтан радиобиологияда сәулеленуден кейін жасушада дамитын үрдістерге ерекше көңіл бөлінеді.
Слайд 21
Тірі жасушада әрқашан жеке жасуша ішілік құрылымдар арасында,
сыртқы ортадан зат алмасу жүзеге асады. Иондаушы сәуле әсерінің
бастапқы сатысында пайда болатын молекулярлы бұзылыстар зақымданған құрылымдар қатысуымен жүзеге асатын алмасу үрдістерінің барысын өзгертеді. Өйткені жасушаның белгілі бір молекулярлы құрылымдарындағы біріншілік зақымданудың сипаты және орналасуы, онымен байланысты метаболизм өзгерістері де алуан түрлі.
Метаболизмдік үрдістердің бұзылысы, өз кезегінде, жасушада молекулярлық зақымданудың айқындылығының жоғарылауына әкеледі. Бұл феномен біріншілік радиациялық зақымданудың "биологиялық күшеюі" деп аталады. Бірақ, сонымен қатар, жасушада репарациялық үрдістер де дамиды, оның салдары құрылмдардың және функциялардың толық немесе жартылай қалпына келуі болып табылады.
Слайд 22
1.3.1. Радиациялық зақымданудың биологиялық күшеюі
Сәулеленген жасуша тағдыры үшін
нуклеин алмасуы, ақуыз алмасуының, тотығу фосфорланудың өзгерістері маңызды.
Сәулеленуден
кейін бірден бөлінуші жасушаларда ДНК синтезі баяулайды. Эндо- және экзонуклеазалар белсенеді, нәтижесінде ядролық ДНК молекулаларының ферменттік гидролизі жоғарылайды; жасуша ішілік мембрана өткізгіштігінің жоғарылауы ферменттердің ядроішілік кеңістікке келіп түсуіне септігін тигізеді, ферменттік шабуылдың ядролық ДНК-ға әсер ету мүмкіндігін жоғарылатады. ДНК ыдырауы тіндерде полидезоксинуклеотидтердің жоғарылауына әкеледі. Сәулеленгендердің қанында және зәрінде нуклеотидтер және олардың ыдырау өнімдері – азотты негіздер, нуклеозидтер, зәр қышқылы мөлшері жоғарылайды.
РНК синтезі ДНК-ға қарағанда, аз дәрежеде төмендейді. РНК синтезі бұзылысы ДНК матрицалық құрылымдарының бұзылысына байланысты.
Слайд 23
Лизосома мембранасының зақымдануы және протеазалардың олардан шығуы сәулеленуден
соң ерте мерзімінде протеолиз үрдісінің белсенуіне әсер етеді. Бұл
белсену тіндерде және организм сұйықтықтарында бос аминқышқылдары және басқа аминқосылыстар деңгейінің жоғарылауымен, аминоацидуриямен, теріс азоттық баланс дамуымен көрінеді. Қанда, тіндерде, зәрде протеолитикалық ферменттердің белсенділігі жоғарылайды. Протеаза ингибиторларының белсенділігі бұзылады. Тіршілікке қабілеттілігі сақталған жасушаларда жүретін протеолиз белсенуі әрқашан айқын үрдіс болып табылмайды. Ол өлген жасушаларда деструкцияның аяқталуын көрсетуі мүмкін.
Ақуыз биосинтезі аз бұзылады. Алайда, ДНК синтезінің терең төмендеуі немесе тіпті тоқтауымен бірге жалғасатын ақуыз синтезі нуклеопротеидтік комплекстер құрылымының және кеңістіктік ұйымдастырылуының ауыр бұзылыстарына әкелуі мүмкін. ДНК- гистон комлексінің бұзылуы ДНК –ның ақуызбен байланысынан босаған аймағына мутагендердің әсер ету мүмкіндігін жеңілдетеді.
Слайд 24
Оттегіні пайдалану қарқындылығы өзгермейді. Бірақ, сәуленуден кейін алғашқы
сағаттарда кейде тіндік гипоксия белгілері байқалады. Жоғары радиосезімтал жасушаларда
салыстырмалы жоғары емес дозада сәулеленуден кейін тотығулық фосфорланудың бұзылысы анықталады, Р/О коэффициентінің төмендеуімен көрінеді.
Қан түзу тінінің жасушаларында тотығулық фосфорланудың тежелуі сәулеленуден кейін 2-4 сағ соғ, ДНК терең бұзылысымен параллельді анықталады. Бірқатар зерттеушілердің пікірінше, АТФ синтезінің бұзылысы сәулеленуден кейінгі ДНК деградациясында іске қосушы буыны болып табылады. Макроэрг синтезінің бұзылысы қалпына келу үрдістерінің дамуына, ДНК репарациясының ферменттер жүйесі жұмысына әсерін тигізуі мүмкін. Осылай, тотығулық фосфорланудың тежелуі жасушаның генетикалық құрылымдарының радиациялық зақымдануында айрықша роль атқарады.
Сәулелену болған организм жасушаларында тіндік тыныс алу және тотығу фосфорлану тез қалпына келеді.
Слайд 25
1.3.2. Сәулелік зақымданудың репарациясы
Пайда болған біріншілік зақымдануға жауап
ретінде сәулеленген жасушада репарациялық жүйелер белсенеді, олардық қызметі туындаған
бұзылысты жоюға бағытталған. Олардың ішінде ДНК бұзылысы репарациясының ферменттік жүйесі маңызды болып табылады. Басқа түрдегі биомолекулалардың зақымдануы жиі жасуша үшін фатальды болып табылмайды: олардың ыдырау өнімдері жасушадан жойылуы мүмкін, ал инактивтелген қосылыстардың қызметін сол құрылымның сақталған молекулалары атқаруы мүмкін. ДНК молекулалары бірегей, және зақымдалған жағдайда олардың қызметі қайталануы мүмкін емес. бұзылған матрицалардың репликациясы кезінде ақаулы көшірмелері өндіріледі – ақаулы өнімдер синтезделеді, мысалы сипаты өзгерген ферменттер. Сондықтан сәулелену нәтижесінде пайда болған ДНК бұзылысы, жасуша үшін ауыр салдардың дамуынан сақтану үшін, бұл өте күрделі құралған биополимердің бастапқы құрылымы нақты қалпына келетіндей түрде репарациялануы болуы керек.
Слайд 26
Жасушада комплементерлық тізбектердің біреуінің және тіпті екі жіпшені

алатын біршама бөлігінің бұзылуымен байланысты, ДНК құрылымының көптеген бұзылыстарын
репарациялауға қабілетті жүйелердің бірнеше түрлері болады. Бірақ мұндай репарацияны қамтамасыз ететін ферменттердің шамадан тыс белсенуі кейде жасуша геномының бұзылысының ауырлауына әкелуі мүмкін. Осылай, ДНК бұзылысының репарацияcы оның барысында АТФ көп мөлшері шығындалатын, энергиялы үрдіс болып келеді. Сонымен қатар, репарация үрдісінде АДФ қарқынды пайдаланылады, ол жасушалармен АТФ өндірілуін төмендетеді. Нәтижесінде дамыған макроэргтар тапшылығы әсіресе оған сезімтал жүйке жасушаларына теріс әсер көрсетуі мүмкін.
Көптеген ДНК бастапқы зақымдалуы репарациясын қамтамасыз ететін механизмдер мен ферменттік жүйелердің жасушаларда болуы ортада химиялық мутагердердің болуы, табиғи радиациялық орта әсерінен тұрақты дамитын ДНК бұзылысы жағдайында геном тұрақтылығын сақтау қажеттілігінен эволюциялық қалыптасқан. Мұндай механизмдер болмаса, өмір сүру мүмкін емес болар еді.
Слайд 27
1.3.3. Сәулеленген жасушаның тағдыры
Сәулеленген жасуша тағдыры биологиялық

күшею және репарация үрдістерінің эффективтілігі қатынасымен анықталады. Сәулелену дозасы
жоғары болған сайын, биологиялық күшею үрдісінің нәтижесінде жасуша өліміне, онық қатерлі өзгеруіне, пролиферациялық белсенділіктің өзегруіне, дифференциялаушы потенцияның шектелуіне, функционалдық мүмкіншіліктің төмендеуіне әкелетін, қайтымсыз өзгерістердің пайда болу мүмкіндігі жоғары болады. Доза төмен болған сайын, жасушада туындаған бұзылыстар аз, соғұрлым пайда болған бұзылыстардан қалпына келуі, тіршілікке қабілеттілігін және жасушаның негізгі қызметтерін сақтауы мүмкін.
Барлық бөлінетін жасушаларда сәулеленуден соң бірден митоздық белсенділік уақытша тоқтайды. Митоздық индекстің күрт төмендеуі, және салдары ретінде жасушалар санының өсуінің тоқтауы in vitro дақылдарында да, көпжасушалы организмнің сәулеленуінде де байқалады. Бөлінудің тежелу уақыты доза жоғары болған сайын, көп болады. G1 фазасынан S –ға және G2 фазасынан M-ға алмасудың тежелуі байқалуы мүмкін.
Слайд 28
ДНК синтезінің баяулауы митоздық белсенділіктің тежелуінің себебі ретінде

қарастыруға болмайды: митоздық белсенділік ДНК-ға белгіленген ізашарлардың қосылуының азаюы
анықтала бастағаннан бұрын төмендейді. Митоздың блогын жасушалық бөлінуді реттейтін үрдістің бұзылуымен түсіндіреді. Митозда хромосомалардың алшақтауын қамтамасыз ететін біліктің түзілуінің бұзылысы болуы мүмкін.
Белсенді пролиферациялаушы тіндердің (мысалы, сүйек кемігі) жасушаларында бөлінудің кідіруі сәулеленуден кейін олардың босап қалуының себебі болады.
Жасушалардағы функционалды бұзылыстарға сәулеленуден кейін нейтрофильдердің фагоцитарлы белсенділігінің төмендеуі, осы жасушаларда кейбір ферменттердің белсенділігінің өзгеруі сияқты көріністер жатады. Бірнеше ондаған грейден асатын дозада сәулелену кезінде, маңызды сәулеленуден кейінгі эффект - ДНК үзілісінің репарациясы үрдісінде олардың ізашарларының шығындалуы нәтижесінде болатын макроэргттар тапшылығымен байланысты, жүйке жасушаларының функционалды белсенділігінің бұзылуы болып табылады.
Слайд 29
1.3.3.1. Жасушалардың сәулелік өлімінің түрлері
Маңызды радиобиологиялық эффект жасуша

өлімі болып табылады. Оның екі негізгі түрлерін ажыратады: репродукциялық,
яғни жасушаның бөліну үрдісімен тікелей байланысты, және интерфазалық, ол жасушалық циклдің кез-келген фазасында болуы мүмкін.
Жасушалар өлімінің репродукциялық түрі
Жоғарыда көрсетілгендей, ядролық ДНК-ның бірегей молекулаларының радиациялық зақымдануы сәулелік үрдістің дамуы үшін маңызды болап табылады. Бірақ, іс егер бөлінбейтін жасушалардағы ДНК туралы болса, оның тізбегінің "мылқау" аймақтарының бұзылуы осы жасушалардың қызметіне әсер көрсетпеуі де мүмкін.
Пролиферацияланатын жасушалар үшін ДНК бұзылысының маңызын асыра бағалау қиын. Жасушаның бөлінуіне қажетті дайындаушы кезеңі, схемасы суретте көрсетілген, ДНК репликациялық синтезі болып табылады. ДНК екілік шиыршығы екі жіпшеге ажырайды, және матрица болған, әрбір түзілген жалғыз тізбегіне комплементарлық матрицалық, нуклеотидтердің ретті қосылуы жолымен оған жұбы салынады. Соңында, генетикалық ақпарат екі еселенеді, және жасуша бөлінуге дайын болады.
Слайд 30
Егер сәулелену нәтижесінде ДНК бұзылысы туындаса, мысал, екілік

үзілістер немесе тігістер, қалыпты репликация мүмкін емес болады. Хромосома
қалыптасуы кезінде ДНК бұзылысы көпірлер, фрагменттер, басқа хромосомалық аберрациялар пайда болуымен көрінеді. Митозда жасушалар өлімінің бұл түрі репродукциялық өлім деп аталады.
Сәулелену нәтижесінде пайда болған ДНК бұзылысының мөлшері үлкен. Мысалы, 1 Гр дозада сәулеленгенде адамның әрбір жасушасында мыңға жуық жалғыз және жүз – екі жүз екілік үзілістер пайда болады. Жоғарыда аталғандай, туындаған ДНК бұзылыстарының көбін жоюға қабілетті жүйелер болмағанда, олардың әрбіреуінде фатальды салдарлар болуы мүмкін. Митоз фазасына дейін ДНК бұзылыстарын репарациялап үлгерген жасушалар қалыпты бөлінуге қабілетті болады. сәулеленумен шақырылатын бөлінуге дайындық үрдістерінің тежелуі жасуша тағдырына қолайлы әсер көрсетуі мүмкін, себебі нәтижесінде сәулелік зақымданудың репарациясы үшін қажет уақыт көбейеді. Қазір көптеген зерттеушілер жасушалардың репродукциялық өлімінің тікелей себебі ДНК репарацияланбаған бұзылыстары, барлығынан бұрын, тізбектердің екілік үзілістері және ДНК-мембраналық кешеннің бұзылуы болып табылады деп санайды.
Слайд 31
Морфологиялық репродукциялық түр бойынша өлген жасушаларды оларда хромосомалық
аберрацияларды анықтап, митоздың ана- немесе метафазасында білуге болады.
Жасушалар
өлімінің интерфазалық түрі
Интерфазалық түр бойынша бөлінбейтін де, бөлінетін де, бірақ митоз фазасынан тыс болатын жасушалар өледі. Интерфазалық өлім туындауы үшін жоғары дозада сәулелену қажет болады. Жасушалардың кейбір түрлері үшін (миоциттер, нейроциттер) бұл ондаған және жүздеген грей. Сонымен қатар, лимфоциттер, тимоциттер, ооциттер сияқты жасушалар ондаған және жүздеген бөлік грей дозада әсерінен өлуі мүмкін.
Жасушалардың интерфазалық өлімінің механизмдері некроз және апоптоз болып табылады. Cәулеленуге ұшыраған, жасушалардың некрозына бастапқы жағдай жиі липидтердің перекисьтік тотығуының белсенумен шақырылған жасуша ішілік мембрананың бұзылуы болып табылады.
Слайд 32
Мембраналардың бұзылуы мембранамен байланысты ферменттердің жұмысын бұзады, тотығулық
фосфорлану үрдісін басады; мембрана өткізгіштігінің жоғарылауы жасушада төмен молекулярлы
заттардың концентрация градиенттернің бұзылуына, лизосомальды протеаза және нуклеазалардың цитоплазмаға шығуына және олардың ядроға енуіне әкеледі. Жасушалық тыныс тежеледі. Осы үрдістердің барлығы нәтижесінде ядрода нуклеопротеидтік комплекстердің деградациясы дамиды, ядроның пикнозы немесе балқу, жасушаның құрамындағының жасуша мембранасының сыртына шығуымен цитолиз жүреді.
Апоптоз жағдайында кейін ядроның фрагментациясымен көрінетін, хроматиннің нуклеосома аралық деградациясы жүреді. Цитоплазма да ыдырайды, оның ядро бөлшектерін қоршайтын аймақтары "апоптоздық денешіктер" деп аталады. Апоптоз үрдісі жасушаның өзін-өзі құрту бағдарламасының қосылуымен іске асады. Хроматин деградациясына қатысатын ферменттердің синтезін бақылайтын геном аймақтарының белсенуі жүреді.
Слайд 33
Бұл белсенуді әртүрлі факторлардың әсерінен пайда болған және
ядролық хроматин, мембрана құрылымдарының сәулеленуден бұзылыстарынан туындаған стимулдар шақыруы
мүмкін. Сонымен, апоптоз- бұл жасуша өлімінің генетикалық бағдарламаланған түрі. Апоптоз механизмі әсіресе лимфоидты жасушалар, қан түзу тінінің жасушаларының интерфазалық өліміне тән.
Жасуша өлімінің репродукциялық және интерфазалық түрінде де генетикалық материалдың бұзылуы байқалады. Бірақ, бірінші жағдайда бұл бұзылыс ядролық ДНК бірегей құрылымына радиацияның тікелей немесе тікелей емес әсері нәтижесінде болады. Интерфазалық өлімді ынталандыруда маңызды роль басқа құрылымдардың бұзылыстарына жатады – жасуша ішілік мембрана, ферменттер, жасушалық метаболизм бұзылыс, тек соңғы кезеңдерінде геном бұзылады.
Слайд 34
1.3.3.2. Жасуша геномының летальді емес зақымдану
ДНК молекулаларының сәулелік
модификациясының кейбір түрлерінің организм үшін маңызды нәтижесі генетикалық материалдың
тұқым қуалаушы бұзылыстарының туындауы болып табылады - мутациялар, олардың зардаптары соматикалық жасушалардың қатерлі өзгеруі болады. Мутациялардың пайда болу себебі сәулеленумен шақырылған ДНК дестабилизациясы, оның бұзылысының репарация үрдісі бола алады. Екі жағдайда да онковирустың жасуша геномына енуі немесе репрессияланған жағдайда геномда болған онковирустардың белсенуі жеңілдейді. Ұрықтық жасушаларда мутация салдары сәулеленген ата-аналарының ұрпақтарында даму ақаулары болу мүмкін.
Слайд 35
1.3.4. Жасушалардың сәулелік зақымдануының сандық сипаттамасы
Сәулелену дозасы

және тіршілікке қабілеттілігін сақтаған жасушалардың қатынасын анықтағанда, олардың кейбіреуі
ең аз дозада әсер еткенде өледі. Сондай-ақ, 10 Гр және одан үлкен дозада әсер еткенде кейбір жасушалар тіршілігін сақтай алады. Дозаға байланысты тірі қалған жасушалардың азаю қисығы көп бөлігінде экспоненциальды жүреді, бұл жасушалардың радиациялық өлімі жағдайының кездейсоқтығын дәлелдейді. Жасушада “нысана” болады, оның астарында критикалық микроқұрылым немесе бұзылысы жасуша тіршілігін сақтап қалуымен байланыссыз микроүрдістердің жиынтығы түсіндіріледі. Затта жұтылаған энергия үлесі іске асырылатын микрокөлемнің мұндай нысанамен түйісуі – жасушаның инактивациясына әкелетін жағдай. Мұндай түйісу мүмкінділіктік сипатта болады. Дозаның жоғарылауымен бұл мүмкіндік өседі. Егер ионизация нысана шегінде өтсе, өте аз дозада әсер еткенде жасуша өледі. Бірақ өте жоғары дозада да ионизацияның ешқайсысы нысанаға тимеу мүмкіндігі бар. Мұндай жағдайда жасуша тіршілігін cақтауы керек.
Слайд 36
Анализге қолайлы болуы үшін жасушалардың өміршеңдігінің сәулелену дозасына
тәуелділігін полулогарифмдік масштабта орындалған қисықпен көрсетеді (сурет 67). Қисық
сызық екі аймақтан тұрады. Негізгі (соңғы) аймақ түзу сызықты, бұл жоғары дозада сәулеленуде тәуелділіктің экспоненциальды сипатын көрсетеді. Еңістеу бастапқы аймақ (“иық”) жоғары емес дозада сәулеленуде жасушалардың резистенттілігін қамтамасыз ететін репарация үрдістерін көрсетеді.
Сурет 67. Сирек иондаушы сәуле әсері кезіндегі жасушалардың өміршеңдігінің қисығы ( С.П. Ярмоненко бойынша, 1988)
Жасушалардың радиосезімталдығының негізгі көрсеткіштері Do және Dq шамалары болып табылады.
Слайд 37
Do қисық сызықтың экспоненциальды аймағының еңіс бұрышын сипаттайды
және тіршілікке қабілетті жасушалардың мөлшері е (2,72) есе төмендейтін,
яғни есептің бастауы деп қабылданған мөлшерден 37 % дейін, сәулелену кезіндегі доза ретінде анықталады.
Dq (иық дозасы) жасуша ішілік репарацияға қабілеттілікті сипаттайды жәнежасушалар өміршеңдігінің 100 % деңгейінде жүргізілген, түзу сызықты аймақтың горизонтальды сызықпен жалғасының қиысу нүктесіне сәйкес келетін доза ретінде анықталады.
Неғұрлым Do және Dq мәні аз болса, соғұрлым зерттелетін жасушалар популяциясының радиосезімталдығы жоғары болады.
Аналогиялық тәуелділік доза-эффект басқа да радиобиологиялық эффекттерді сипаттайды, мысалы, сәулелену дозасынан хромосомалық бұзылыс дамымаған жасушалар бөлігінің тәуелділігі, ерітінділердің сәулеленуінде бұзылмаған молекулалардың бөлігі және т.б.
Слайд 38
1.4. Сәулелердің тінге, ағзаға және жүйелерге әсері. Тіндердің

радиосезімталдығы
Организм тіндері радиосезімьалдығы бойынша ажыратылады. Егер лимфоциттердің және сүйек
кемігі жасушаларының өлімін оннан бір бөлік грейге тең дозада сәулеленуден кейін тіркеуге болса, бұлшық ет және жүйке жасушалары ондаған грей дозаға шыдайды. Радиосезімталдығы бойынша тіндерді бөлуде белгілі бір заңдылықтар 1906 жылы француз ғалымдары Бергонье және Трибондомен сәуленің биологиялық әсерін зерттеудің басында көрсетілген. Олар ереже қалыптастырды, оған сәйкес тіндер оларды құрайтын жасушалардың пролиферациялық белсенділігі жоғары болған сайын, радиосезімталдығы да жоғары, және олардың дифференциация дәрежесі өскен сайын, радиорезистенттілігі жоғары болады.
Белсенді пролиферациялаушы жасушалардың жоғары радиосезімталдығын сәулелену кезіндегі ядролық ДНК құрылымының бұзылысының ерекше ролімен байланыстырады. Тіндік деңгейде жедел радиациялық зақымдану тіннің жасушалық босап қалуымен байланысты құрылымының және қызметінің бұзылысымен көрінеді.
Слайд 39
Тіндердің радиосезімталдығы, негізінен, осы тінді құрайтын жасушалардың радиосезімталдығымен

анықталатындығымен, реттеуші жүйелердің– жүйкелік, эндокриндік бұзылысы арқылы радиацияның тікелей
емес әсер етуін де есептен шығармау керек. Сонемен қатар, ағзаның радиосезімталдығы оның функционалдық жағдайына байланысты. Сезімталдық әдетте ағзаның қызметі артқанда жоғарылайды.
Ересек организмде Бергонье және Трибондо ережесіне сәйкес, пролиферацияламайтын жоғары дифференцияланған жүйке жасушалары жоғары радиорезистентті. Бірақ бұл тек бұзылыстың морфологиялық көрінісіне жатады. нейрондардың функционалды реакциясы өте аза дозада сәулеленуге жауап ретінде анықталады. Электроэнцефалограмманың ерте өзгерістері 0.5 мГр дозада сәулеленуден кейін пайда болады; 1 мГр дозада сәулелену электрлік тітіркенішке жауапқа рефлекс ұзақтығының ұзаруын шақырады. Ұйықтап жатқан егеуқұйрықтар 0.01 - 0.02 Гр дозада сәулелену нәтижесінде оянады. In vitro жүйке жасушаларында электрлік белсенділіктің толқындарын 0.01 Гр дозада сәулелену шақырады. Осының барлығы жүйке жасушаларының радиациялық әсерге қатысты жоғары реактивтілігін көрсетеді.
Слайд 40
"Радиосезімталдық" термині оның қарапайым қолданысында сәтсіз деп айтуға
болады. Өз уақытында көрнекті патофизиолог және радиобиолог П.Д. Горизонтов,
радиосезімталдық деп биологиялық обьекттің сәулеленуге тек бұзылуы ғана емес, реакцияларының кез-келген түрінің сандық көрінісі деп түсінуді ұсынғаны қисынды сияқты. Егер бұл бекітілсе, жүйке тінін ең радиосезімтал деп атаушы еді. Бірақ, радиобиологияда радиосезімталдық термині көбінесе радиобұзылыс синонимі ретінде қолданады.
Слайд 41
1.4.1. Қан жүйесінің радиациялық зақымдануы
Қан жүйесі жасушалық жаңару
жүйесіне жатады, олардың қызметі өмір сүру ұзақтығы қысқа функционалды
жасушалардың тұрақты мөлшерін сақтап тұруды қамтамасыз етеді. Мұндай жүйенің қызмет ету сызбасы суретте келтірілген.
Жасушалық жаңару жүйесінде жүретін сәулеленуден кейінгі өзгерістер гранулоцитопоэз мысалында қарастырылады.
Маңызды эффекттердің бірі жасушалық бөлінудің тоқтауы болып табылады. ол сәулелену дозасы жоғары болған сайын, ұзақ болады.
Блоктан шыққан соң ядролық ДНК бұзылысы репарацияланбаған жасушалардың бір бөлігі репродукциялық өлімге ұшырайды. Бір бөлігі интерфазалық түр бойынша өледі. Доөаның өсуімен өлген жасушалардың саны артады. Радиосезімталдығы жоғары бағаналық бөліктің жасушалары (Do шамамен 1 Гр құрайды), және туынды жасушалардың колония түзуге қабілетінің жоғалуы критериі бойынша бағаналық жасушалардың саны сәулеленуден кейін бірден төмендейді. Пролиферация пула жасушалары да жоғары радиосезімталдыққа ие.
Слайд 42
Пісіп жетілу пула жасушаларының радиосезімталдығы салыстырмалы түрде жоғары
емес, бұл жасушалардың көбі тіршілікке қабілетін сақтайды, жетіледі және
перифериялық қанға шығады. Нәтижесінде жасушалар мөлшері сүйек кемігінде, одан кейін перифериялық қанда тез азаяды. Бастапқыда жас, радиосезімталдығы жоғарырақ жасушалар көлемі төмендейді. Артынан босау үрдісі жетілген бөліктерді алады, себебі пісіп жетілу және жетілген жасушалардың қанға шығуы жалғасады, ал пролиферациялық пуладан келіп түсу есебінен олардың саны толтырылуы жоқ. Соңында, перифериялық қанда гранулоцитопения дамиды (сурет. 68).
Сурет 68. Жоғары дозада сәулеленуден кейін жасушалық жаңару жүйесінде босап қалу дамуының сызбасы (В. Бонду және т.б. бойынша, 1971)
Слайд 43
Қанда гранулоциттер құрамының қисығының барысына басқа да факторлар

әсер етеді. Сәулеленуден кейін жақын сағаттарда ерте нейтрофильді лейкоцитоз
анықталады перераспределительного характера – басқа да тітіркендіргіштер әсер еткенде байқалатын бейспецификалық реакция. Сәулеленуден кейін 2-ші аптаның ортасынан адамда байқалатын нейтрофильдер санының абортивті өсуі және осы жасушалардың одан да терең төмендеуімен ауысуы маңызды орын алады. Абортивті өрлеуді бөлінудің шектелген мөлшеріне қабілетті пролиферациялық жасушалардың жаңаруымен түсіндіреді, ол жетілген нейтрофильдер санының уақытша артуын қамтамасыз етеді. Бірақ, ол терең нейтропения кезеңін қысқарта отырып, пайдалы болып табылады.
Сәулеленгендердің перифериялық қан жасушаларында морфологиялық және цитохимиялық өзгерістер анықталады, бұл олардың толық емес функционалдық толымсыздығын дәлелдейді. Негізінен қан жасушалары бірнеше грей дозада сәулеленуден кейін жедел сәулелік ауру кезінде өздерінің қызметтерін қанағаттанарлық орындайды, және қан түзудің бұзылуымен байланысты клинакалық белгілердің негізгі себебі жасушалардағы сапалық өзгеріс емес, олардың санының азаюы болып табылады.
Слайд 44
Сәулеленуден кейін қанда функционалыдық жасушалардың жеке түрлерінің құармының

азаюының басы және бұл азаюдың тереңдігі максимальды болу мерзімі
жасушалар-ізашарлардың пролиферация, пісіп жетілу пула құрамында болатын уақытына, және жетілген жасушалардың қанда айналып жүру ұзақтығына байланысты. Бұл көрсеткіштер түрлі жасушалық сызықтар үшін де, жануарлардың әр түріне де бірдей емес. Мысалы, адамда гранулоцит алғышарттардың пролиферация пул арқылы өтуі 4 - 6 күнді алады, және жетілу пул арқылы өтуге де соншама уақыт кетеді. Жетілген гранулоциттер қанда орташа 8 – 10 сағат айналып жүреді.
Аталған мерзімдерге сәйкес адамда нейтропения сәулеленуден кейін шамамен 5 күннен соң анықтала бастайды. Тромбоциттердің қанда болу ұзақтыңы 6 – 8 күнге бағаланады, олардың минимальды деңгейі 2 – 2,5 аптадан кейін жетеді.
Қанда эритроциттердің өмір сүру ұзақтығы 100 – 120 күнді құрайды. Бірнеше грей дозада сәулеленуден кейін жетілген эритроциттердің бұзылыстары үлкен емес, және сондықтан жаңа эритроциттердің өндірілуі толық тоқтаған жағдайда да, олардың саны тәулігіне 1 % төмендеуі мүмкін, анемия өте баяу дамиды (егер қан кету пайда болмаса).
Слайд 45
Митоздың блок ұзақтығы сәулелену дозасына байланысты және бірнеше
сағаттардан тәуліктерге дейін құрайды. Блоктан шықаннан кейін тіршілікке қабілеттілігін
сақтаған бағаналық жасушалар пролиферацияны жаңартады, сол арқылы сүйек кемігінің, одан соң қанның морфологиялық құрамын қалпына келтіруге негіз жасайды. Бұл қалпына келуді қанда енді ғана босау үрдісі басталғанда байқауға болады. Бағаналық бөлікте қалпына келу үрдісі жетілген функционалды жасушалардың көбеюімен іске асуы үшін, бағаналық жасушалардың жеткілікті санының қалпына келуіне және жасушалардың бөліну және жетілу бөліктерінен өтуіне қажетті уақыт керек.
Цитопенияның айқындылығы сәулелену дозасының өсуімен бірге артады.
Қан түзудің бұзылуы және онымен байланысты клиникалық көріністер, бірінші кезекте, инфекциялық асқынулар және жоғары қанаққыштық сүйек кемігі синдромы деп аталады, ол 1 - 6 Гр дозада сәулеленуден соң дамитын ЖСА аттас түрінің негізінде жатыр.
Слайд 46
1.4.2. Асқазан-ішек жолының радиациялық зақымдануы
Жалпы сәулеленуде асқазан-ішек жолының
ағзалары арасында аса маңызды бұзылыс аш ішектің шырышты қабатының
эпителиінің зақымдану, сүйек кемігі сияқты, жасушалық бөлінудің сондай жүйесі болып табылады. бірақ егер сүйек кемігінде жетілудің түрлі дәрежесіндегі жасушалар ретсіз орналасса, ішектің шырышты қабатында әртүрлі пулаларға жататын жасушалардың орналасуы анық шектелген.
Крипталардың түбінде бағаналық жасушалар болады. Бағаналық жасушалардың бөліну өлшемі және олардың әрі қарай жетілуіне байланысты, жасушалар крипталардың сағағына қарай бағытымен және бұдан әрі бүрлердің қабырғасымен оның ұшына қарай жылжиды, ол жерден ішек өзегіне түлейді. Бүрлерден жасушалалардың жоғалуы крипталалардан қайтадан түзілген жасушалар түсімімен теңдестіріледі. Жасушаның крипта түбінен бүрдің ұшына дейін жылжуы 4 тәулікті алады.
Слайд 47
Жасушалық жаңарудың басқа жүйелері сияқты, ішек эпителиінде сәулеленуден

кейін митоздың уақытша блогы болады, бағаналық және басқа бөлінетін
жасушалар өледі. Жетілуші және функционалды жасушалар радиорезистентті (Do 15 Гр құрайды) бола отырып, сәулеленуден кейін бүрлердің ұшына жылжуын жалғастыра береді және түлейді. Ішектің эпителиальды қабаты жасушалық бөліну есебінен толықтыру болмағанда тез жоғалады, бүрлер "жалаңаштанады" және тегістеледі.
Бағаналы энтероциттер бағаналы қан түзу жасушаларына қарағанда, оларда ДНК бұзылысының жасуша ішілік репарациясының жоғары белсенділігі нәтижесінде (Dq сүйек кемігіндегі бағаналы жасушалар үшін 1 Гр –ден аз көлемді құрайды, ал аш ішек эпителиінде - 4 Гр) гамма- және рентген сәулесіне сезімталдығы төмендеу. Сондықтан өмірге қауіпті ішек эпителиінің зақымдануы, сүйек кемігінің терең бұзылысна жеткілікті дозаға (4 - 5 Гр) қарағанда, өте жоғары дозада (10 Гр) болады. Жалпы сәулелену дозасы, ішек бұзылысы организмнің өмірін сақтаумен сәйкес келмейтін көлемге жететіндей жағдайда болғанда, патологиялық үрдіс тез дамиды, 3 – 5 тәулік соңында шырышты қабаттың толық денудациясы жүреді. Панцитопения қанда кешірек дамиды.
Слайд 48
Егер ерте мерзімінде өлім болмаса, ішек эпителиінің сақталған
бағаналы жасушалары оның тез регенерациясын, ішек қабырғасының құрылымының және
қызметінің қалпына келуін қамтамасыз етеді.
10 Гр асатын дозада жалпы сәулелену жағдайында максимальды айқындылыққа жететін аш ішектің шырышты қабатының сипатталған өзгерістері ішектік синдром дамуы негізінде жатыр.
Асқазан-ішек жолының басқа бөліктерінің радисезімталдығы аш ішекпен салыстырғанда төмендеу болады.
Асқазан-ішек жолының басқа барлық бөліктерінде ішектік синдром дамуындағы деңгейге жетпейтін жалпы сәулеленуден кейін эрозиялар, ойықтар, жергілікті некроздар ішек қабырғасының перфорациясына дейін байқалуы мүмкін. Көбінесе бұл белгілердің пайда болуы екіншілк инфекция және сүйек кемігі синдромы себебінен геморрагиялардың дамуымен байланысты. Ең маңызды некроздық энтеропатия және орофарингеальды синдром болып табылады.
Жоғары дозада іш аймағының жергілікті сәулеленуінде некроздар және ойықтырдың пайда болуы мүмкін.
Слайд 49
1.4.3. Орталық жүйке жүйесінің сәулелік зақымдануы
Орталық жүйке жүйесінің

жасушаларының зақымдануының айқын морфологиялық көріністері 50 Гр және одан
жоғары дозада әсер етуден кейін ғана байқалады. Ерте өзгерістер синапстарда (пресинапстық терминал немесе белсенді аймақта туындайтын синапстық көпіршіктердің жабысуы) анықталады. Сәулеленуден 2 сағ соң жарықтық микроскопияда жасушалардың ісінуі, мишықтың дәнді жасушаларының ядроларының пикнозы, васкулит, менингит, гранулоцитарлы инфильтрациямен анықталады хориоидальды плексит. Өзгерістердің максимумы сәулеленуден кейін 1 тәулігінде байқалады. Өте жоғары дозада ми тінінің ерте некрозы болуы мүмкін.
10 - 30 Гр дозада сәулеленуде ОЖЖ жасушаларында тотығулық фосфорланудың тежелуі анықталады. Мұны ДНК үзілісінің репарациясына шығындалған АТФ тапшылығымен байланыстырады. Жүйке жасушаларының реактивті жағадайының ошақтары дамиды: нейрондардың ісінуі, аргирофильдіктің жоғарылауы. Бұл кезде жеке нейрондар өледі. Вегетативті ганглилердегі жайылған ошақтық өзгерістер ішкі ағзалар қызметінің дискоординациясының себебі бола алады.
Слайд 50
Жүйке жасушаларындағы аталған өзгерістер сәулелік зақымдануға спецификалық емесе
және кейбір токсикалық факторлардың әсерінен байқалады. Жүйке құрылымдарының өзгерістері
екіншілік, яғни сәулелік бұзылыс даму барысында басқа ағзалардағы өзгерістердің (токсемия, инфекциялық үрдіс) салдары болып табылады.
Өте аз дозада сәулелену әсеріне жүйке жасушаларының функционалдық реакциялармен жауап беру қабілеті айтылған. Осыған қосатыны. Жүйке жүйесі қызметіне зақмданған радиосезімтал тіндерден көлемді патологиялық афферентті импульсация және ішкі ортаға ішектен енген жасушалық ыдырау өнімдерінің, эндотоксиндердің токсикалық әсері әсер етуі мүмкін.
Сәулелік ауру барысында ми қыртысының биоэлектрлік белсенділігігің өзегрістері анықталады, тәжірибеде шартты-рефлекс қызметінің бұзылысы тіркеледі.