- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Разработка метода клинического исследования фармацевтических препаратов с использованием тканевого инжиниринга
Содержание
- 2. Цель:разработать метод клинического исследования фармацевтических препаратов с использованием тканевого инжиниринга.
- 3. Задачи:
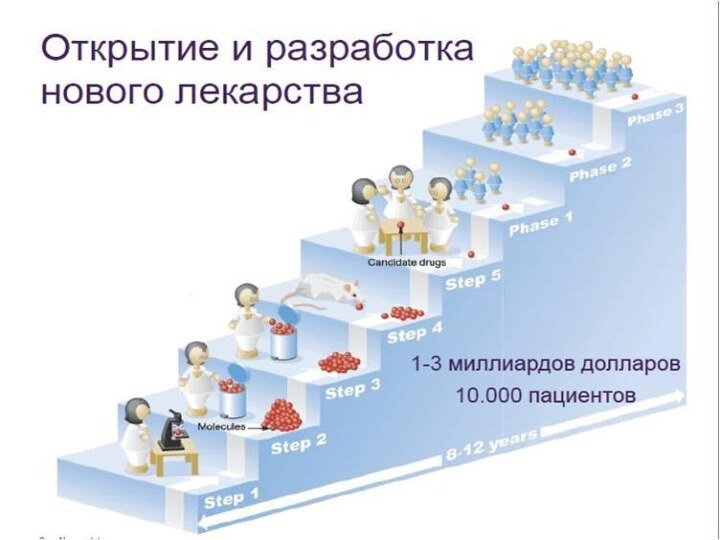
- 4. Разработка лекарственных средстввключает в себя поиск новых
- 5. Этапы создания лекарственного средства:
- 6. Slide TitleProduct AFeature 1Feature 2Feature 3Product BFeature 1Feature 2Feature 3
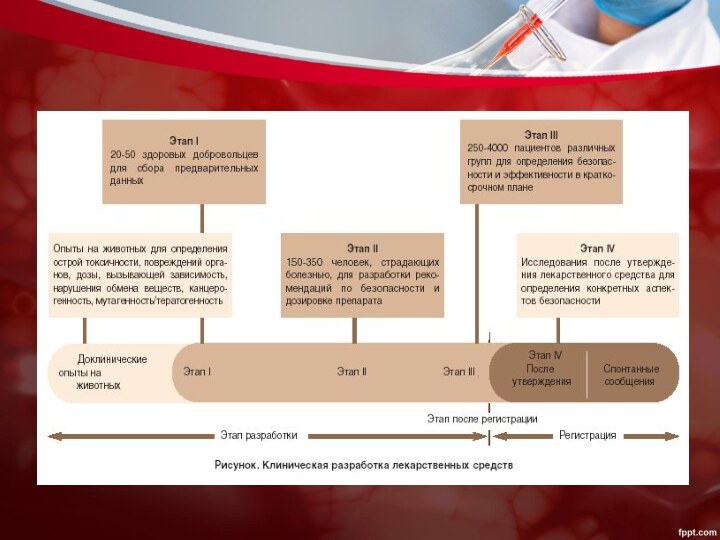
- 7. Клиническое исследование (испытание)любое систематическое исследование медицинского продукта
- 9. Фаза ІИССЛЕДОВАНИЯ:Первичные испытания средств на людях, обычно
- 10. Фаза ІIИССЛЕДОВАНИЯ:Испытания на больших группах людей,страдающих определенным
- 11. Фаза ІIIИССЛЕДОВАНИЯ:Крупномасштабные клинические исследования на более крупных
- 12. Фаза ІVИССЛЕДОВАНИЯ:Постмаркетинговые.ЦЕЛЬ:1.Выявление отличий нового лекарственного препарата от
- 13. Суть предлагаемой методикиОрганы-на-чипах являются микрожидкостными приборами для
- 15. Перспективы методики:Обеспечение точной альтернативы традиционным испытаниям на
- 16. Преимущества:Достижение высокого разрешения в микроскопических системах для
- 17. Недостатки:Невозможно полностью смоделировать все функции органа;Сложность в воспроизведении пространственной неоднородности ткани;Технические проблемы.
- 18. ВыводПредложенная методика воспроизведения живых органов на микрожидкостных
- 19. Скачать презентацию
- 20. Похожие презентации
Цель:разработать метод клинического исследования фармацевтических препаратов с использованием тканевого инжиниринга.
















Слайд 2
Цель:
разработать метод клинического исследования фармацевтических препаратов с использованием
тканевого инжиниринга.
Слайд 4
Разработка лекарственных средств
включает в себя поиск новых фармакологически
активных веществ, последующее изучение их лекарственных свойств, доклинические исследования,
разработку технологий производства фармацевтических субстанций, разработку составов и технологий производства лекарственных препаратов.
Слайд 7
Клиническое исследование (испытание)
любое систематическое исследование медицинского продукта с
участием людей в качестве субъектов (пациентов или здоровых добровольцев)
с целью оценки его фармакокинетики, эффективности и безопасности.
Слайд 9
Фаза І
ИССЛЕДОВАНИЯ:
Первичные испытания средств на людях, обычно здоровых
добровольцах.
ЦЕЛЬ:
1.Обеспечить необходимый уровень безопасности лекарственного средства;
2.Установить фармокинетический профиль лекарственного
средства.
Слайд 10
Фаза ІI
ИССЛЕДОВАНИЯ:
Испытания на больших группах людей,страдающих определенным заболеванием.
ЦЕЛЬ:
1.Установить
эффективность лекарственного средства у пациентов с исследуемым заболеванием или
синдромом;2.Оценить краткосрочную безопасность лекарственного средства;
3.Определить терапевтическую дозировку.
Слайд 11
Фаза ІII
ИССЛЕДОВАНИЯ:
Крупномасштабные клинические исследования на более крупных группах
больных разного возраста, с разными сопутствующими заболеваниями.
ЦЕЛЬ:
Получение данных о
безопасности и эффективности лекарственного средства с целью оценки показателя «риск/польза».
Слайд 12
Фаза ІV
ИССЛЕДОВАНИЯ:
Постмаркетинговые.
ЦЕЛЬ:
1.Выявление отличий нового лекарственного препарата от других
в данной фармгруппе;
2.Сравнение его эффективности с аналогами;
3.Демонстрация экономичности препарата.
Слайд 13
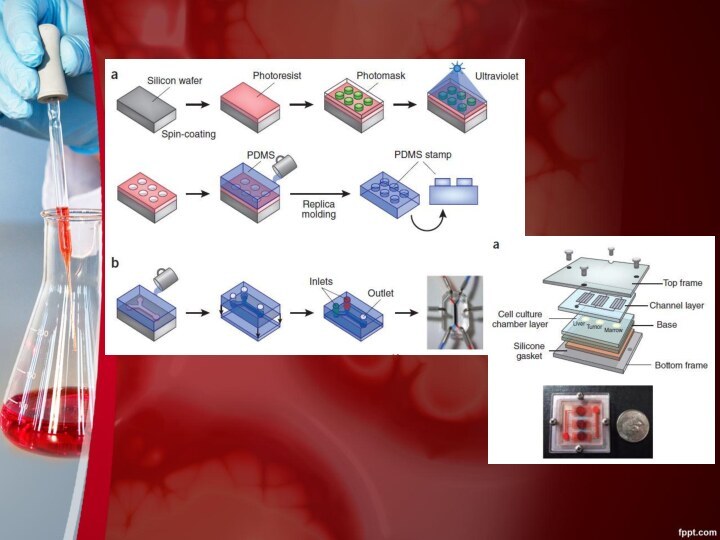
Суть предлагаемой методики
Органы-на-чипах являются микрожидкостными приборами для культивирования
живых клеток в постоянно кровоснабжающихся камерах для моделирования физиологических
функций тканей и органов.Цель данной разработки не в том, чтобы построить целый живой орган, а скорее, чтобы синтезировать минимальные функциональные единицы, которые отображают тканевой и органный уровень функции.
Слайд 15
Перспективы методики:
Обеспечение точной альтернативы традиционным испытаниям на животных,
которые часто не в состоянии предсказать человеческие ответы;
Исследования эффектов
новых лекарств-кандидатов для безопасности и эффективности препарата в тканях человека;Проверка безопасности косметики;
Тест на токсичность химических веществ;
Разработка вакцин и препаратов для противодействия угрозам биотерроризма.
Слайд 16
Преимущества:
Достижение высокого разрешения в микроскопических системах для визуализации
процессов;
Отображение в реальном времени событий молекулярного уровня;
Облегчение вычислительного моделирования
жидких динамических взаимодействий среди различных газов, метаболитов и клеток, которые неизменно воздействуют на жизнеспособность клетки и ее функцию;Способность управлять средой клетки, что позволяет усилить ее дифференцировку и выживаемость.
Слайд 17
Недостатки:
Невозможно полностью смоделировать все функции органа;
Сложность в воспроизведении
пространственной неоднородности ткани;
Технические проблемы.
Слайд 18
Вывод
Предложенная методика воспроизведения живых органов на микрожидкостных чипах
является наиболее перспективной и оптимальной для клинического исследования фармпрепаратов.
Но
все же стоит отметить, что данная методика имеет и существенные недостатки, которые не позволяют внедрить ее в использование и гарантировать полную замену клинических испытаний на людях.Итак, полная замена клинических исследований фармпрепаратов на эксперименты на животных тканях НЕВОЗМОЖНА, поскольку такие эксперименты являются острыми .