Слайд 2
ТЕРМІНИ
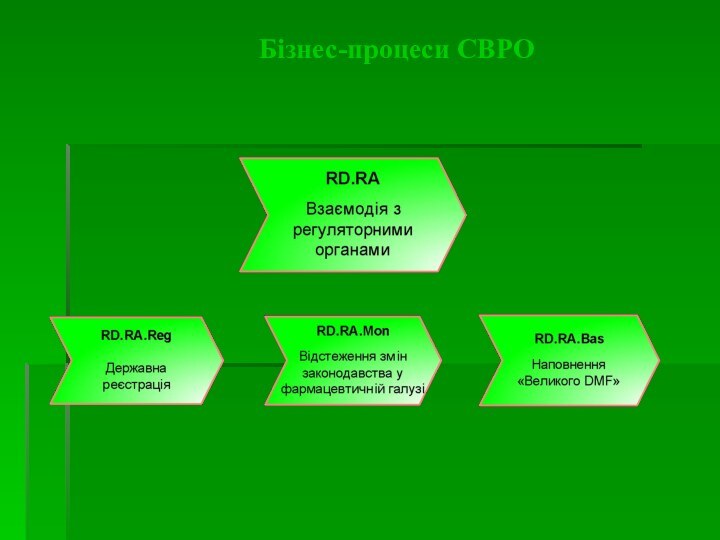
Реєстрація/перереєстрація ГЛЗ - процедура, яка включає ряд етапів
експертиз ЛЗ і відповідної НТД, які проводяться компетентними органами
(організаціями) та визначеними для цього державними регуляторними органами для отримання реєстраційного посвідчення на ЛЗ та внесення цього ЛЗ в Державний реєстр країни, на ринку якої працює виробник.
Заявник (власник реєстраційного свідоцтва) - юридична або фізична особа, яка несе відповідальність за ефективність, якість та безпеку лікарського засобу в порядку, встановленому законодавством.
Слайд 3
РЕЄСТРАЦІЙНЕ досьє – комплект документів,
які стосуються матеріалів доклінічного вивчення, клінічних випробувань лікарського засобу
та їх експертиз; фармакопейної статті або матеріалів, які стосуються методів контролю якості лікарського засобу, проекту технологічного регламенту або даних про технологію виробництва; зразків лікарського засобу і його упаковки; інших матеріалів, які характеризують ефективність, безпечність і якість лікарського засобу.
(Наказ МОЗ України від 26.08.2005 № 426)
Власник ліцензії на виробництво зобов'язаний виробляти лікарські засоби так, щоб забезпечити їхню відповідність своєму призначенню, вимогам реєстраційного досьє.
(Керівництво 42-01-2001, Належна виробнича практика)
РЕЄСТРАЦІЙНЕ ДОСЬЄ
Слайд 5
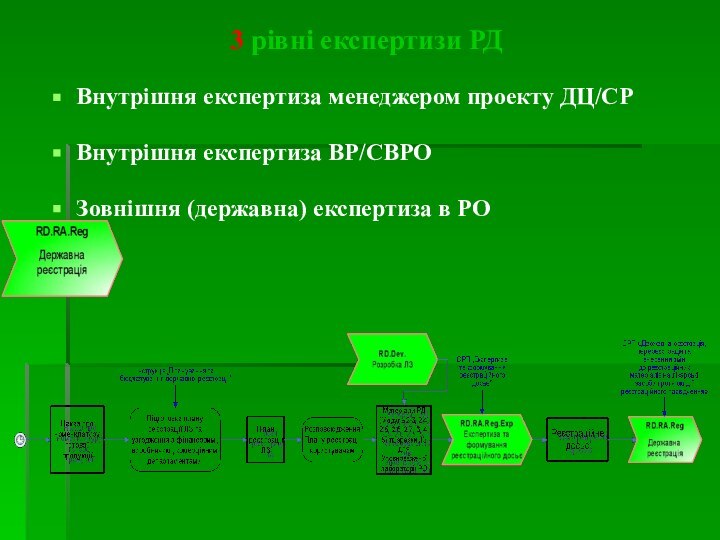
3 рівні експертизи РД
Внутрішня експертиза менеджером проекту ДЦ/СР
Внутрішня
експертиза ВР/СВРО
Зовнішня (державна) експертиза в РО
Слайд 6
Внутрішня експертиза РД (1)
Експертна функція ВР (критична оцінка
даних досьє на відповідність останнім фармакопейним та ін. регуляторним
вимогам)*.
*СРП «Експертиза та формування реєстраційного досьє» (AR.RD.RA. Req. Exp.01. SOP).
Мета - підвищити якість РД, що означає:
Скоротити час реєстрації ЛЗ;
Скоротити грошові витрати підприємства;
Зменшити кількість змін після реєстрації.
Слайд 7
Передача документів з ДЦ у ВР
При реєстрації: Модуль
2 (розділ 2.3) і Модуль 3.
При перереєстрації: Комплект
документів у відповідності з вимогами Наказу МОЗ України № 426 от 26.08.2005 (доп.15).
Передача документів з СР у ВР
При реєстрації: Модуль 2 (розділи 2.4, 2.5, 2.6, 2.7) і Модуль 4 та 5.
При перереєстрації: PSUR, проект інструкції по медичному застосуванню, зведені дані виробника про стан безпеки медичного застосування ЛЗ.
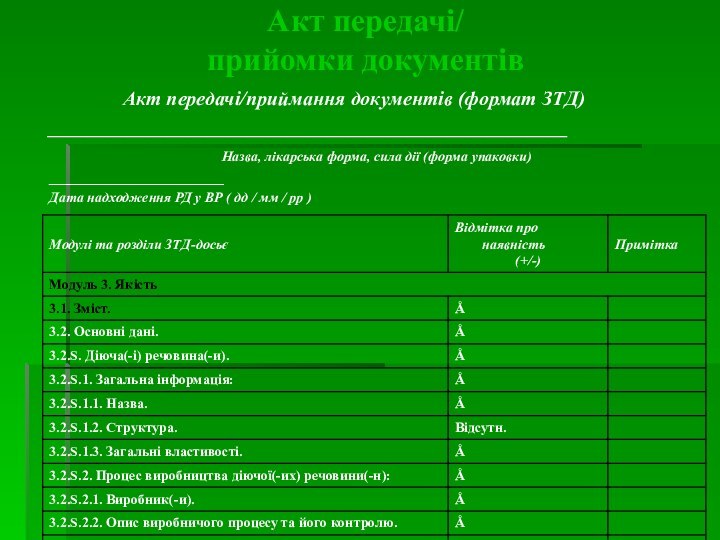
Спеціаліст по реєстрації складає Акт передачі/приймання документів з СР/ДЦ у ВР/СВРО (обов'язково: дати і підписи).
Внутрішня експертиза РД (2)
Слайд 8
Технічні вимоги до реєстраційного досьє
Переплетення не повинно
закривати інформацію.
Текст і таблиці повинні бути з полями.
Рекомендується використовувати
шрифт з розміром кеглю 12.
Акроніми і скорочення необхідно вказувати в місці їх першого згадування в тексті кожного модуля.
Рекомендується використання окремої нумерації томів в кожному модулі.
Слайд 9
Акт передачі/
прийомки документів
Слайд 10
Тривалість експертизи у ВР:
- при реєстрації - 5
днів,
- при перереєстрації - 3 дні,
- при внесенні змін
в РД - 2 дні.
Після закінчення експертизи спеціаліст по реєстрації ВР складає Звіт про результати внутрішньої експертизи.
У випадку наявності зауважень ВР передає досьє на доробку спеціалістам ДЦ і СР. Термін виправлення зауважень 5 днів.
Терміни внутрішньої
експертизи РД
Слайд 11
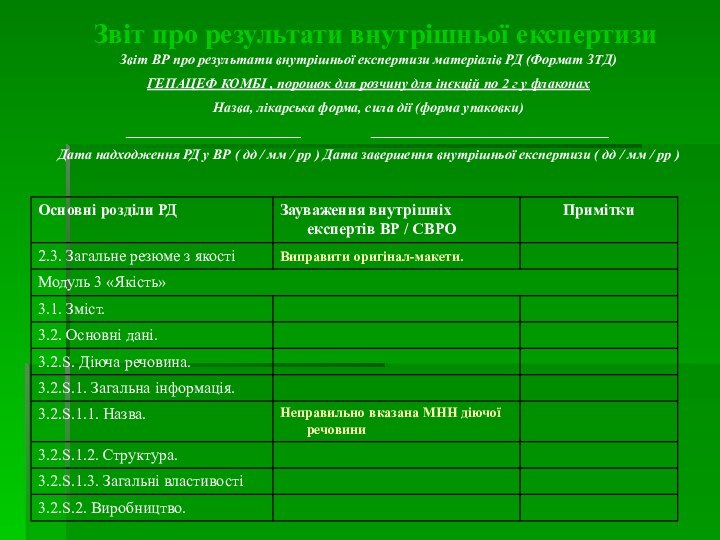
Звіт про результати внутрішньої експертизи
Звіт ВР про результати
внутрішньої експертизи матеріалів РД (Формат ЗТД)
ГЕПАЦЕФ КОМБІ , порошок
для розчину для інєкцій по 2 г у флаконах
Назва, лікарська форма, сила дії (форма упаковки)
_________________________ __________________________________
Дата надходження РД у ВР ( дд / мм / рр ) Дата завершення внутрішньої експертизи ( дд / мм / рр )
Слайд 12
Формування РД
Порядок формування реєстраційного досьє у ВР.
Матеріали, передані з ДЦ і СР, доповнюються :
- При реєстрації: Модуль 1 і 2 (Розділи 2.1 і 2.2.).
- При перереєстрації і внесенні змін: Заявки і супровідні документи.
Сформоване РД передається для візування начальнику СВРО і директору ДІіР на затвердження.
Затверджене досьє передається менеджеру по реєстрації СВРО для подання в РО.
Слайд 13
ТЕРМІНИ ЕКСПЕРТИЗИ РД
в регуляторних органах
ТЕРМІНИ ЕКСПЕРТИЗИ (згідно
Наказу №426)
При реєстрації не більше 210 днів
При перереєстрації не
більше 90 днів
При внесенні змін не більше 60 днів
(за виключенням часу знаходження матеріалів на доробці у заявника)
Слайд 15
Мета і терміни експертизи РД
в регуляторних органах
(1)
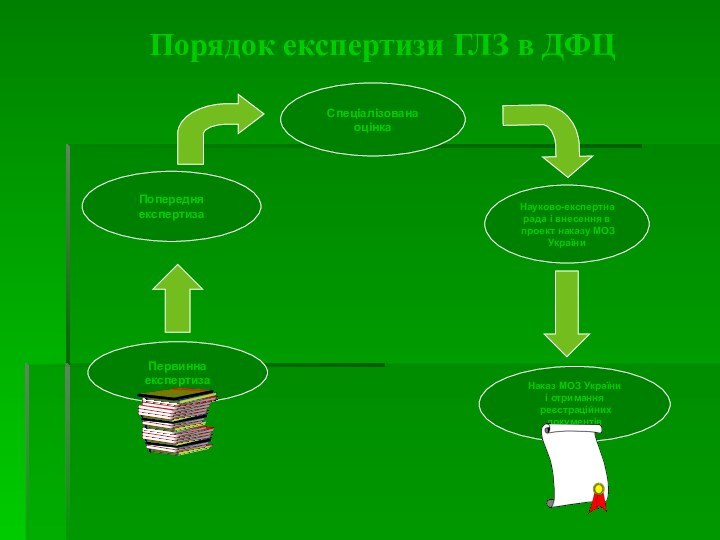
Первинна
експертиза заявки на предмет винесення мотивованого заключення про можливість реєстрації (перереєстрації) ЛЗ.
За її результатами складається угода про проведення експертизи, вартість якої визначається у встановленому порядку, в залежності від типу заявки.
Попередня експертиза, метою якої є перевірка відповідності наданих реєстраційних матеріалів, встановленим вимогам з точки зору повноти обєму і правильності оформлення. Термін проведення 15 днів.
При наявності зауважень заявник може допрацювати РД у відповідності з зауваженнями ДФЦ протягом 90 календарних днів у випадку реєстрації і 15 календарних днів у випадку перереєстрації.
Спеціалізована оцінка реєстраційних матеріалів та результатів додаткових експертиз (досліджень) ЛЗ з метою складання мотивованих висновків відносно безпеки і якості ЛЗ і рекомендації або не рекомендації його до державної перереєстрації
Спеціалізована експертиза
РО мають право :
прийняти рішення про проведення
додаткової експертизи даних, наведених у реєстраційних матеріалах, на їх відтворюваність;
Вимагати надання додаткових матеріалів відносно ефективності, безпеки і якості лікарського засобу (інструкцію для медичного застосування, PSUR, МКЯ і т.д.)
При отриманні від РО зауважень до реєстраційних матеріалів спеціаліст ВР протягом 1 дня робить запит у відповідні підрозділи, проводить експертизу внесених зауважень і протягом 10 днів надає відповідь у РО (СРП AR.RD.RA.Req.01.SOP).
При непредставленні протягом 90 днів в ДФЦ допрацьованих матеріалів або листа з обґрунтуванням термінів, необхідних для їх доопрацювання, ЛЗ знімається з розгляду.
При відсутності зауважень ЛЗ отримує рекомендації, відносно реєстрації/перереєстрації і вноситься в проект Наказу МОЗ (термін підписання 1 міс.) .
Мета і терміни експертизи РД
в регуляторних органах (1)
Слайд 17
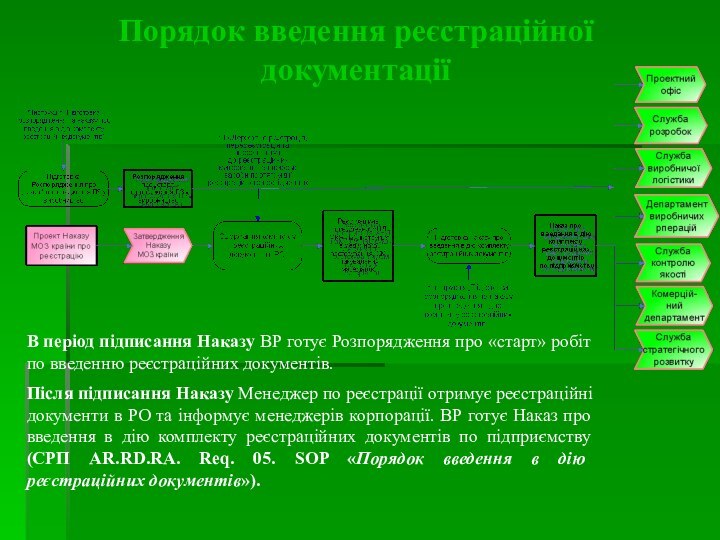
В період підписання Наказу ВР готує Розпорядження про
«старт» робіт по введенню реєстраційних документів.
Після підписання Наказу Менеджер
по реєстрації отримує реєстраційні документи в РО та інформує менеджерів корпорації. ВР готує Наказ про введення в дію комплекту реєстраційних документів по підприємству (СРП AR.RD.RA. Req. 05. SOP «Порядок введення в дію реєстраційних документів»).
Порядок введення реєстраційної документації
Слайд 18
Склад реєстраційного досьє у форматі CTD
(Модуль 3 Якість/Фармацевтична
розробка)
Слайд 19
1. Note for Guidance on Pharmaceutical Development.

– EMEA/СHМР/167068/2004 – ICH (ICH Topic Q8). – May
2006. – 9 p.
2. Настанова 423.1:2004 Настанови з якості. Лікарські засоби. Фармацевтична розробка / М. Ляпунов, В. Георгієвський, О.Безугла та ін. – Київ, МОЗ України, 2004. – 16 с.
3. Note for Guidance on Quality of Modified Release Рroducts: A: Oral Dosage Forms. B: Transdermal Dosage Forms. Section 1 (Quality). –СPMP/QWP/604/96. – 1999. – 15 p.
4. Guideline on the Pharmaceutical Quality of Inhalation and Nasal Products. – EMEA/CHMP/QWP/49313/2005 corr. – London, 16 February 2005. – 25 p.
5. Guideline on Quality of Herbal Medicinal Products / Traditional Herbal Medicinal Products. – CPMP/QWP/2819/00 (EMEA/CVMP/814/00). – 30 March 2006. – 11 p.
6. Настанова 423.2:2004 Настанови з якості. Лікарські засоби. Специфікації: контрольні випробування та критерії прийнятності. - Київ, МОЗ України, 2004. – 38 с.
7. Фармацевтический сектор: Общий технический документ для лицензирования лекарственных средств в ЕС/Под ред. А.В.Стефанова и др. – К.:МОРИОН, 2002. – 256 с.
Слайд 20
Thomas J. DiFeo. Drug Product Development. A Technical
Review of Chemistry, Manufacturing, and Control Information (…). Johnson&Johnson.
Drug Development and Industrial Pharmacy. Vol. 29, № 9, pp. 939-958, 2003.
В.Т. Чумак, О.П. Баула, Гос. Фармакологический центр МЗ Украины. Фармацевтическая разработка – залог качества генерических лекарственных препаратов. «Фармацевтическая промышленность», Москва, 2/2007, с. 30-34
А.П. Мешковский. Фармацевтическая разработка – связь с валидацией. Фармация, Москва, 1/2008, с.
Слайд 21
Мета:
1) Розглянути методологічний підхід до фармрозробки
(ICH Q8) лікарських засобів у взаємозв'язку з структурними елементами
реєстраційного досьє (CTD);
2) зрозуміти принципово які зміни у підходах до фармрозробки відбулись останнім часом і в чому полягають відмінності традиційної і «нової» регуляторних культур.
Слайд 22
Складові сучасної фармацевтичної розробки
Розробка лікарських препаратів повинна
базуватись на декількох складових:
на загальному методологічному підході до фармацевтичної
розробки (ICH Q8);
на вимогах до якості ЛЗ;
на медично-біологічних вимогах до ЛЗ;
на принципах і правилах забезпечення якості, зокрема - GMP;
на сучасному науковому рівні знань, який може включати результати власних фундаментальних досліджень і дані літератури;
на вичерпній інформації про діючі речовини, викладеній у Drug Master File (DMF);
на широкому асортименті допоміжних речовин і науковому підході до їх застосування.
Слайд 23
Головні структурні елементи
Керівництва ICH Q8 «Pharmaceutical Development»
1.
Компоненти лікарського препарату
1.1. Лікарська речовина
1.2. Допоміжні речовини
2. Лікарський препарат
2.1.
Розробка складу
2.2. Надлишки
2.3. Фізико-хімічні і біологічні властивості
3. Розробка виробничого процесу
4. Система контейнер/пакувальний елемент
5. Мікробіологічні властивості
6. Сумісність
По суті, це структура розділу 3.2.Р.2 «Фармацевтична розробка» модуля 3 реєстраційного досьє в форматі CTD, що частково дає відповідь на питання: «Навіщо потрібна фармацевтична розробка?»
Ні в одній цивілізованій країні лікарський препарат неможливо зареєструвати без звіту про фармацевтичну розробку, оскільки вона є структурним елементом реєстраційного досьє.
Слайд 24
ЗТД-МОДУЛЬ 3. Якість*
СTD-Module 3. Quality
3.2.S. Діюча
речовина
3.2.S.1. Загальна інформація
3.2.S.2. Виробництво
3.2.S.3. Характеристики
3.2.S.4. Контроль діючої речовини
3.2.S.5.
Стандартні зразки або речовини
3.2.S.6. Система пакування/укупорка
3.2.S.7. Стабільність
3.2.Р. Лікарський засіб
3.2.Р.1. Опис і склад
3.2.Р.2. Фармацевтична розробка
3.2.Р.3. Виробництво
3.2.Р.4. Контроль допоміжних речовин
3.2.Р.5. Контроль лікарського засобу
3.2.Р.6. Стандартні зразки і речовини
3.2.Р.7. Система пакування/укупорка
3.2.Р.8. Стабільність
Common Technical Document
* Додаток 3 Наказу № 426 від 02.08.2005
Слайд 25
CTD 3.2.Р.2 Фармацевтична розробка (1) Pharmaceutical Development
Розділ
досьє «Фармацевтичня розробка»
повинен містити інформацію,
яка б переконливо продемонструвала, що вибрана лікарська форма, запропонований склад і технологія виробництва препарату, задовольняють мету і цілі, вказані в заявці.
CTD 3.2.Р2.1 Компоненти лікарського засобу
Діючі речовини (CTD 3.2.Р.2.1.1)
- обгрунтування вибору;
- дані про сумісність діючої речовини з допоміжними речовинами;
- фізико-хімічні характеристики (розчинність, проникність, поліморфізм, розмір частинок, хіральність і т.д.)
Допоміжні речовини (CTD 3.2.Р.2.1.2)
- обгрунтування вибору;
- обгрунтування функцій;
- дані про сумісність допоміжних речовин
Слайд 26
CTD 3.2.Р.2.2 Лікарська форма
Розробка складу (CTD 3.2.Р.2.2.1)
- резюме по розробці складу і вибору лікарської форми;
- відмінності між кожним складом
Надлишки (CTD 3.2.Р.2.2.2)
Фізико-хімічні параметри і біологічні властивості (CTD 3.2.Р.2.2.3)
Технологічний процес (CTD 3.2.Р.2.3)
Обґрунтування вибору і оптимізація технологічного процесу;
Визначення критичних стадій і критеріїв прийнятності процесу виробництва;
Встановлення вимог до валідації;
Інформація про контроль в процесі виробництва;
Обґрунтування показників якості в специфікації готового лікарського засобу
CTD 3.2.Р.2 Фармацевтична розробка (2)
Pharmaceutical Development
Слайд 27
Мета фармацевтичної розробки
Мета фармацевтичної розробки – розробити продукт
відповідної якості + такий процес його виробництва, щоб постійно
випускати продукцію із заданими функціональними характеристиками.
Якість (відповідність ЛЗ своєму призначенню) не може бути перевірене в ГЛЗ, якість повинна бути закладена при розробці.
«Якість цілеспрямовано «вбудовується» в препарат, а не тестується» (ICH Steering Committee, 18 November 2004. Pharmaceutical Development Q8)
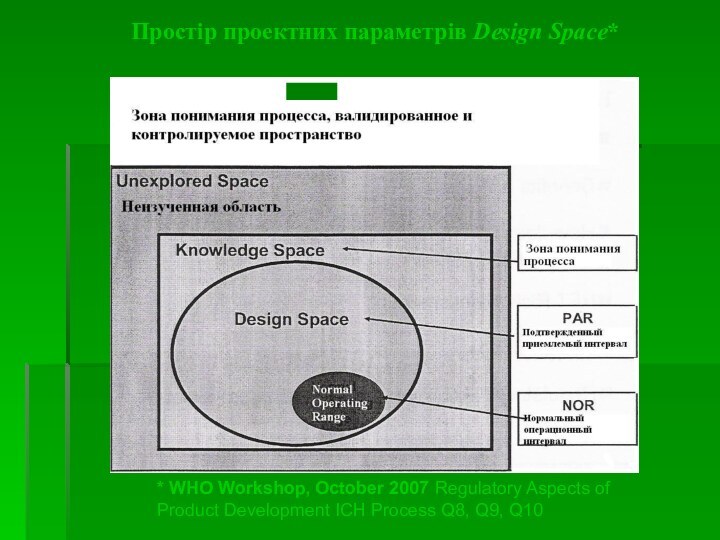
Інформація і знання, отримані в ході фармрозробки - основа для встановлення простору проектних параметрів (Design Space), специфікацій і виробничого контролю, а також для управління ризиками.
Слайд 28
Важливі поняття*
Простір проектних параметрів (design space) – це
багатофакторна комбінація і взаємодія вхідних змінних, а також параметрів
процесу, при яких доведено забезпечення якості.
Процесно-аналітична технологія (process analytical technology – PAT) – це система планування, аналізу и контролю виробництва шляхом періодичних вимірювань критичних показників якості і функціональних характеристик сировини, оброблюваних матеріалів і процесів з метою забезпечення якості ГЛЗ.
Стійкість процесу (process robustness) – здатність процесу допускати мінливість у матеріалах, а також зміни процесу та обладнання без негативного впливу на якість.
* ICH Steering Committee, 18 November 2004. Pharmaceutical Development Q8
Слайд 29
Простір проектних параметрів Design Space*
* WHO Workshop, October
2007 Regulatory Aspects of Product Development ICH Process Q8,
Q9, Q10
Слайд 30
Гнучкість сучасних регуляторних підходів
•
Вдосконалення виробничого процесу
в межах схваленого простору дизайну, описаного в досьє, без
подальшого розгляду ;
• Скорочення заявок на зміни заявлених реєстраційних умов;
• Перевірка якості в реальному часі веде до скорочення випробувань при випуску кінцевого продукту.
Слайд 31
Порядок вдосконалення процесів/якості
Фармацевтична система якості потребує
неперервного вдосконалення процесів і якості продукції:
Для покращення процесів застосовується
цикл PDCA:
Плануй (Plan) → Роби (Do) →
→ Перевіряй (Check) → Впливай (Act)
Післе того, як цикл PDCA пройдемо декілька разів, варіабельність процесів знижується і їхні результати обовязково покращуються.
Слайд 32
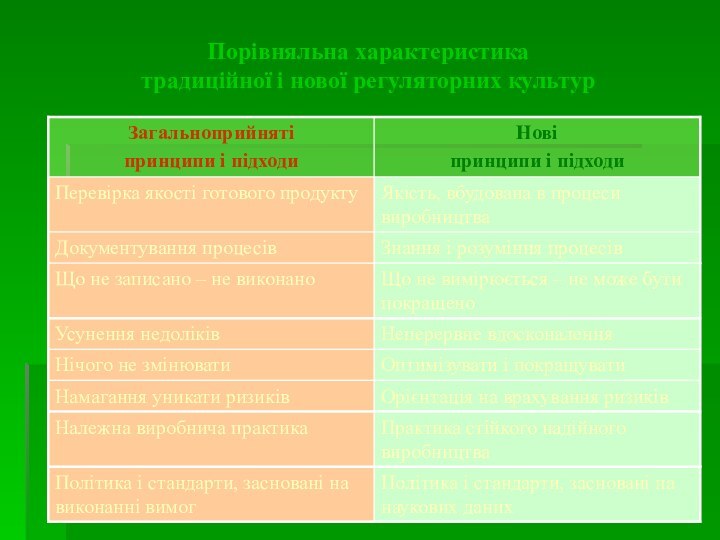
Порівняльна характеристика
традиційної і нової регуляторних культур
Слайд 33
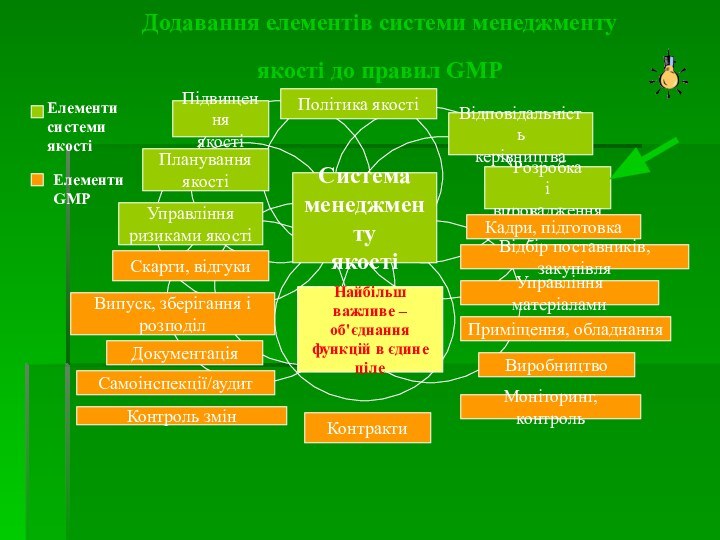
Додавання елементів системи менеджменту якості до правил GMP
Система
менеджменту
якості
Політика якості
Підвищення
якості
Відповідальність
керівництва
Розробка
і впровадження
Планування
якості
Управління
ризиками якості
Скарги, відгуки
Випуск, зберігання і
розподіл
Документація
Самоінспекції/аудит
Контроль змін
Контракти
Кадри, підготовка
Відбір поставників, закупівля
Управління матеріалами
Приміщення, обладнання
Виробництво
Моніторинг, контроль
Найбільш важливе –
об'єднання
функцій в єдине
ціле
Елементи
системи
якості
Елементи
GMP