Слайд 2
Стабильность как фактор качества лекарственных средств
Стабильность – способность
лекарственного средства сохранять химические, физические, микробиологические и биофармацевтические свойства
в определенных границах на протяжении срока годности.
Цель проведения испытаний стабильности – получение данных об изменении с течением времени качества действующего вещества или лекарственного средства под влиянием различных факторов окружающей среды, таких, как температура, влажность и свет, а также установление периодичности проведения повторных испытаний действующего вещества или срока хранения лекарственного средства и рекомендуемых условий хранения.
Срок хранения (срок годности) – период времени, в течение которого ЛС (как ожидается) соответствует утвержденной спецификации при хранении в условиях, указанных на упаковке.
Слайд 3
Типы стабильности лекарственных средств
Химическая стабильность – заявленное значение
содержания активного компонента находится в определенных пределах и сохраняет
свою химическую целостность.
Физическая стабильность – сохраняются исходные физические свойства, в т.ч. внешний вид, вкусовые качества, однородность, растворение.
Микробиологическая стабильность – стерильность или резистентность к росту м/о сохраняется в соответствии с определенными требованиями.
Терапевтическая (фармакологическая стабильность) – терапевтический эффект препарата не нарушен.
Токсикологическая стабильность – не происходит существенного увеличения токсичности препарата.
Слайд 4
Основные проблемы, связанные с потерей стабильности лекарственных средств
Снижение
эффективности
Снижение биодоступности
Контаминация микроорганизмами
Образование токсичных продуктов разложения
Изменение внешнего вида ЛС
Слайд 5
Факторы, влияющие на стабильность лекарственных средств
Основные физические факторы,
способствующие снижению стабильности ЛС в процессе хранения:
- температура
- влажность
-
свет
Слайд 6
Механизмы разложения лекарственных средств
Химическое разложение – образование новых
химических веществ (гидролиз, окисление, фотолиз, дегидратация).
Физическое разложение – уменьшение
количества действующего вещества без образования новых химических веществ.
Биологическое/микробиологическое разложение – разложение компонентов ЛС в результате жизнедеятельности живых организмов.
Слайд 7
Способы предотвращения разложения (стабилизации) лекарственных средств:
- физические –
изолирование от влияния внешних факторов (герметичная упаковка, специальные покрытия);
-
химические - введение веществ, предотвращающих или замедляющих химические процессы, приводящие к разложению (стабилизаторы);
- антимикробные - соблюдение асептических условий производства, стерилизация.
Слайд 8
Основные документы, регламентирующие проведение исследований стабильности ЛС
Руководство по
качеству. Лекарственные средства. Испытания стабильности.
Руководства ICH:
- Q1A (R2) «Испытания
стабильности новых лекарственных веществ и препаратов»
- Q1C «Испытания стабильности новых дозированных форм»
- Q1D «Брекетинг и построение матриц при испытании стабильности новых лекарственных веществ и препаратов»
- Q1E «Оценка данных испытаний стабильности»
- Q1В «Испытания стабильности: испытания фотостабильности новых лекарственных веществ и препаратов».
Слайд 9
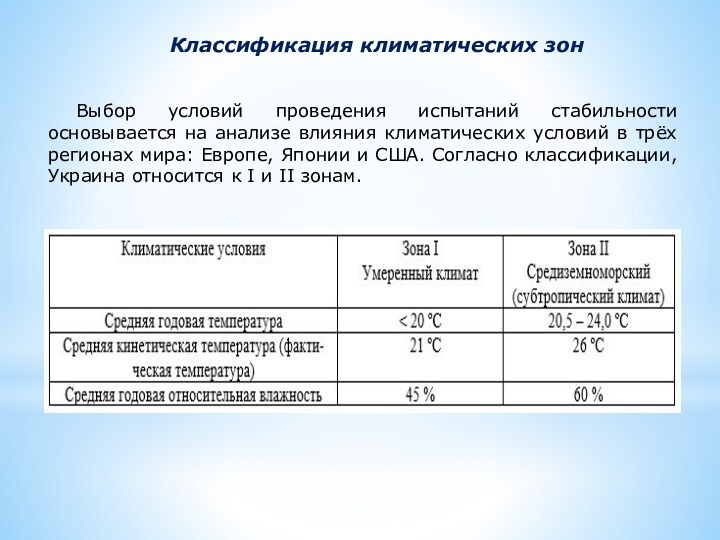
Классификация климатических зон
Выбор условий проведения испытаний стабильности основывается
на анализе влияния климатических условий в трёх регионах мира:
Европе, Японии и США. Согласно классификации, Украина относится к I и II зонам.
Слайд 10
Испытания стабильности лекарственных средств
Методы испытания стабильности ЛС:
- стрессовые
испытания;
- ускоренные испытания;
- испытания в реальном времени (долгосрочные испытания).
Слайд 11
Стрессовые испытания – испытания стабильности в стресс-условиях, проводимые
с целью исследования вынужденного процесса разложения (установления продуктов и
механизмов разложения).
Условия испытаний:
- температура, превышающая температуру при ускоренных испытаниях с последовательным её повышением на 10 ºС (50 ºС, 60 ºС и т.д.);
- влажность 75 % и выше;
- окисление и фотолиз;
- кислотный и щелочной гидролиз (при необходимости);
- светостабильность.
Проводят на 1-й серии АФИ, в основном на этапе фармразработки.
Слайд 12
Ускоренные испытания или испытания стабильности методом «ускоренного старения»
- проводят для интенсификации химического разложения или провоцирования физических
изменений АФИ или ГЛС с помощью гипертрофированных условий хранения.
В предрегистрационный период – для получения данных, подтверждающих результаты исследований в реальном времени, что дает основание установить более длительный первоначальный срок годности, чем тот, который подтвержден данными долгосрочного хранения.
В пострегистрационный период – для предварительного подтверждения возможности изменений утвержденных условий производства (прописи, технологии, переноса площадки и т.п.).
Условия испытаний:
- температура на 10-15 ºС выше предполагаемой температуры хранения;
- влажность – повышенная (по сравнению с нормальными условиями хранения).
Слайд 13
Долгосрочные испытания – испытания стабильности при рекомендованных условиях
хранения в течении периода до проведения повторных испытаний или
срока хранения.
Слайд 14
Выбор условий хранения и частоты тестирования
Условия хранения АФИ
и ГЛС:
- продукты, предназначенные для хранения при комнатной температуре
(общий случай);
- продукты, предназначенные для хранения в холодильнике;
- продукты, предназначенные для хранения в морозильной камере (-20 ºС и ниже).
Периодичность проверки показателей стабильности при сроке годности ЛС (для долгосрочных испытаний):
- до 1-го года – через каждые 3 месяца;
- в течении 2-го года – каждые 6 месяцев и затем ежегодно в течение предлагаемого срока хранения.
Слайд 15
Схема решений при оценке
данных для установления периода до повторных испытаний или срока
хранения действующих веществ или лекарственных средств (за исключением лекарственных препаратов, предназначенных для хранения в морозильной камере), где: Y — предложенный период до проведения повторных испытаний или срок хранения; X — продолжительность долгосрочных испытаний, для которых имеются данные.
Слайд 16
Как рассчитать срок годности?
Срок годности С при температуре

хранения tхр. связан с экспериментальным сроком годности СЭ при
повышенной температуре экспериментального хранения tэ следующей зависимостью:
где коэффициент соответствия
Приведенная зависимость основана на правиле Вант-Гоффа о 2-4-кратном росте химических реакций при увеличении температуры на 10 ºС.
Температурный коэффициент скорости химической реакции А принимают равным 2,5.
В таблице приведены значения коэффициентов соответствия К для различных значений разности температур экспериментального и обычного хранения при А = 2,5.
Таблица – Значения коэффициентов соответствия К
Если промежуток времени Со между датой производства/изготовления лекарственного средства и началом его экспериментального хранения превышает 30 суток (но не более 90 суток), и оно в это время хранилось в обычных условиях, расчет срока годности С проводят по уравнению C = K × Cэ + Cо.
При необходимости tхр., позволяющую обеспечить заданный срок годности С, рассчитывают по формуле:
Слайд 17
Испытания стабильности существующих действующих веществ
Выбор серий: не менее
2-х промышленных серий или 3 опытно-промышленных серий, произведенных с
помощью такого же способа производства и процедуры, что планировалось для промышленного производства.
Продолжительность долгосрочных и ускоренных испытаний должна составлять, по меньшей мере, 6 месяцев на момент подачи заявления о регистрации.
Данные, полученные по результатам ускоренного хранения и, если применимо, хранения в промежуточных условиях, допускается использовать в целях оценки влияния кратковременных отклонений за пределы заявленных условий хранения (которые возможны при транспортировке).
Слайд 18
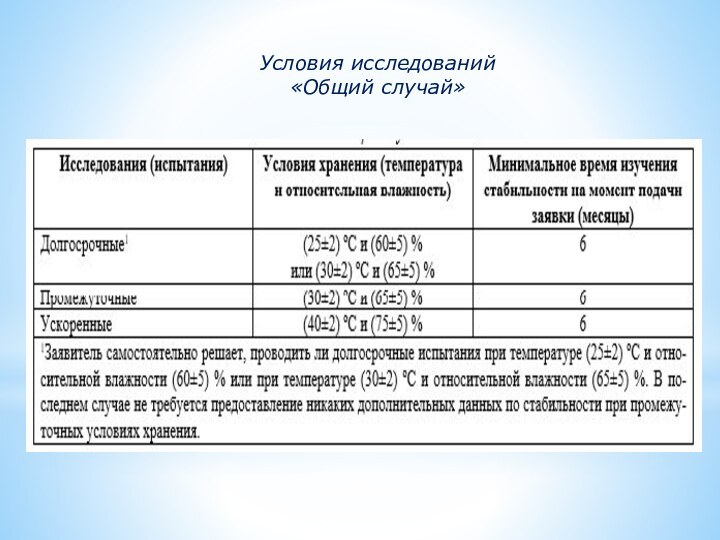
Условия исследований
«Общий случай»
Слайд 19
Испытания стабильности лекарственных средств, произведенных из известных действующих
веществ
Выбор серий:
а) не менее 2-х опытно-промышленных серий в случае
стандартных ЛФ (например, твердые ЛФ с немедленным высвобождением, растворы);
б) не менее 3-х серий (2-е из которых должны быть опытно-промышленными, 3-я может быть меньшей) для критических ЛФ, если известно, что они нестабильны.
Серии ЛС, если возможно, необходимо производить с использование разных серий АФИ.
Испытания светостабильности должны быть проведены как min на 1-й первичной серии ЛС.
Испытания стабильности должны быть представлены для каждой индивидуальной дозировки, вида и вместимости упаковки ЛС, за исключением случаев, когда применяют выбор крайних вариантов или матричный метод.
Слайд 20
На момент подачи заявления о регистрации продолжительность долгосрочных
исследований должна составлять, по меньшей мере, 6 месяцев для
варианта а) или 12 месяцев для варианта б).
Для оценки влияния кратковременных отклонений за пределы заявленных условий хранения (которые возможны при транспортировке) допускается использовать данные, полученные по результатам ускоренного хранения и, если применимо, хранения в промежуточных условиях.
Слайд 21
Условия исследований
«Общий случай»
Слайд 22
Определение срока годности для однодозовых ЛС, прошедших переупаковку

Перефасовка в однодозовую упаковку возможна только для твердых и
жидких лекарственных препаратов предназначенных для орального применения.
Расфасовка может осуществляться производителями и переупаковщиками, а также больницами, коммунальными аптеками или учреждениями по совместному обслуживанию.
Проводить испытания стабильности для нестерильных твердых и жидких ЛС для орального применения, которые вторично разфасованы в однодозовую упаковку не требуется, если выполняются следующие условия:
Указана дата истечения срока годности, которая не превышает 1 года с даты перефасовки или же дата окончания срока годности, указанная на упаковке, в которую был первоначально расфасован препарат (берется более ранняя из 2-х дат).
Тара, предназначенная для расфасовки на один прием должна соответствовать стандарту класса А, описанному в Фармакопеи США.
Оригинальная упаковка ЛС не была раннее вскрыта и все ее содержимое перефасовывалось за одну технологическую операцию.
Условия, при которых осуществляется перефасовка и хранение ЛС, должно соответствовать требованиям, указанным на этикетки исходной упаковки.
Слайд 23
Планирование испытаний стабильности
Сокращенный план (как правило) используется, при
проведении предварительного испытания стабильности.
Исследование крайних вариантов
План изучения стабильности, при
котором во всех временных точках по полному протоколу тестируются только образцы препарата с крайними вариантами факторов.
Варианты факторов: дозировки (состав ЛС должен быть пропорционален), вместимость контейнера и/или номинальный объем.
Слайд 24
Пример плана исследования крайних вариантов
Слайд 25
Матричное планирование
Метод исследования стабильности, при котором в определенный
момент времени исследованиям подвергается только подгруппа из общего числа
проб всех комбинаций факторов.
Факторы, по которым возможна группировка образцов
различные:
- серии
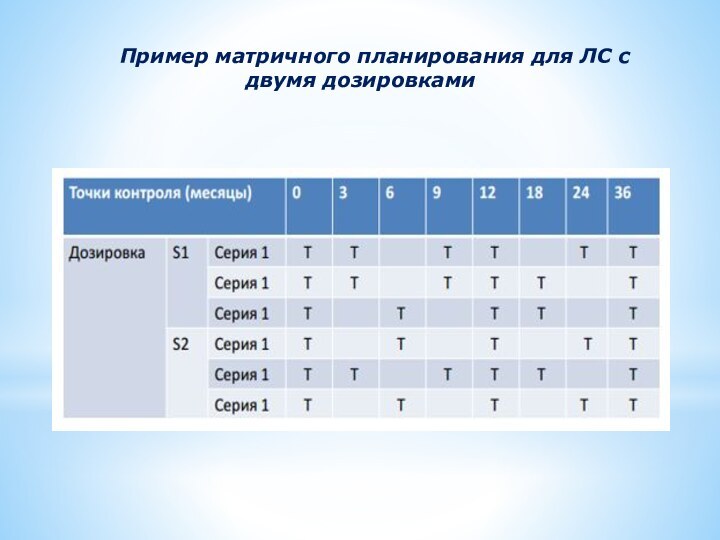
- дозировки с пропорциональным составом
- вместимости контейнеров и (или) номинальные объемы при одной и той же системе контейнер-укупорка
В полном объеме все факторы должны быть проанализированы не менее чем в 3-х временных точках, включая первую и последнюю.
Слайд 26
Пример матричного планирования для ЛС с двумя дозировками
Слайд 27
Экстраполяция
Способ получения информации о будущих данных на основе
имеющихся.
Экстраполяцию допускается произвести в целях увеличения периода повторных исследований
и срока годности сверх долгосрочных данных, особенно если при ускоренном хранении не наблюдались значительные изменения.
Предлагаемый период повторных исследований или срок годности допускается увеличить не более чем в 2 раза, но не более чем на 12 месяцев по сравнению с периодом, охваченным долгосрочными данными.
Период повторных исследований или срока годности, полученный на основании экстраполяции, необходимо во всех случаях верифицировать дополнительными долгосрочными данными по мере получения последних.
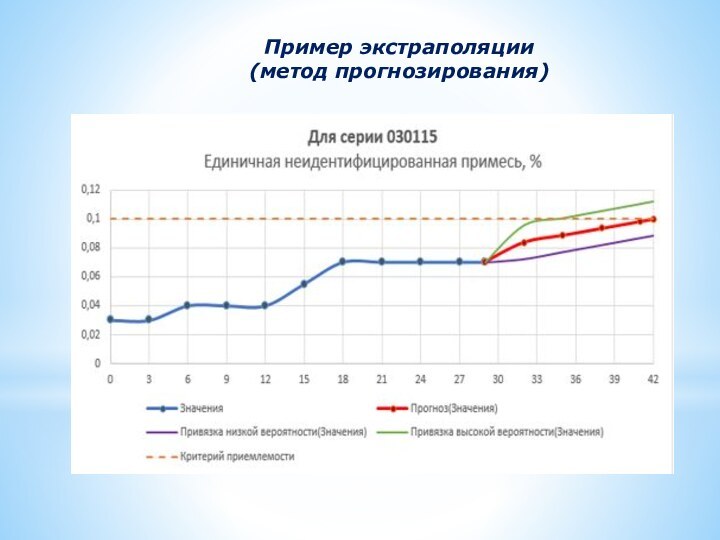
Слайд 28
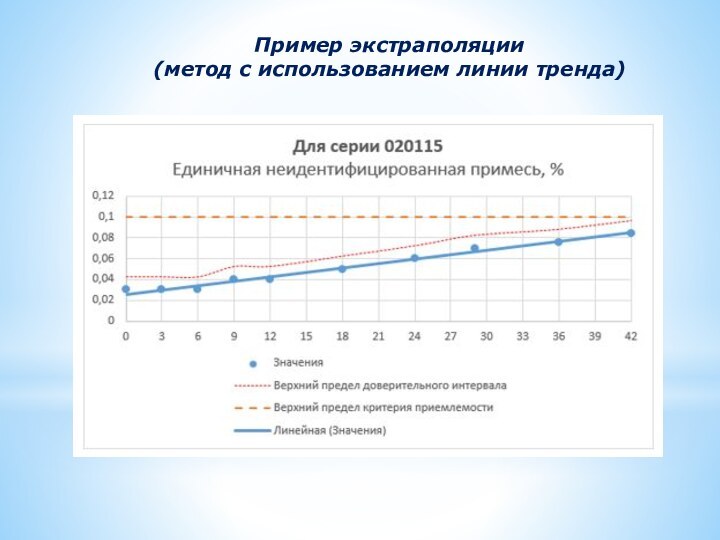
Пример экстраполяции
(метод с использованием линии тренда)
Слайд 29
Пример экстраполяции
(метод прогнозирования)