- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Загальна характеристика родини Iridoviridae
Содержание
- 2. “Назва походить від імен богів веселки у
- 3. IridoviridaeВперше виявлені у 1954 р.у личинці багатоніжкиВірус розповсюджений по всьому світі
- 4. Кристалоподібні скупчення в клітинах уражених комах. Така “упаковка” вірусу надає комахам блакитного кольору, що опалесціює.
- 5. IridoviridaeВиявлені у безхребетних та деяких хребетних (не
- 6. Iridoviridae
- 7. Нуклеокапсид діаметром 125-300 нм, складається з 72 капсомерів. Основний капсидний білок - МСР.Морфологія вірусних часток
- 8. Будова віріонуВіріони складаються із трьох концентричних структур:зовнішнього
- 9. Геном Геном – лінійна 2л ДНК, 150 дo 280 тис.п.о.Наявні термінальні повторів та циклічні перестановки
- 10. Геном Геном містить близько 100 відкритих рамок
- 11. Білки У структурі віріону виявляють від 25
- 12. Ліпіди входять до складу внутрішнього шару. Їх
- 14. Фізико-хімічні властивості Віруси дуже стабільні до умов зовнішнього
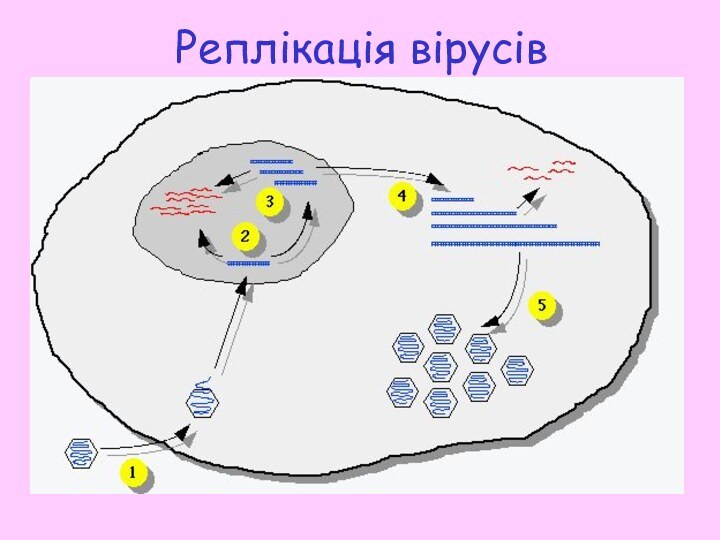
- 15. Реплікація вірусів
- 16. Вірусні частки проникають у середину клітини шляхом
- 17. 1 етап реплікації здійснюється в ядрі інфікованої
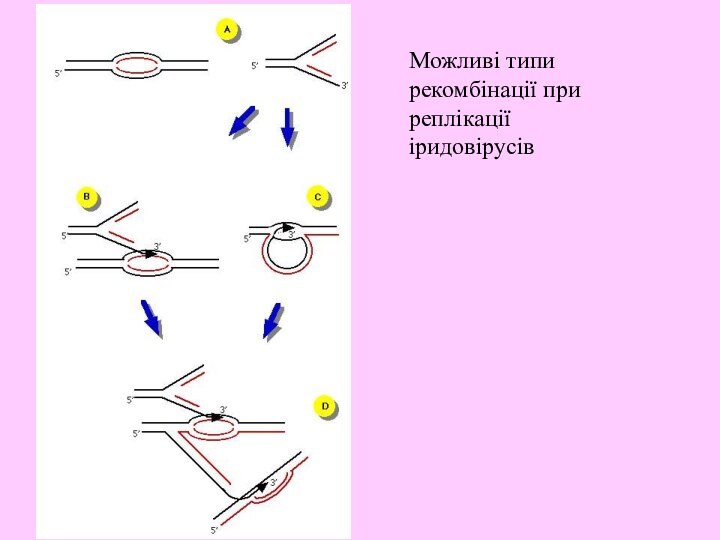
- 19. Можливі типи рекомбінації при реплікації іридовірусів
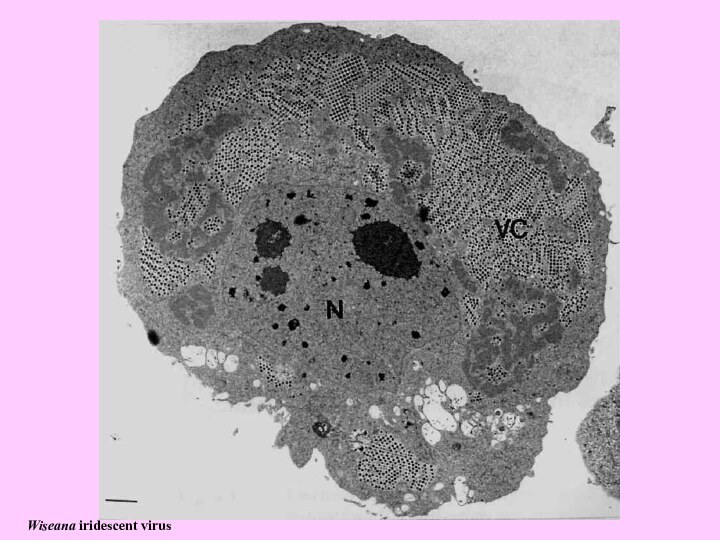
- 20. Wiseana iridescent virus
- 21. Симптоми хворобХронічні або ураження легкого ступеня (лізис,
- 22. ПатогенезПатогенез – температурозалежний процес. Іридовіруси у чорної
- 23. Симптоми захворювання1. Контроль (ін’єкція водою)2. Інапарантна інфекція3. Ранні симптоми4. Пізня стадія інфекції, обумовленої IIV-6
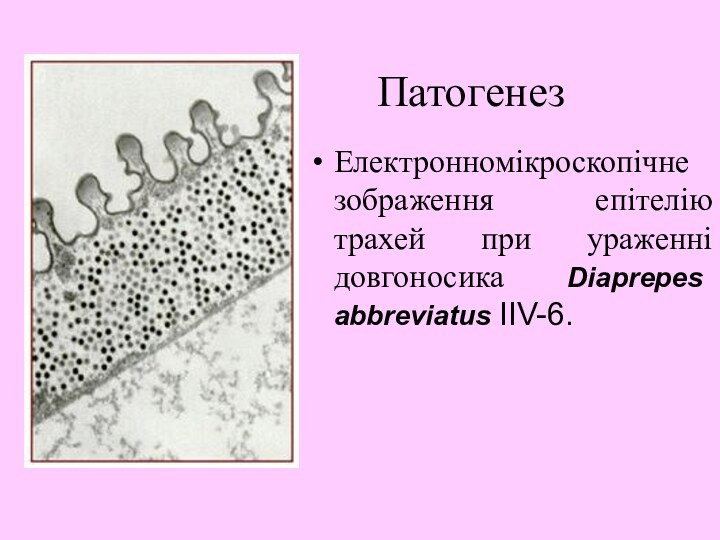
- 24. Патогенез Електронномікроскопічне зображення епітелію трахей при ураженні довгоносика Diaprepes abbreviatus IIV-6.
- 25. Патогенез При летальній інфекції комах початковими місцями
- 26. ЕпідеміологіяПередача:ГоризонтальнаВертикальна Віруси передаються за допомогою води, на пір’ї та дзьобах птахів, за рахунок канібалізму
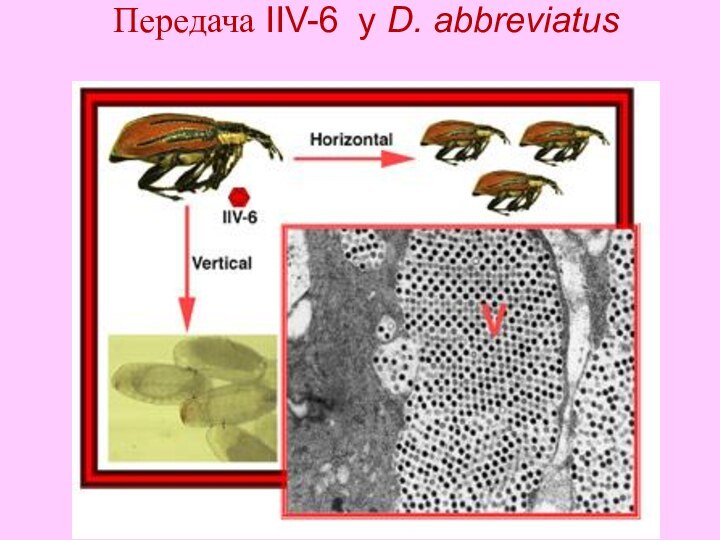
- 27. Передача IIV-6 у D. abbreviatus
- 28. Можливе застосуваннякомахи: біоконтроль У комах вірус був
- 29. Хребетні: аквакультура, тваринництво, зоопарки;Передача – контактним шлях
- 30. CимптомиПроявляються на всіх стадіях розвитку амфібій:У пуголовків-
- 31. Іридовіруси RanavirusУражуються жаби, саламандри та інші амфібії.
- 32. Ranavirus виділений з морського окуня Epinephelus tauvina (Сингапур)
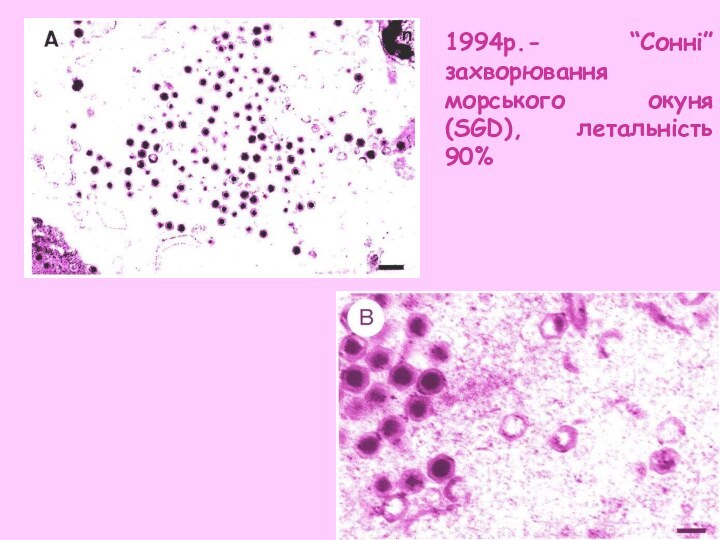
- 33. 1994р.- “Сонні”захворювання морського окуня (SGD), летальність 90%
- 34. Лімфоцистит LDCV-1 викликає хронічну контагіозну хворобу багатьох видів морських та прісноводних риб.
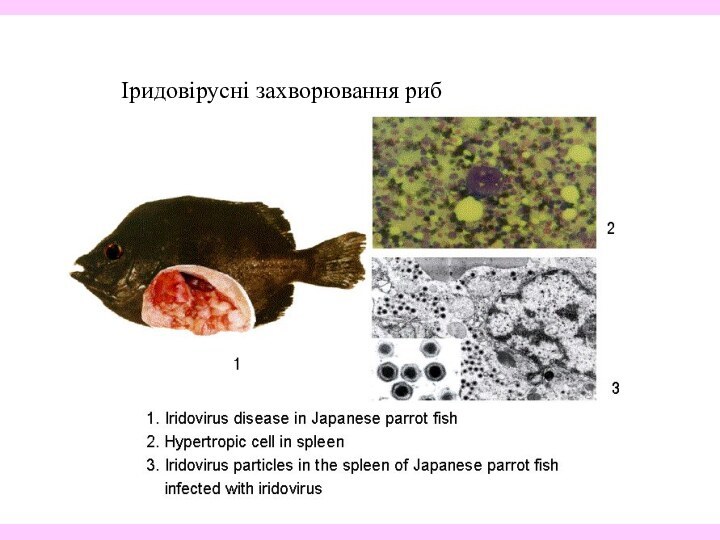
- 36. Іридовірусні захворювання риб
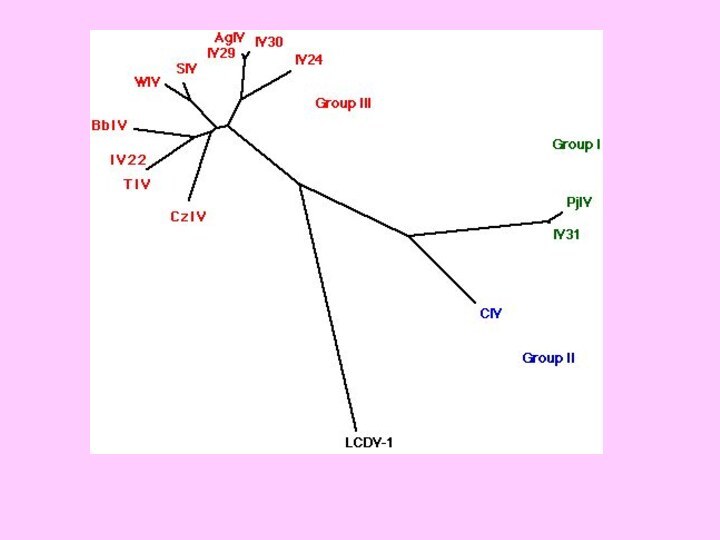
- 37. Географічне розповсюдження
- 38. ДіагностикаВибір методу діагностики інфекції, спричиненої іридовірусами визначається епізоотичною ситуацією з врахуваннями клінічних та патолого-морфологічних даних.
- 39. Діагностика Іридовірусні інфекції деяких комах, зокрема комарів
- 40. Скачать презентацию
- 41. Похожие презентации
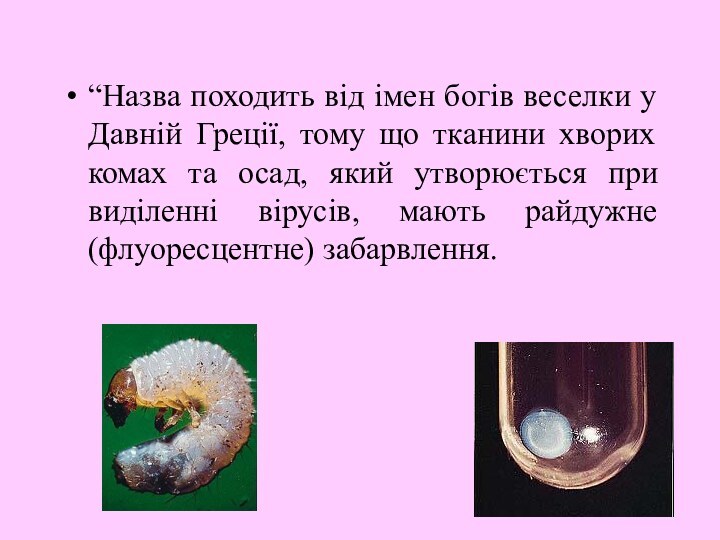
“Назва походить від імен богів веселки у Давній Греції, тому що тканини хворих комах та осад, який утворюється при виділенні вірусів, мають райдужне (флуоресцентне) забарвлення.



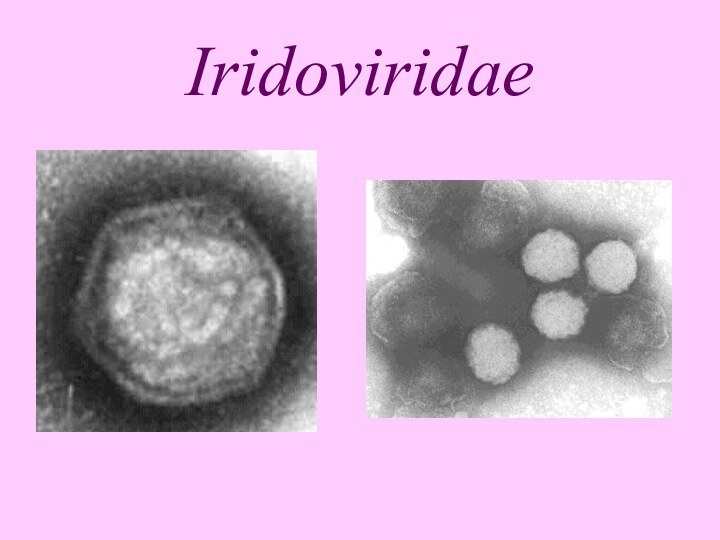




















Слайд 3
Iridoviridae
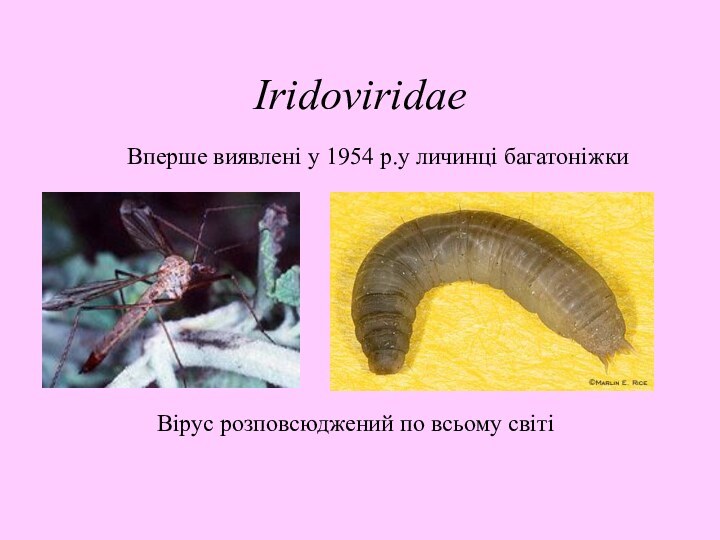
Вперше виявлені у 1954 р.у личинці багатоніжки
Вірус розповсюджений
по всьому світі
Слайд 4 Кристалоподібні скупчення в клітинах уражених комах. Така “упаковка”
вірусу надає комахам блакитного кольору, що опалесціює.
Слайд 5
Iridoviridae
Виявлені у безхребетних та деяких хребетних (не ссавців)
1. Рід Chloriridovirus – великі іридісцентні віруси комах, іридісцентний
вірус безхребетних 3 (IV 3), іридовірус москітів (IV 13);2. Рід Iridovirus – дірібні іридісцентні віруси комах (багато видів комах) – іридісцентний вірус безхребетних 1, 2, 6, 9, 10, 16, 17, 18, 21, 22, 23, 24, 28, 29, 30, 31, 32, іридісцентний вірус Chilo (IV6), іридовірус личинки Costelytra zaelandica та ін.;
3. Рід Lymphocystivirus – вірус лімфоцитарної хвороби (лімфоцистозу) риб (LCDV-1, 2);
4. Рід Megalocystivirus – вірус інфекційного некрозу печінки, вірус ляща Червоного моря, іридовірус сонної хвороби морського окуня, іридовірус тайванського морського окуня та ін.;
5. Рід Ranavirus – вірус жаби 3 (FV3), вірус епізоотичного гемопоетичного некрозу, вірус європейського сома, вірус леопардової жаби, вірус тритону Люке 1, вірус тигрової амбістоми та ін.
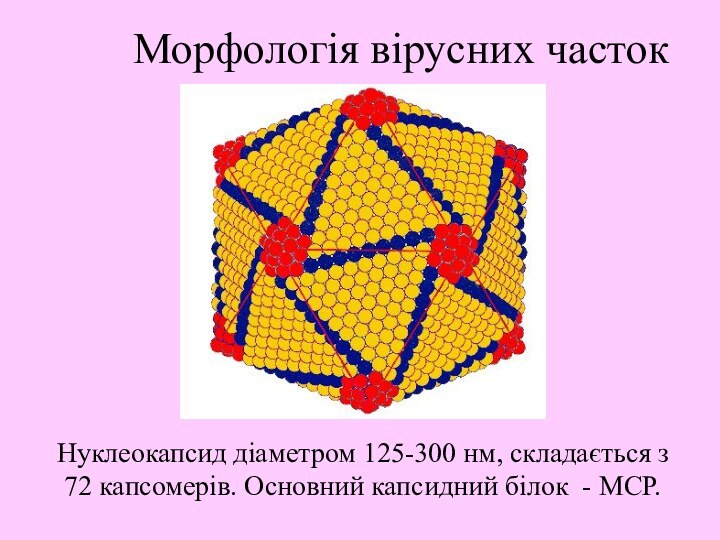
Слайд 7 Нуклеокапсид діаметром 125-300 нм, складається з 72 капсомерів.
Основний капсидний білок - МСР.
Морфологія вірусних часток
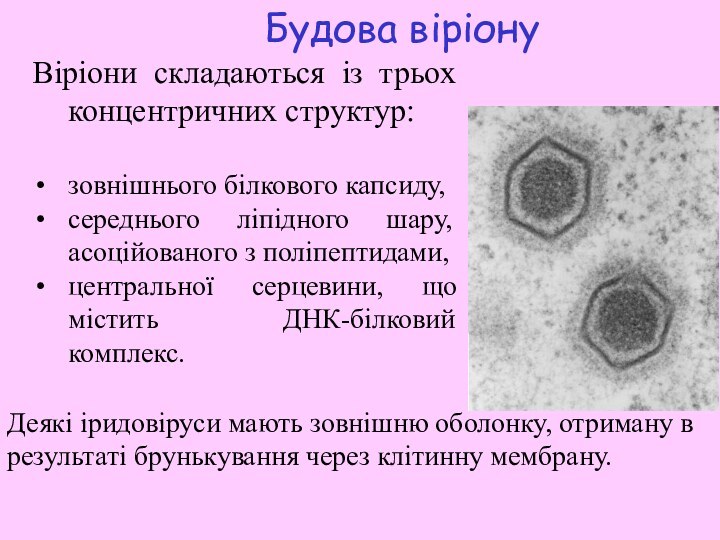
Слайд 8
Будова віріону
Віріони складаються із трьох концентричних структур:
зовнішнього білкового
капсиду,
середнього ліпідного шару, асоційованого з поліпептидами,
центральної серцевини,
що містить ДНК-білковий комплекс. Деякі іридовіруси мають зовнішню оболонку, отриману в результаті брунькування через клітинну мембрану.
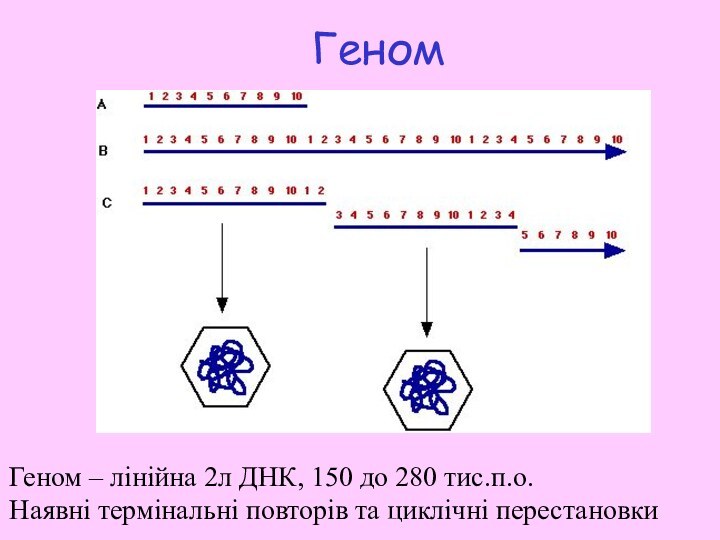
Слайд 9
Геном
Геном – лінійна 2л ДНК, 150 дo
280 тис.п.о.
Наявні термінальні повторів та циклічні перестановки
Слайд 10
Геном
Геном містить близько 100 відкритих рамок зчитування
на обох ланцюгах ДНК. Високий рівень метилювання ДНК попереджує
її активну транскрипцію, проте білкові фактори, що містяться у віріоні, ініціюють синтез ранніх мРНК за допомогою клітинної ДНК-зал-РНК-пол ІІ.
Слайд 11
Білки
У структурі віріону виявляють від 25 до
75 структурних білків, які мають М від 12 до
15 кДа. Загальною властивістю для усіх іридовірусів є наявність мажорного білку, масою 50 кДа, що складає до 45% загальної маси білка.Мінімум 6 білків зв'язані з вірусною ДНК, але основним білковим компонентом нуклеоїда є р12,5.
Віріонні ферменти: протеїнкіназа, протеїнфосфатаза, нуклеотидфосфогідролаза, рибонуклеаза, рН5- та 7,5 –дезоксирибонуклеаза.
Слайд 12 Ліпіди входять до складу внутрішнього шару. Їх вміст
становить від 3 до 14% маси віріону. Структура та
склад ліпідів віріону та клітинних мембран відрізняється. Отже, ліпіди не є дериватами клітинних мембран, включеними у віріони.
Слайд 14
Фізико-хімічні властивості
Віруси дуже стабільні до умов зовнішнього середовища,
поза організмом хазяїна Стабільні в широкому діапазоні рН (4-12),
“переживають” зиму на дні озер. Інактивуються органічними розчинниками.Слайд 16 Вірусні частки проникають у середину клітини шляхом ендоцитозу,
після цього наступає стадія роздягання.
Вірусна ДНК транспортується до ядра
клітини, де припиняються усі реплікативні та транскрипційні процеси. Вірусна транскрипція ініціюється модифікованою вірусом клітинною РНК полімеразою ІІ.Батьківська ДНК використовується як матриця для реплікації, проте в її процесі синтезуються ланцюги значно більші за розміром ніж вихідна ДНК. Ці довгі молекули стають матрицями для цитоплазматичної реплікації.
ДНК нащадків транспортується до цитоплазми, де великі конкатомери вірусної ДНК піддаються рекомбінації. Транскрипція великих транскриптів також може мати місце у цитоплазмі.
Конкатомери розрізаються до потрібної для упакування довжини, можливо за рахунок механізму заповнення віріону. Віріони звільняються із клітини за рахунок брунькування через плазматичну мембрану чи у результаті лізису клітини.
Слайд 17 1 етап реплікації здійснюється в ядрі інфікованої клітини:
синтез копій геному, неповних з 5’-кінця кожного ланцюга (оскільки
сайти ініціації реплікації знаходяться не на самому краю 3’-кінця). Неповні копії геному можуть бути використані або для продовження транскрипції ранніх мРНК, або транспортуються у цитоплазму, де відбувається 2 етап.2 етап реплікації – формування з неповних копій геному довгих конкатомерів, з яких потім вірусні нуклеази вирізають фрагмент, що відповідає віріонній ДНК з повними фланкуючими послідовностями.
Цитоплазматичний етап відбувається у спеціалізованих нуклеопротеїдних “фабриках”.
Реплікація вірусів
Слайд 21
Симптоми хвороб
Хронічні або ураження легкого ступеня (лізис, виразки),
Збільшення клітин деяких органів.
Виявляються проблематично.
У комах: іридисцентні плями
У риб: збільшення плавального міхура, втрата рівноваги
У амфібій: може викликати ураження хвоста пуголовка
Слайд 22
Патогенез
Патогенез – температурозалежний процес. Іридовіруси у чорної мухи
Simulium spp. викликають дві форми інфекції:
приховану (інапарантну) та гостру
(летальну), відсоток кожної залежить від умов зовнішнього середовища та щільності хазяїв у угрупованнях.
Слайд 23
Симптоми захворювання
1. Контроль (ін’єкція водою)
2. Інапарантна інфекція
3. Ранні
симптоми
4. Пізня стадія інфекції, обумовленої IIV-6
Слайд 24
Патогенез
Електронномікроскопічне зображення епітелію трахей при ураженні довгоносика
Diaprepes abbreviatus IIV-6.
Слайд 25
Патогенез
При летальній інфекції комах початковими місцями реплікації
вірусів є жирові тіла та гемоцити (що в кінцевому
рахунку і призводить до летальної інфекції). Комахи стають слабкими та опалесцеюють через 7-10 діб після інфекції, хоча загибель відбувається через 3 тижні та більше від ураження.
Слайд 26
Епідеміологія
Передача:
Горизонтальна
Вертикальна
Віруси передаються за допомогою води,
на пір’ї
та дзьобах птахів, за рахунок канібалізму
Слайд 28
Можливе застосування
комахи: біоконтроль
У комах вірус був виділений
з мошок (Similiidae), хрущика японського (Popillia japonica), совки бавовняної,
рисової совки, коників, москітів та бджіл
Слайд 29
Хребетні: аквакультура, тваринництво, зоопарки;
Передача – контактним шлях (при
контакті з хворими тваринами та інфікованими предметами).
Риби: системні захворювання
(домашні рибки), лосось (лосось та форель), сом, окуньРептилії : коробчаста черепаха( Cuora ), гофер ( Gopherus ), зелений деревний пітон
Амфібії: жаба –бик ( Rana catesbiana ), прудова жаба ( Rana esculenta ), леопардова жаба (Rana pipiens), тигрова амбістома ( Ambystoma tigrinum ), зеленуватий тритон ( Notophthalmus viridescens )
*через подібні симптоми захворювання серед риб, амфібій та рептилій, один з представників цих класів може бути резервуаром чи носієм вірусів для інших видів в одному середовищі.
Можливе виявлення
Слайд 30
Cимптоми
Проявляються на всіх стадіях розвитку амфібій:
У пуголовків- зниження
активності, асцит, вогнищеві крововиливи
У молодих тварин - зниження активності,
анасарка (водянка шкіри), асцит, вогнищеві крововиливи, смерть ;У дорослих тварин - зниження активності, утворення виразок на шкірі, вогнищеві крововиливи, смерть.
Іридовірус жаб (FV3)
Слайд 31
Іридовіруси
Ranavirus
Уражуються жаби, саламандри та інші амфібії.
Північно
Американський вид тігрової саламандри Ambystoma tigrinum під загрозою вимирання.
Слайд 34
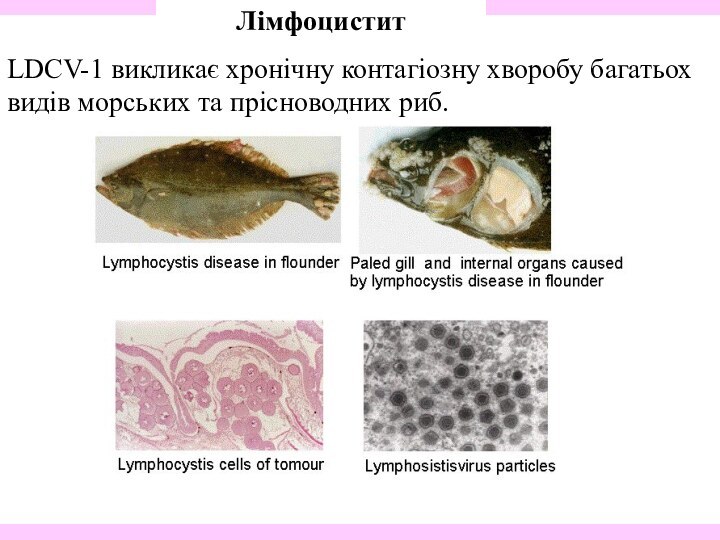
Лімфоцистит
LDCV-1 викликає хронічну контагіозну хворобу багатьох видів
морських та прісноводних риб.
Слайд 38
Діагностика
Вибір методу діагностики інфекції, спричиненої іридовірусами визначається епізоотичною
ситуацією з врахуваннями клінічних та патолого-морфологічних даних.
Слайд 39
Діагностика
Іридовірусні інфекції деяких комах, зокрема комарів та
мошок, легко виявляти за характерним райдужним забарвленням тіла та
методом кольорових осадів.Обстеження органів (селезінка, нирки) мертвих тварин.
Окрім зазначеного методу для діагностики іридовірусів комах використовують метод біопроби, світлову мікроскопію (виявлення специфічних цитоплазматичних включень), електронну мікроскопію та серологічні методи (МФА, РІД, РЗК, латекс аглютинація, РІА та ІФА).
Для виділення іридовірусів застосовують різни типи культур клітин безхребетних.