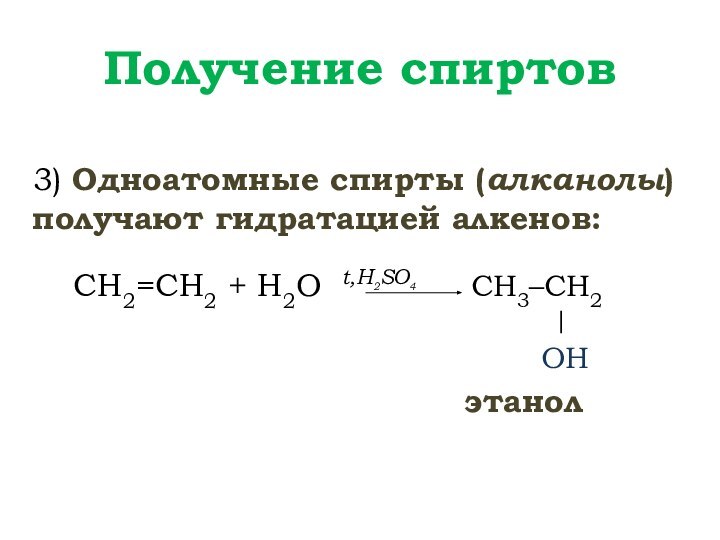
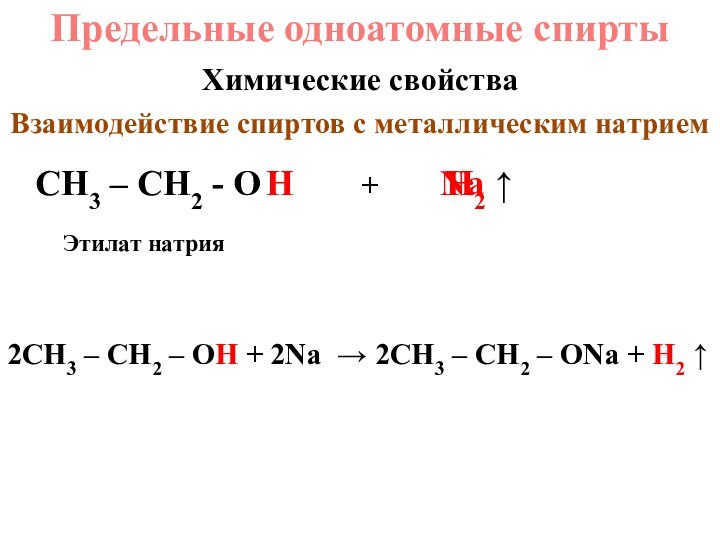
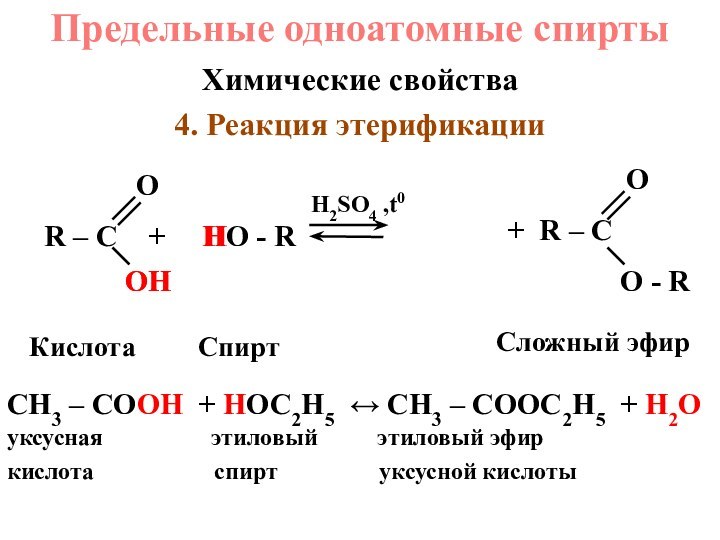
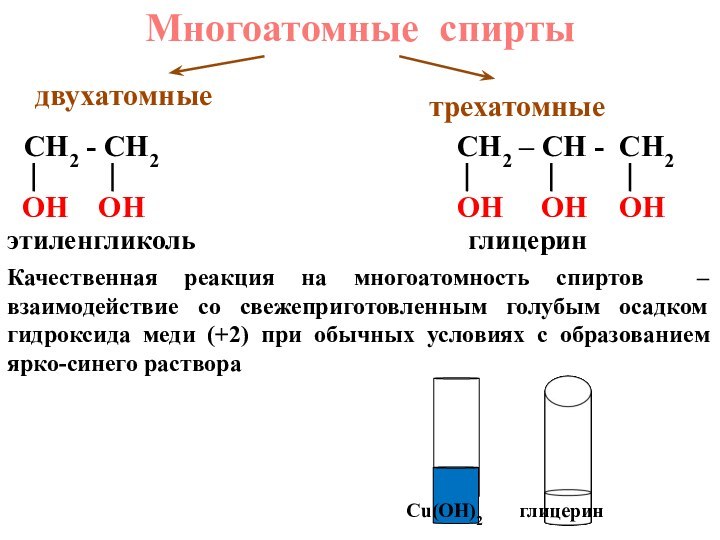
+ 1 OH или R – OH,
где R- углеводородный
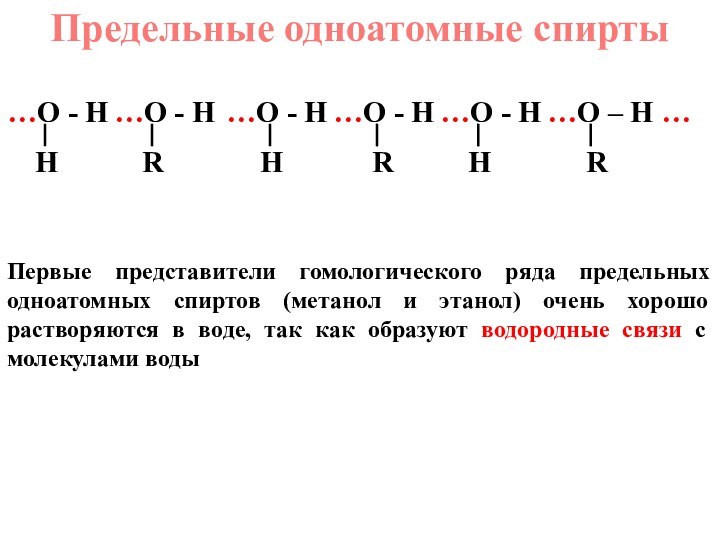
радикалЭто органические соединения, в молекулах которых углеводородный радикал связан с функциональной гидроксильной группой (гидроксо-группой)
СН3ОН метанол (метиловый спирт)
СН3СН2ОН этанол (этиловый спирт)




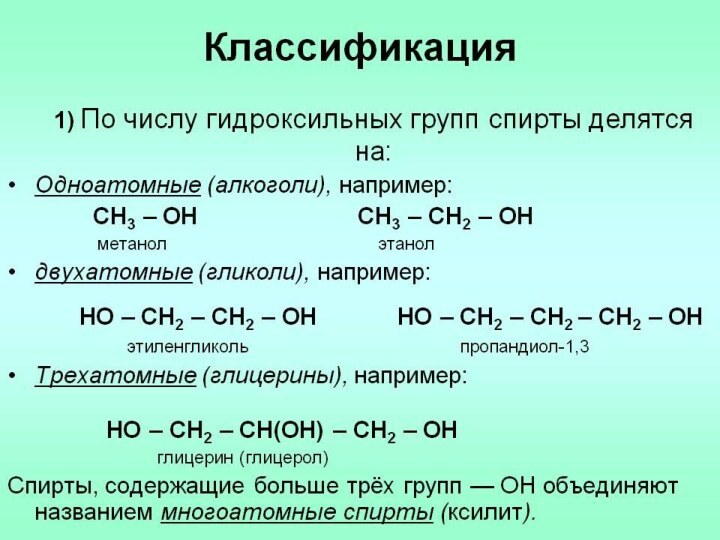



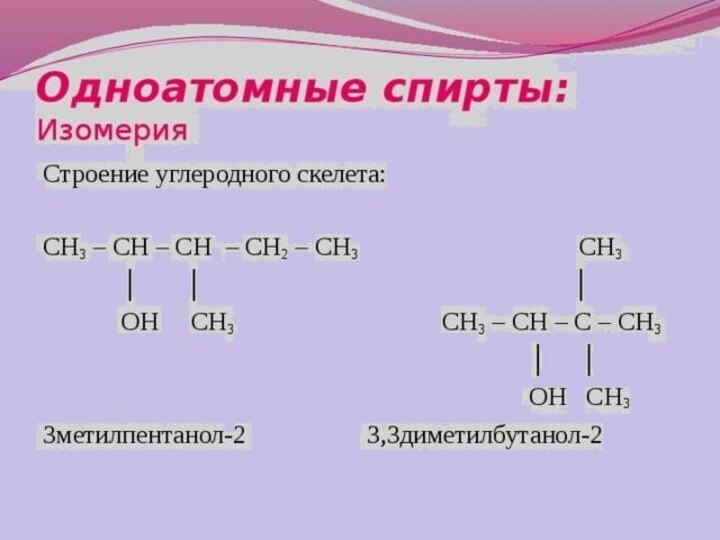



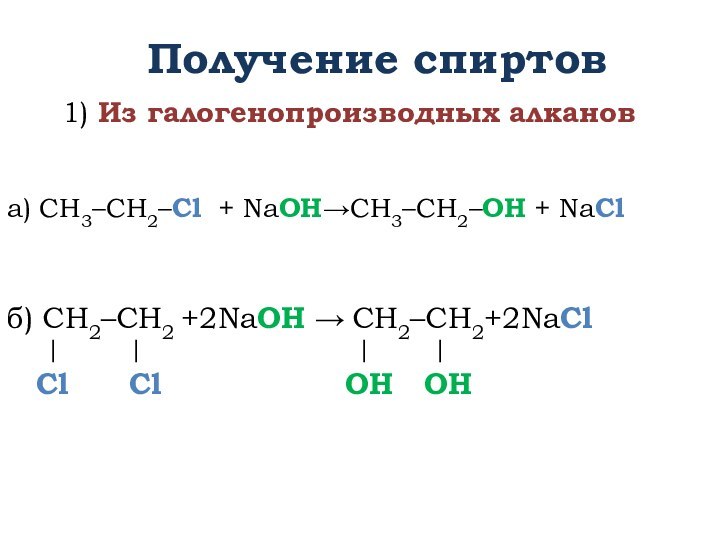
![Презентация к УМК Габриеляна к уроку химии в 10 классе по теме Спирты Получение спиртов2) Двухатомные спирты (гликоли) получают окислением алкенов: СН2=СН2 + [O] +](/img/tmb/13/1218543/2d4807540f206c3535bae921a4054a49-720x.jpg)