Слайд 2
Реальный газ
Газ, свойства которого зависят от взаимодействия
молекул.
Силы межмолекулярного взаимодействия
Силы взаимодействия между молекулами и
атомами газа, не приводящие к образованию химических соединений.
Эти силы — короткодействующие проявляются на расстояния
< 10-9 м).
Слайд 3
Критерием различных агрегатных состояний вещества является соотношение между
величинами Пmin и kT; Пmin — наименьшая потенциальная энергия
взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (r = r0); kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул.
Слайд 4
Газообразное состояние вещества
Вещество находится в газообразном состоянии,
так как интенсивное тепловое движение молекул препятствует соединению молекул,
сблизившихся до расстояния r0, т. е. вероятность образования агрегатов из молекул достаточно мала.
Слайд 5
Твердое состояние вещества
Вещество находится в твердом состоянии,
так как молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблются около положений равновесия, определяемых расстоянием r0
Слайд 6
Жидкое состояние вещества
Вещество находится в жидком состоянии,
так как в результате теплового движения молекулы перемещаются в
пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее r0.
Слайд 7
Вывод. Любое вещество, в зависимости от температуры, может
находиться в газообразном, жидком или твердом агрегатном состоянии, причем
температура перехода из одного агрегатного состояния в другое зависит от значения Пmin для данного вещества.
Например, у инертных газов П min мало, а у металлов велико поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
Слайд 8
Поправки, вносимые при рассмотрении реальных газов
1 Учет собственного
объема молекул
Наличие сил отталкивания, которые противодействуют проникновению в
занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, a
Vm – b,
где b – объем, занимаемый самими молекулами.
Объем b – равен учетверенному собственному объему молекул.
Слайд 9
2 Учет притяжения молекул
Действие сил притяжения газа
приводит к появлению дополнительного давления на газ, называемого внутренним
давлением р'.
[а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения; Vm — молярный объем]
Слайд 11
Определение поправок (а и b) Ван-дер-Ваальса
Записывают уравнения
Ван-дер-Ваальса для двух известных из опыта состояний газа, которые
решаются относительно а и b.
Слайд 13
Критическая изотерма
Изотерма, на которой наблюдается лишь одна
точка перегиба.
Критическая температура
Температура Тк, соответствующая
критической изотерме.
Критическая
точка
Точка перегиба К на критической изотерме.
Критические объем и давление
Объем VK и давление pк, соответствующие критической точке К.
Критическое состояние
Состояние с критическими параметрами (рк, VK, ТК).
Слайд 14
Определение критических параметров
Слайд 15
Изотермы Ван-дер-Ваальса при Т > Тк
При Т
> Тк изотерма реального газа отличается от изотермы идеального
газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой.
Слайд 16
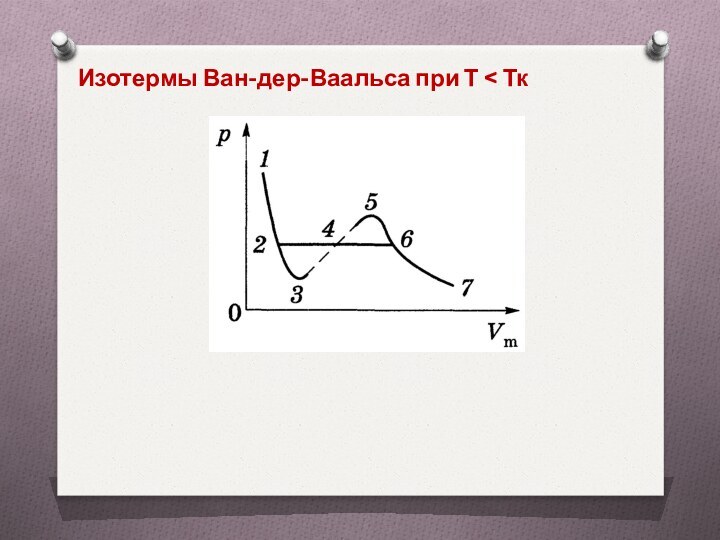
Изотермы Ван-дер-Ваальса при Т < Тк
Слайд 17
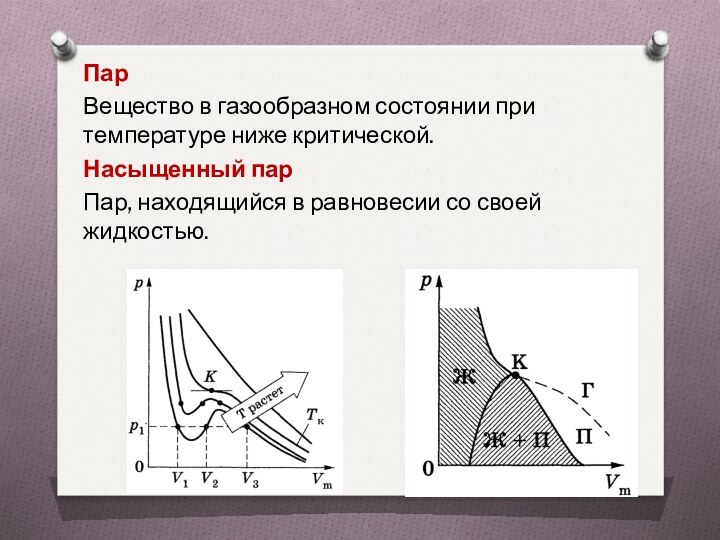
Пар
Вещество в газообразном состоянии при температуре ниже
критической.
Насыщенный пар
Пар, находящийся в равновесии со своей
жидкостью.
Слайд 18
Внутренняя энергия реального газа. Равна сумме кинетической энергии
хаотического теплового движения молекул и их взаимной потенциальной
энергии П.
Кинетическая энергия хаотического движения молекул. Свойства большинства реальных газов близки к свойствам идеального, если они находятся при температурах, когда можно пренебречь взаимодействием молекул, и потому эта составляющая внутренней
энергии определяется внутренней
энергией для идеального газа.
Слайд 19
Взаимная потенциальная энергия молекул реального газа
Потенциальная энергия
реального газа обусловлена только силами притяжения между молекулами.
Внутренняя
энергия 1 моль реального газа
Внутренняя энергия растет с повышением температуры и увеличением давления.
Слайд 20
♦ Равенство U1 — U2 формально справедливо как
для идеального, так и реального газов, но результат, получаемый
при его применении, для обоих случаев совершенно различен.
Слайд 22
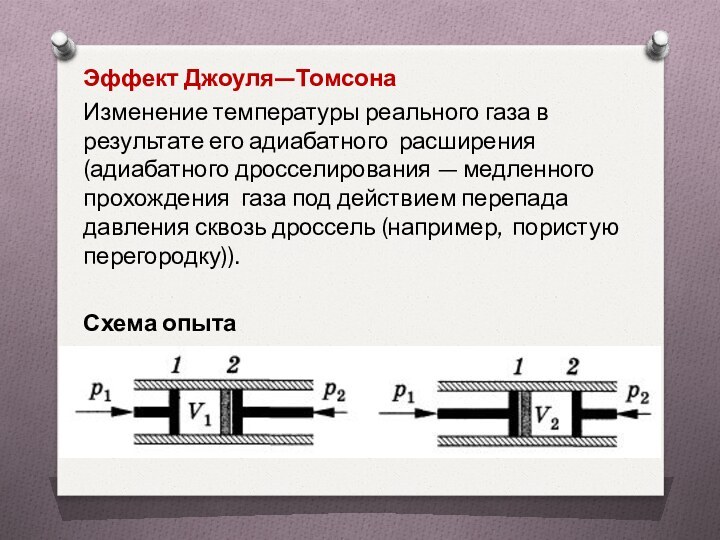
Эффект Джоуля—Томсона
Изменение температуры реального газа в результате
его адиабатного расширения (адиабатного дросселирования — медленного прохождения газа
под действием перепада давления сквозь дроссель (например, пористую перегородку)).
Схема опыта
Слайд 26
Вывод. Знак разности Т2 – Т1 зависит от
того, какая из поправок Ван-дер-Ваальса играет большую роль.
Слайд 27
Эффект Джоуля—Томсона
положительный T < 0 (газ в
процессе дросселирования охлаждается).
отрицательный T > 0 (газ в
процессе дросселирования нагревается).
Эффект Джоуля—Томсона обусловлен отклонением газа от идеальности.
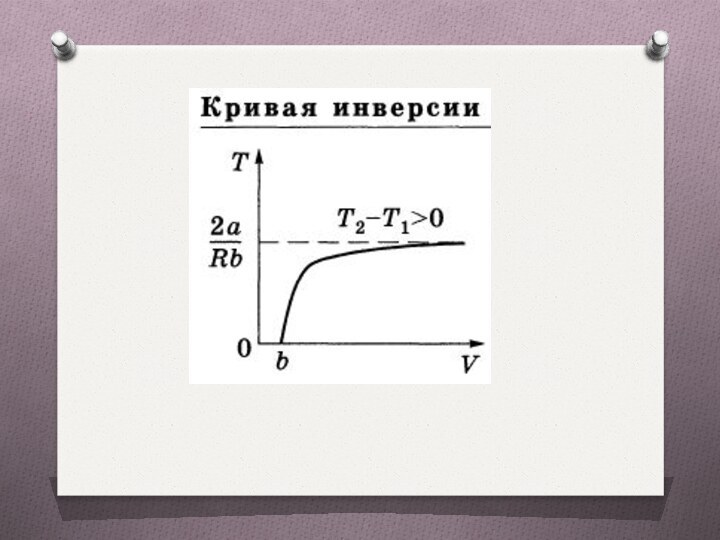
Температура инверсии
Температура, при которой (для данного давления) происходит изменение знака эффекта Джоуля—Томсона. В зависимости от условий дросселирования для одного и того же газа эффект Джоуля—Томсона может быть как положительным, так и отрицательным.
Слайд 30
Поведение жидкостей
Жидкость — агрегатное состояние вещества, промежуточное
между газообразным и твердым, поэтому она обладает свойствами как
газообразных, так и твердых веществ.
Жидкости, подобно твердым телам, обладают определенным объемом, а подобно газам, принимают форму сосуда, в котором они находятся.
В жидкостях имеет место так называемый ближний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на расстояниях, сравнимых с межатомными.
Слайд 31
Согласно Френкелю, каждая молекула в течение некоторого времени
колеблется около определенного положения равновесия, после чего скачком переходит
в новое положение, отстоящее от исходного на расстоянии порядка межатомного.
Таким образом, молекулы жидкости довольно медленно перемещаются по всей массе жидкости и диффузия происходит гораздо медленнее, чем в газах.
С повышением температуры жидкости частота колебательного движения резко увеличивается, возрастает подвижность молекул, что, в свою очередь, является причиной уменьшения вязкости жидкости.
Слайд 32
Радиус (r) и сфера молекулярного действия
Расстояние (порядка
10-9 м), при котором можно пренебречь силами притяжения между
молекулами жидкости. Сфера радиусом r называется сферой молекулярного действия.
Молекулярное (внутреннее) давление
Давление, оказываемое на жидкость результирующими силами всех молекул поверхностного слоя.
Слайд 33
Поверхностная энергия
Дополнительная энергия, которой обладают молекулы в
поверхностном слое жидкости.
Слайд 34
Силы поверхностного натяжения
Силы, направленные по касательной к
поверхности жидкости и перпендикулярные участку контура (на рисунке рассмотрена
поверхность жидкости, ограниченная замкнутым контуром), на который они действуют, и стремящиеся сократить поверхность до минимума.
Слайд 37
Определение смачивания
Явление искривления свободной поверхности жидкости при
соприкосновении жидкости с поверхностью твердого тела.
Смачивание определяется характером
сил, действующих между молекулами поверхностных слоев соприкасающихся тел.
Слайд 40
Давление под искривленной поверхностью жидкости
Давление, обусловленное силами
поверхностного натяжения и оказываемое на нижележащие слои жидкости со
стороны поверхностного слоя.
Это избыточное (добавочное) давление положительно для выпуклой поверхности, и отрицательно — для вогнутой.
Избыточное давление под искривленной поверхностью жидкости
Слайд 41
Формула Лапласа
Общая формула, определяющая избыточное давление для
произвольной поверхности жидкости двоякой кривизны.
[R1 и R2 —
радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в данной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости]
Слайд 45
Твердые тела
Агрегатные состояния вещества, характеризующиеся постоянством формы
и объема, причем тепловые движения частиц в них представляют
собой хаотические колебания частиц относительно положений равновесия.
Кристаллические тела
Твердые тела, имеющие упорядоченное, периодически повторяющееся расположение частиц (атомов, молекул, ионов).
Кристаллическая решетка
Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях.
Слайд 46
Монокристаллы
Твердые тела, частицы которых образуют единую кристаллическую
решетку.
Внешняя форма монокристаллов одного вида может быть различной,
но углы между соответствующими гранями постоянны — закон постоянства углов, сформулированный Ломоносовым. Монокристаллами являются большинство минералов.
Слайд 47
Анизотропия монокристаллов
Зависимость физических свойств — упругих, механических,
тепловых, электрических, магнитных, оптических — от направления.
Объясняется тем,
что плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристаллов вдоль этих направлений.
Слайд 48
Поликристаллы
Твердые тела, имеющие мелкокристаллическую структуру, т. е. состоящие
из множества беспорядочно ориентированных кристаллических зерен (например, горные породы,
металлы, сплавы).
Изотропия поликристаллов
В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.
Изотропны аморфные твердые тела которые представляют собой переохлажденные жидкости.
Слайд 49
Аморфные твердые тела и их свойства
Твердые тела,
физические свойства которых одинаковы по всем направлениям (наблюдается изотропия
свойств).
Для аморфных твердых тел, как и для жидкостей, характерен ближний порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления.
Слайд 50
Полимеры
Органические аморфные тела, молекулы которых состоят из
большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными)
связями.
Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5—10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии.
Слайд 51
Признаки классификации кристаллов
Кристаллографический признак кристаллов
В данном
случае важна только пространственная периодичность в расположении частиц, поэтому
можно отвлечься от их внутренней структуры, рассматривая частицы как геометрические точки.
Физический признак кристаллов
В данном случае важна природа частиц, расположенных в узлах кристаллической решетки, и характер сил взаимодействия между ними.
Слайд 52
Симметрия кристаллической решетки
Свойство решетки совмещаться с собой
при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях
или их комбинациях и т. д. Кристаллической решетке присущи 230 комбинаций элементов симметрии, или 230 различных пространственных групп. Эти 230 групп разбиваются по признакам симметрии на 32 класса.
Слайд 53
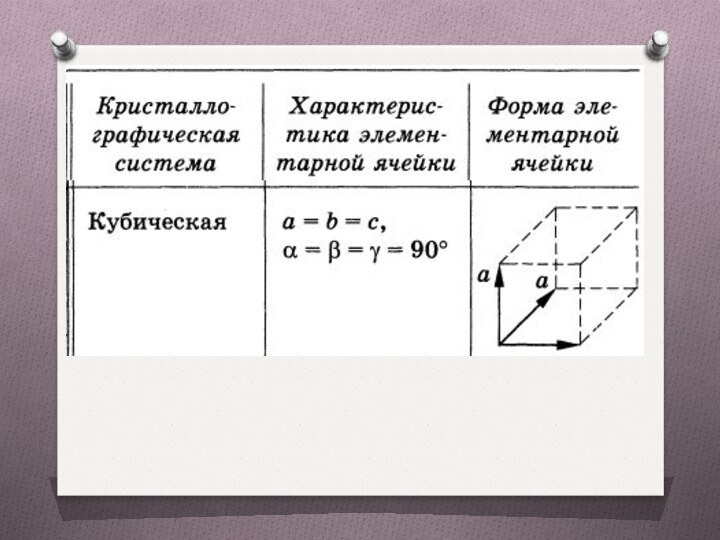
Кристаллографические системы (сингонии)
Признак деления кристаллов по форме
элементарной ячейки.
Всякая пространственная решетка может быть составлена повторением
в трех различных направлениях элементарной решетки. Существует семь кристаллографических систем, каждая из которых включает в себя несколько классов симметрии.
Слайд 58
Ионные кристаллы
В узлах кристаллической решетки поочередно располагаются
ионы противоположного знака.
Слайд 59
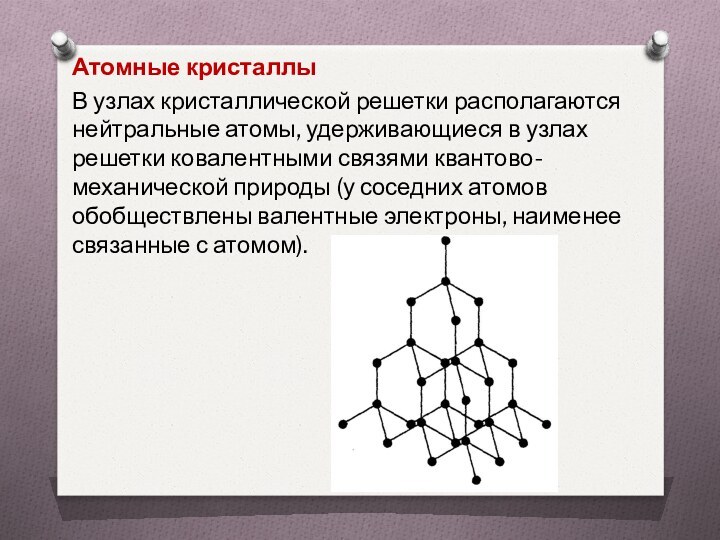
Атомные кристаллы
В узлах кристаллической решетки располагаются нейтральные
атомы, удерживающиеся в узлах решетки ковалентными связями квантово-механической природы
(у соседних атомов обобществлены валентные электроны, наименее связанные с атомом).
Слайд 60
Металлические кристаллы
В узлах кристаллической решетки располагаются положительные
ионы металла. При образовании кристаллической решетки валентные электроны, сравнительно
слабо связанные с атомами, отделяются от атомов и коллективизируются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, а всему кристаллу в целом.
Слайд 61
Молекулярные кристаллы
В узлах кристаллической решетки располагаются нейтральные
молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным
смещением электронов в электронных оболочках атомов.
Эти силы называются ван-дер-ваалъсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности.
Слайд 62
Координационное число
Число ближайших однотипных с данным атомом
соседних атомов в кристаллической решетке или молекул в молекулярных
кристаллах.
Для модельного изображения кристаллических структур пользуются системой плотной упаковки шаров. Правая упаковка более плотная. Различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой — 6.
Слайд 63
Модельное изображение кристалла поваренной соли (NaCl)
Если кристалл
построен из атомов различных элементов, то его можно представить
в виде плотной упаковки шаров разных размеров. Крупные ионы хлора ( r = 181 пм) образуют плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по размеру ионами натрия (r = 98 пм). Каждый
ион Na окружен шестью
ионами Сl, и, наоборот,
каждый ион Сl —
шестью ионами Na.
Слайд 64
Дефекты кристаллической решетки
Всякие отклонения от строгой периодичности
расположения частиц в узлах кристаллической решетки.
Дефекты делятся на
макроскопические и микроскопические.
Макроскопические дефекты
Дефекты, возникающие в процессе образования и роста кристаллов. К ним относятся всякого рода трещины, макроскопические пустоты, инородные макроскопические включения.
Микроскопические дефекты
Дефекты, обусловленные микроскопическими отклонениями от периодичности.
Слайд 65
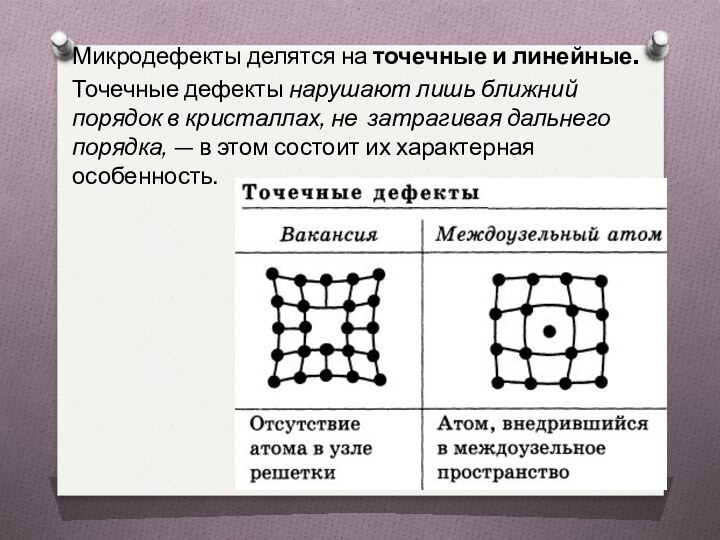
Микродефекты делятся на точечные и линейные.
Точечные дефекты нарушают
лишь ближний порядок в кристаллах, не затрагивая дальнего порядка,
— в этом состоит их характерная особенность.
Слайд 68
Линейные дефекты нарушают дальний порядок и в значительной
степени определяют механические свойства кристаллов.
Дислокации никогда не обрываются,
они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций.
Слайд 69
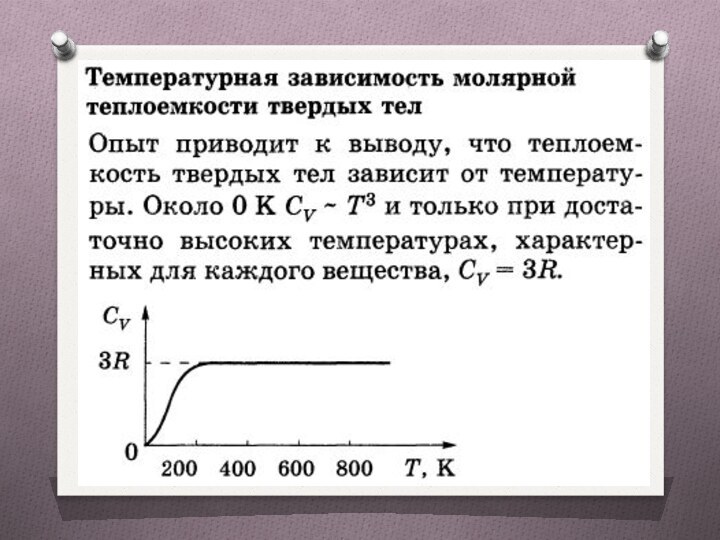
Модель твердого тела для определения теплоемкости
Правильно построенная
кристаллическая решетка, в узлах которой частицы (атомы, ионы, молекулы),
принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях.
Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы обладает энергией kT.
Слайд 74
Парообразование
Физический процесс, при котором вещество из жидкого
состояния при подведении теплоты переходит в газообразное состояние.
Теплота
парообразования
Количество теплоты, необходимое для перехода вещества из жидкого в газообразное состояние.
Температура парообразования
Температура
перехода жидкости
в газ.
Слайд 75
Удельная теплота парообразования
Количество теплоты, необходимое, чтобы перевести
1 кг жидкости при постоянной температуре в газообразное состояние.
Испарение
Парообразование, происходящее при любой температуре со свободной поверхности жидкости.
Сублимация (возгонка)
Физический процесс прямого перехода вещества из твердого состояния в газообразное, минуя жидкую фазу.
Процесс сублимации при обычных температурах незначителен, он активизируется с повышением температуры.
Слайд 76
Конденсация
Физический процесс, при котором вещество из газообразного
состояния с отдачей теплоты переходит в жидкое состояние.
Сравнение
характеристик при испарении и конденсации
Конденсация — процесс, компенсирующий испарение. Подведенное при испарении количество теплоты отдается веществом при конденсации:
Температура кипения определенного вещества при постоянном давлении равна температуре конденсации:
Температура кипения повышается с увеличением давления.
Слайд 77
Плавление
Физический процесс, при котором вещество из кристаллического
(твердого) состояния при подведении теплоты переходит в жидкое состояние.
Теплота плавления
Количество теплоты, необходимое для перевода вещества из кристаллического (твердого) в жидкое состояние.
Температура плавления
Температура перехода
кристаллического
(твердого)
состояния в жидкость.
Слайд 78
Удельная теплота плавления
Количество теплоты, необходимое, чтобы перевести
1 кг твердого вещества при постоянной температуре в жидкое
состояние.
Кристаллизация (затвердевание)
Физический процесс, при котором вещество из жидкого состояния с отдачей теплоты переходит в кристаллическое (твердое) состояние.
Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси.
Слайд 79
Сравнение характеристик при плавлении и кристаллизации (затвердевании)
Подведенное
при плавлении количество теплоты отдается веществом при кристаллизации (затвердевании):
Температура плавления определенного вещества при постоянном давлении равна температуре кристаллизации (затвердевания):
Температура плавления большинства веществ повышается с увеличением давления.
Слайд 80
Фаза
Термодинамически равновесное состояние вещества, отличающееся по физическим
свойствам от других возможных равновесных состояний того же вещества.
Пример: если в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза — вода; газообразная фаза — смесь воздуха с водяными парами. Если в воду бросить кусочки льда, то эта система станет трехфазной, в которой лед является твердой фазой.
Слайд 81
Агрегатные состояния
Состояния одного и того же вещества,
переходы между которыми сопровождаются скачкообразным изменением его физических свойств.
Вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Слайд 83
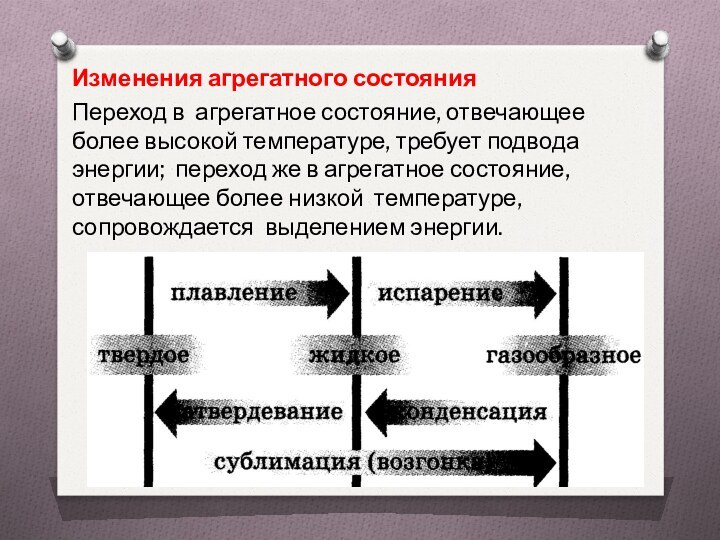
Изменения агрегатного состояния
Переход в агрегатное состояние, отвечающее
более высокой температуре, требует подвода энергии; переход же в
агрегатное состояние, отвечающее более низкой температуре, сопровождается выделением энергии.
Слайд 84
О понятиях «фаза» и «агрегатное состояние»
Часто понятие
«фаза» употребляется в смысле агрегатного состояния, однако надо учитывать,
что оно шире, чем понятие «агрегатное состояние».
В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению (лед, например, встречается в пяти различных модификациях — фазах).
Слайд 85
Фазовый переход
Переход вещества из одной фазы в
другую, связанный обязательно с качественными изменениями свойств вещества.
Примеры:
изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
Слайд 86
Фазовые переходы I рода
Переходы, сопровождающиеся
поглощением или выделением теплоты. Характеризуются постоянством температуры, изменениями энтропии
и объема.
Примеры: плавление, кристаллизация.
Фазовые переходы II рода
Переходы, не связанные с поглощением или выделением теплоты и изменением объема. Характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости.
Примеры: переход ферромагнитных веществ (железа, никеля) при определенных давлении и температуре в парамагнитное состояние; переход металлов и сплавов при температуре, близкой к О К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля.
Слайд 87
Диаграмма состояния
Геометрическое изображение фазовых превращений, где в
координатах р, Т задается зависимость между температурой фазового перехода
и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы
на три области,
соответствующие
условиям
существования
твердой (ТТ), жидкой (Ж) и
газообразной (Г) фаз.
Слайд 88
Кривые фазового равновесия
Кривые на диаграмме; каждая точка
на них соответствует условиям равновесия двух сосуществующих фаз: КП
— твердого тела и жидкости, КИ — жидкости и газа, КС — твердого тела и газа.
Слайд 89
Тройная точка
Точка, в которой пересекаются кривые фазового
равновесия и которая, следовательно, определяет условия (температуру Т и
давление ртр) одновременного равновесного сосуществования трех фаз вещества.
Каждое вещество имеет одну тройную точку. Координаты тройной точки воды: Т = 273,16 К (или t = 0,01 °С (по шкале Цельсия)). Тройная точка воды — реперная точка для построения термодинамической температурной шкалы.
Слайд 91
Возможности экспериментальных диаграмм состояния
На основе экспериментальной диаграммы
состояния можно судить, в каком состоянии находится данное вещество
при определенных р и Т, а также какие фазовые переходы будут происходить при том или ином процессе. Например, при условиях, соответствующих точке 1, вещество находится в твердом состоянии, точке
2 — в газообразном, а
точке 3 — одновременно
в жидком и газообразном
состояниях.
Слайд 92
Допустим, что вещество в твердом состоянии, соответствующем точке
4, подвергается изобарному нагреванию, изображенному на диаграмме состояния горизонтальной
штриховой прямой 4—5—6.
Из рисунка видно, что при температуре, соответствующей точке 5, вещество плавится, при более высокой температуре, соответствующей точке 6, начинает превращаться в газ.
Если же вещество находится в твердом состоянии, соответствующем точке 7, то при изобарном нагревании (штриховая прямая 7—8) кристалл превращается в газ, минуя жидкую фазу.