- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Биоорганическая химия
Содержание
- 2. Впервые термин «углеводы» был предложен профессором Дерптского
- 3. кислород в несколько иной пропорции, чем указано в
- 4. Произведенный в 1861 г. A.M. Бутлеровым синтез
- 5. в изучение углеводов внесли отечественные ученые А.А. Колли, П.П.
- 6. БИОЛОГИЧЕСКАЯ РОЛЬ УГЛЕВОДОВ Углеводы наряду с белками и липидами являются важнейшими химическими соединениями,
- 7. защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета).Углеводы (рибоза, дезоксирибоза) используются для
- 8. С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет,
- 9. Углеводы можно определить как альдегидные или кетонные производные
- 11. МОНОСАХАРИДЫ Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие
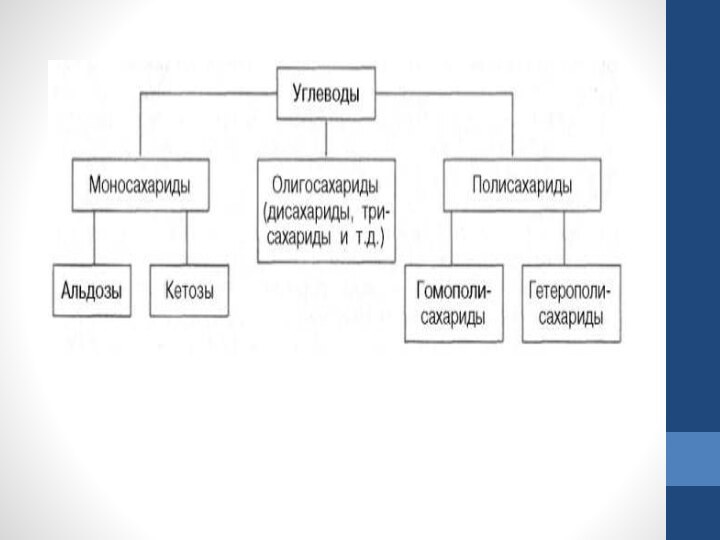
- 12. Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой
- 13. Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы –
- 14. Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n,
- 16. Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в
- 17. Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость
- 18. Однако направление угла вращения поляризованного луча, которое
- 19. Циклические (полуацетальные) формы моносахаридов. Любой моносахарид с конкретными физическими свойствами (температура плавления,растворимость и т.д.) характеризуется специфической величиной удельного вращения [α]D20.
- 21. Явление мутаротации имеет объяснение. Известно, что альдегиды и кетоны легко и обратимо реагируют с эквимолярным количеством спирта с образованием полуацеталей.
- 22. Реакция образования полуацеталя возможна и в пределах одной молекулы,
- 23. Таким образом, явление мутаротации связано с тем, что каждый
- 24. Следует подчеркнуть, что из различных таутомерных форм глюкозы в
- 25. Изменение величины удельного вращения при стоянии (во
- 26. Наконец, следует помнить, что при написании структурных формул по
- 27. Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Подобно циклогексану, пиранозное кольцо
- 28. Основные реакции моносахаридов, продукты реакций и их
- 29. α-D-глюкоза а - линейная формула глюкозы (альдогексоза); б - структурная формула по Хеуорсу; в - конформационная формула (форма кресла).
- 30. Продукт реакции называют гликозидом. Соответственно α- и β-изоме-рам моносахаридов существуют α- и
- 31. При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид:
- 32. Ацилированию и метилированию способны подвергаться и остальные группы моносахаридов, но при
- 33. К N-гликозидам принадлежат исключительно важные в обмене веществ продукты расщепления нуклеиновых кислот и нуклеопротеидов (нуклеоти-ды и нуклеозиды), АТФ, НАД, НАДФ, некоторые антибиотики и т.п.
- 34. ОЛИГОСАХАРИДЫ Олигосахариды – углеводы, молекулы которых содержат от 2 до 10
- 35. В молекуле мальтозы у второго остатка глюкозы имеется свободный полуацетальный гидроксил. Такие дисахариды обладают восстанавливающими свойствами
- 36. Одним из наиболее распространенных дисахаридов является сахароза – обычный пищевой сахар. Молекула сахарозы состоит из
- 37. В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и
- 38. Среди природных трисахаридов наиболее известна рафиноза, содержащая
- 39. ПолисахаридыПолисахариды широко распространены в природе. По функциональным свойствам
- 41. А. Структура полисахаридовПолисахариды, построенные из моносахаридных звеньев одного
- 42. Сложную структуру имеет линейный гетерогликан муреин, который в
- 43. Б. Важнейшие представители полисахаридовДанные таблицы дают представление о
- 44. Крахмал, важнейший резервный полисахарид растений и компонент клеточных стенок.
- 45. Гликозаминогликаны и гликопротеины А.Гиалуроновая кислота Гликозаминогликаны, группа кислых гетерополисахаридов, в
- 47. Гиалуроновая кислота, относительно простой неэтерифицированный гликозаминогликан, построена из дисахаридных
- 48. Б. Олигосахарид из иммуноглобулина IgGМногие белки внешней стороны плазматических мембран и большинство секретируемых белков содержат олигосахаридные цепи,
- 49. В молекуле олигасахарида имеется Т-образный базовый фрагмент (кор) из двух остатков
- 50. В. Различные типы олигосахаридов в гликопротеинахВ некоторых гликопротеинах наряду с N-гликозидными олигосахаридами (по остатку аспарагина)
- 51. Отщепление остатков маннозы с заменой на другие моносахариды приводит к образованию
- 52. Скачать презентацию
- 53. Похожие презентации
Впервые термин «углеводы» был предложен профессором Дерптского (ныне Тартуского) университета К.Г. Шмидтом в 1844 г. В то время предполагали, что все углеводы имеют общую формулу Cm(H2O)n, т.е. углевод + вода. Отсюда название «углеводы». Например, глюкоза и фруктозаимеют формулу С(Н2О)6, тростниковый сахар (сахароза) C12(H2O)11, крахмал [С6(Н2О)5]n и т.д. В дальнейшем















![Биоорганическая химия Циклические (полуацетальные) формы моносахаридов. Любой моносахарид с конкретными физическими свойствами (температура плавления,растворимость и т.д.) характеризуется специфической величиной удельного вращения [α]D20.](/img/tmb/13/1269846/00a62910007485795dcbd3ad4631a33a-720x.jpg)
























Слайд 3 кислород в несколько иной пропорции, чем указано в общей
формуле (например, дезоксирибоза С5Н10О4). В 1927 г. Международная комиссия по реформе химической
номенклатуры предложила термин «углеводы» заменить термином «глициды», однако старое название «углеводы» укоренилось и является общепризнанным. Химия углеводов занимает одно из ведущих мест в истории развития органической химии. Тростниковый сахар можно считать первым органическим соединением, выделенным в химически чистом виде.Слайд 4 Произведенный в 1861 г. A.M. Бутлеровым синтез (вне организма) углеводов из формальдегидаявился
первым синтезом представителей одного из трех основных классов веществ (белки, липиды, углеводы), входящих
в состав живых организмов. Химическая структура простейших углеводов была выяснена в конце XIX в. в результате фундаментальных исследований Э. Фишера. Значительный вкладСлайд 5 в изучение углеводов внесли отечественные ученые А.А. Колли, П.П. Шорыгин,
Н.К. Кочетков и др. В 20-е годы нынешнего столетия
работами английского исследователя У. Хеуорса были заложены основы структурной химии полисахаридов. Со второй половины XX в. происходит стремительное развитие химии и биохимии углеводов, обусловленное их важным биологическим значением.
Слайд 6
БИОЛОГИЧЕСКАЯ РОЛЬ УГЛЕВОДОВ
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в
состав живых организмов. У человека и животных углеводы выполняют важные функции: энергетическую
(главный вид клеточного топлива), структурную (обязательный компонент большинства внутриклеточных структур) и
Слайд 7
защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета).
Углеводы (рибоза, дезоксирибоза) используются для синтеза нуклеиновых
кислот, они являются составными компонентами нуклеотидных ко-ферментов, играющих исключительно
важную роль в метаболизме живых существ. В последнее время все большее внимание к себе привлекаютсмешанные биополимеры, содержащие углеводы: гликопептиды и глико-протеины, гликолипиды и липополисахариды, гликолипопротеины и т.д. Этивещества выполняют в организме сложные и важные функции.Слайд 8 С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет, галактоземия,
нарушение в системе депо гликогена, нетолерантность к молоку и т.д. Следует отметить,
что в организме человека и животного углеводы присутствуют в меньшем количестве (не более 2% от сухой массы тела), чем белки и липиды в растительных организмах за счет целлюлозы на долю углеводов приходится до 80% от сухой массы, поэтому в целом в биосфереуглеводов больше, чем всех других органических соединений вместе взятых.Слайд 9 Углеводы можно определить как альдегидные или кетонные производные полиатомных
(содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти
производные. Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
Слайд 11
МОНОСАХАРИДЫ
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную
или кетонную) группу. Если карбонильная группа находится в конце
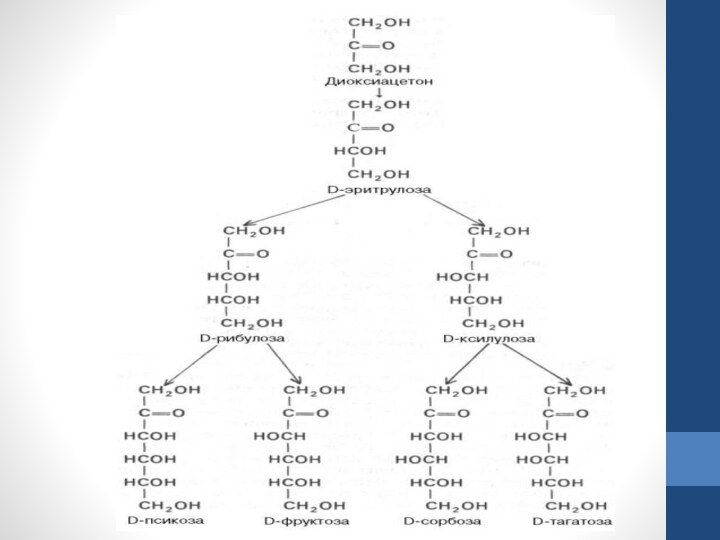
цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется кетозой.Слайд 12 Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы
трехатомногоспирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к
образованию диоксиацетона (кетоза).Слайд 13 Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2,
альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на
один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров.Слайд 14 Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где
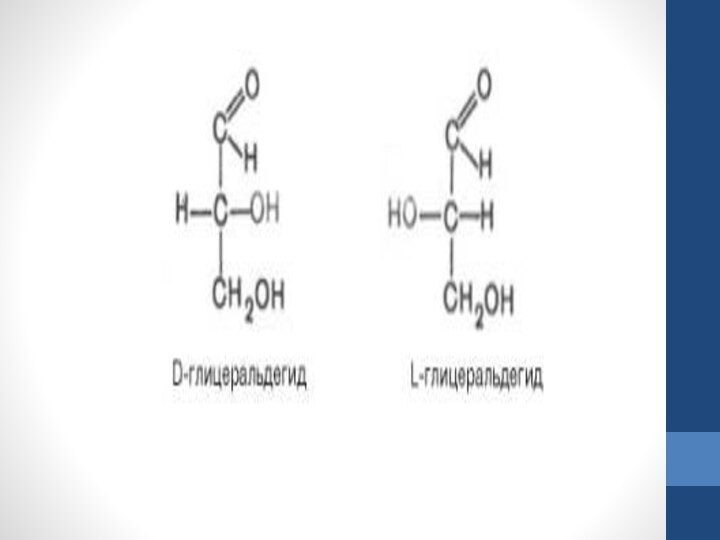
N – число стереоизомеров, а n – число асимметричныхатомов углерода. Как
отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров. Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:Слайд 16 Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде
16 стереоизомеров (24), представителем которых является, например, глюкоза. Для альдопентоз и альдотетроз
число сте-реоизомеров равно соответственно 23 = 8 и 22 = 4. Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда.Слайд 17 Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного
луча света – одна из важнейших особенностей веществ (в том числе моносахаридов), молекулы которых
имеют асимметричный атом углерода или асимметричны в целом. Свойство вращать плоскость поляризованного луча вправо обозначают знаком плюс (+), а в противоположную сторону – знаком минус (–). Так, D-глицеральдегид вращает плоскость поляризованного луча вправо, т. е. D-глицеральдегид является D(+)-альдотриозой, а L-гли-церальдегид – L(–)-альдотриозой.Слайд 18 Однако направление угла вращения поляризованного луча, которое определяется
асимметрией молекулы в целом, заранее непредсказуемо. Моносахариды, относящиеся по стереохимической конфигурации к D-ряду, могут
быть левовращающими. Так, обычная формаглюкозы, встречающаяся в природе, является правовращающей, а обычная форма фруктозы – левовращающей.
Слайд 19
Циклические (полуацетальные) формы моносахаридов.
Любой моносахарид с конкретными физическими свойствами (температура плавления,растворимость и т.д.)
характеризуется специфической величиной удельного вращения [α]D20.
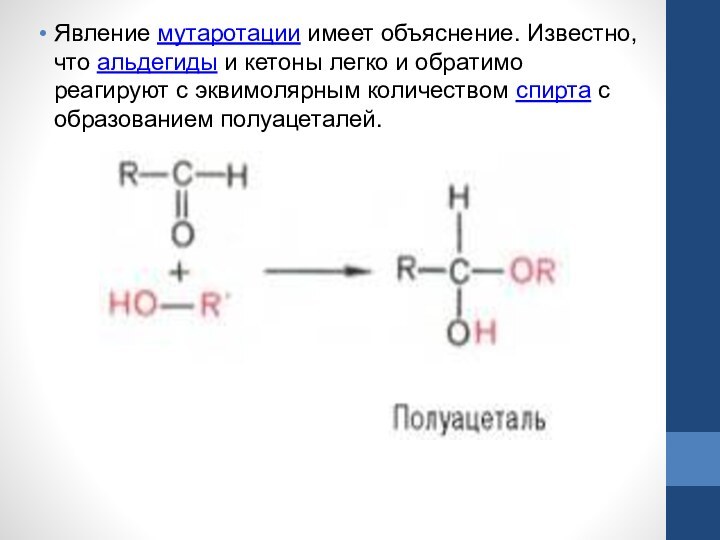
Слайд 21 Явление мутаротации имеет объяснение. Известно, что альдегиды и кетоны легко и обратимо
реагируют с эквимолярным количеством спирта с образованием полуацеталей.
Слайд 22 Реакция образования полуацеталя возможна и в пределах одной молекулы, если
это не связано с пространственными ограничениями. По теории А.
Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольцасахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у которой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-моди-фикациеймоносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот.Слайд 23 Таким образом, явление мутаротации связано с тем, что каждый твердый
препарат углеводов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и
стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, характерное для исходной циклической формы, постепенно меняется. Наконец, устанавливается постоянное удельное вращение, которое характерно для равновесной смеси таутомеров. Например, известно, что в водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени – в виде α- и β-глюкофураноз и совсем небольшое количество глюкозы – в виде альдегидной формы.Слайд 24 Следует подчеркнуть, что из различных таутомерных форм глюкозы в свободном
состоянии известны лишь α- и β-пиранозы. Существование малых количеств фураноз и
альдегидной формы в растворах доказано, но в свободном состоянии они не могут быть выделены вследствие своей неустойчивости. Установлено, что величина удельного вращения при растворении любого моносахарида постепенно меняется и лишь при дли тельном стояниираствора достигает вполне определенного значения. Например, для свежеприготовленного раствора глюкозы [α]D20= +112,2°, после длительного стояния раствора эта величина достигает равновесного значения [α]D20= +52,5°.Слайд 25 Изменение величины удельного вращения при стоянии (во времени) растворов моносахаридов называется мутаротацией.
Очевидно, мутаротация должна вызываться изменением асимметрии молекулы, а следовательно, тВ 20-х годах У.
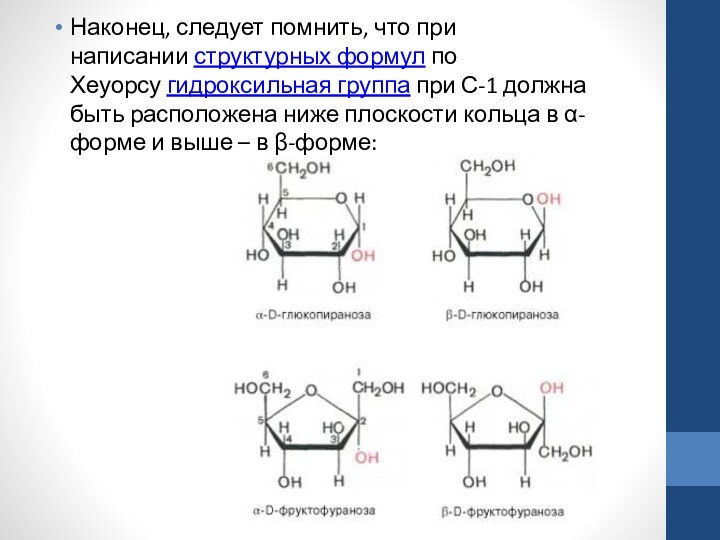
Хеуорс предложил более совершенный способ написания структурных формул углеводов. Формулы Хеуорса – шести- или пятиугольники, причем они изображены в перспективе: кольцо лежит в горизонтальной плоскости. Находящиеся ближе к читателю связи изображают более жирными линиями (углеродные атомы цикла не пишут). Заместители, расположенные справа от остова молекулы при ее вертикальном изображении, помещают ниже плоскости кольца, а заместители, находящиеся слева,– выше плоскости кольца. Обратное правило применяют только для того единственного углеродного атома, гидроксильная группа которого участвует в образовании циклического полуацеталя. Так, у D-сахаров группу СН2ОН пишут над этим атомом углерода, а водородный атом при нем – внизу.рансформацией ее структуры в растворе.Слайд 26 Наконец, следует помнить, что при написании структурных формул по Хеуорсу гидроксильная
группа при С-1 должна быть расположена ниже плоскости кольца в
α-форме и выше – в β-форме:Слайд 27 Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Подобно циклогексану, пиранозное кольцо может
принимать две конфигурации – форму кресла и форму лодки
(конформационные формулы). Форма кресла обычно более устойчива, и, по-видимому, именно она преобладает в большей части природных сахаров.
Слайд 28
Основные реакции моносахаридов, продукты реакций и их свойства
Реакции полуацетального гидроксила. Уже
отмечалось, что моносахариды как в кристаллическом состоянии, так и в растворе в основном существуют
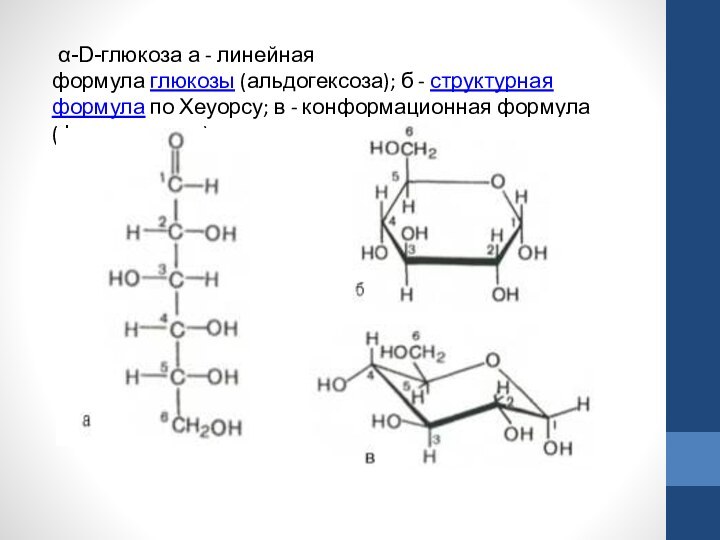
в полуацетальных формах. Полуацетальный гидроксил отличается большей реакционной способностью и может замещаться другими группировками в реакциях со спиртами, карбоновыми кислотами, фенолами и т.д.Слайд 29 α-D-глюкоза а - линейная формула глюкозы (альдогексоза); б - структурная формула по
Хеуорсу; в - конформационная формула (форма кресла).
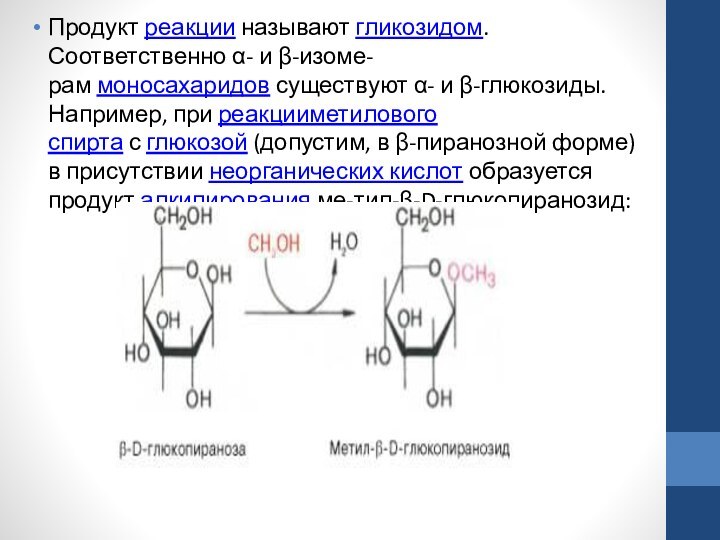
Слайд 30 Продукт реакции называют гликозидом. Соответственно α- и β-изоме-рам моносахаридов существуют α- и β-глюкозиды.
Например, при реакцииметилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических кислот образуется
продукт алкилирования ме-тил-β-D-глюкопиранозид:
Слайд 31
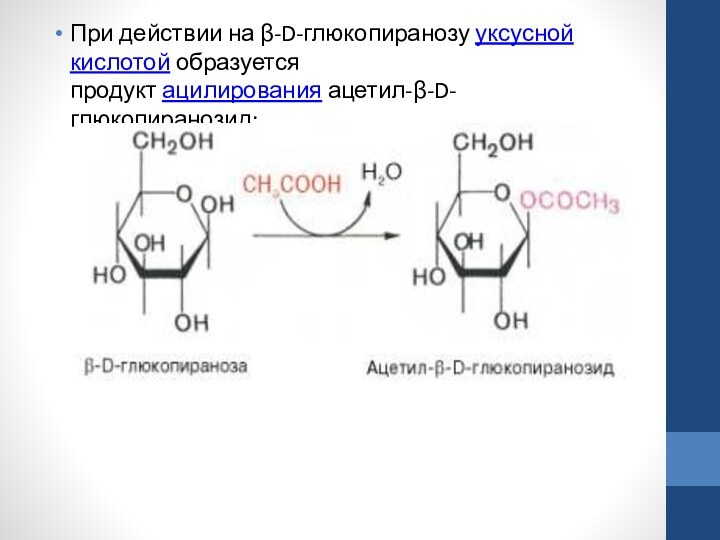
При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид:
Слайд 32 Ацилированию и метилированию способны подвергаться и остальные группы моносахаридов, но при намного
более жестких условиях. Если вреакцию вступают спирты, фенолы или карбоновые кислоты, продукты реакции называют О-гликозидами. Следовательно,
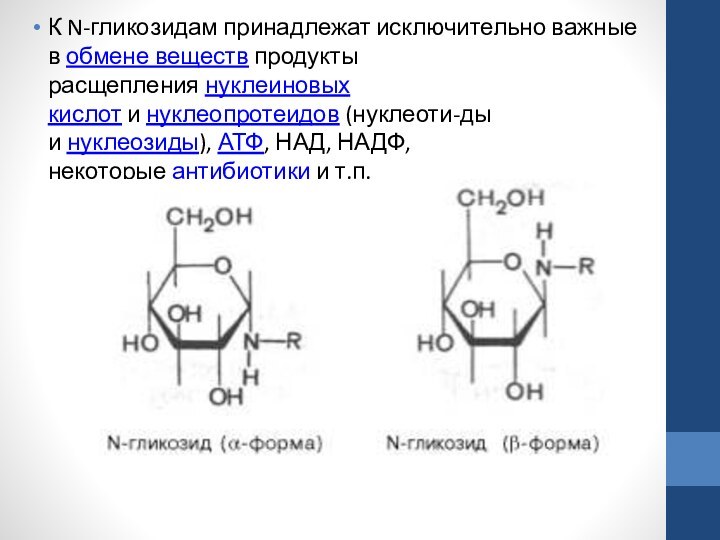
метил-β-D-глюкопира-нозид и ацетил-β-D-глюкопиранозид являются О-гликозидами (связь осуществляется через кислород). Природные О-гликозиды, большинство из которых образуется в результате жизнедеятельности растений, существуют преимущественно в β-форме. Важным классом гликозидов являются N-гликозиды, в которых глико-зидная связь осуществляется через азот, а не через кислород . N-гликозиды рассматривают как производные моносахаридов, у которых гликозидная часть молекулы связана через атом азота с радикалом органического соединения R, не являющегося углеводом. Как и О-гликозиды, N-гликозиды могут быть построены как пиранозиды или как фуранозиды и иметь α-и β-форму:Слайд 33 К N-гликозидам принадлежат исключительно важные в обмене веществ продукты расщепления нуклеиновых
кислот и нуклеопротеидов (нуклеоти-ды и нуклеозиды), АТФ, НАД, НАДФ, некоторые антибиотики и т.п.
Слайд 34
ОЛИГОСАХАРИДЫ
Олигосахариды – углеводы, молекулы которых содержат от 2 до 10 остатков моносахаридов, соединенных
гликозидными связями. В соответствии с этим различают дисахариды, трисахариды и
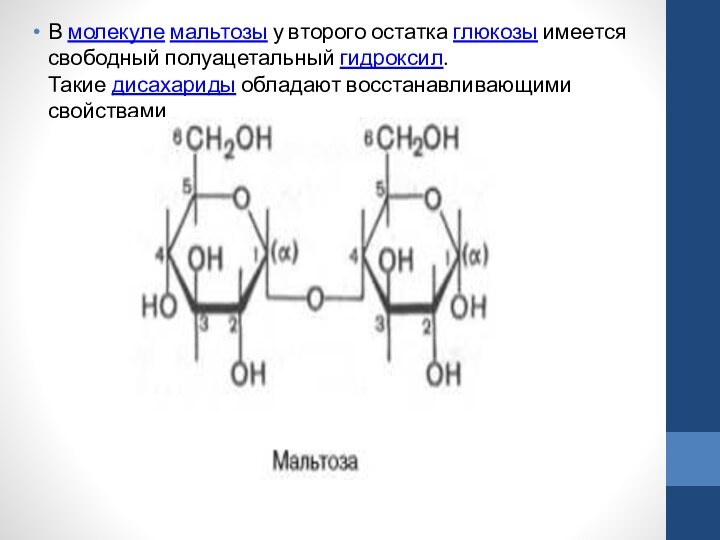
т.д. Дисахариды – сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахаридов. Дисахариды наряду сполисахаридами являются одними из основных источников углеводов в пище человека и животных. По строению дисахариды – это гликозиды, в которых 2 молекулы моносахаридов соединены гликозидной связью. Среди дисахаридов наиболее широко известны мальтоза, лактоза и сахароза. Мальтоза, являющаяся α-глюкопиранозил-(1–>4)-α-глюкопира-нозой, образуется как промежуточный продукт при действии амилаз на крахмал (или гликоген), содержит 2 остатка α-D-глюкозы (название сахара, полуацетальный гидроксил которого участвует в образовании гликозидной связи, оканчивается на «ил»).
Слайд 35
В молекуле мальтозы у второго остатка глюкозы имеется свободный полуацетальный гидроксил. Такие дисахариды обладают восстанавливающими свойствами
Слайд 36 Одним из наиболее распространенных дисахаридов является сахароза – обычный пищевой сахар. Молекула сахарозы состоит из одного
остатка D-глюкозы и одного остатка D-фруктозы. Следовательно, это α-глюко-пиранозил-(1–>2)-β-фруктофуранозид:
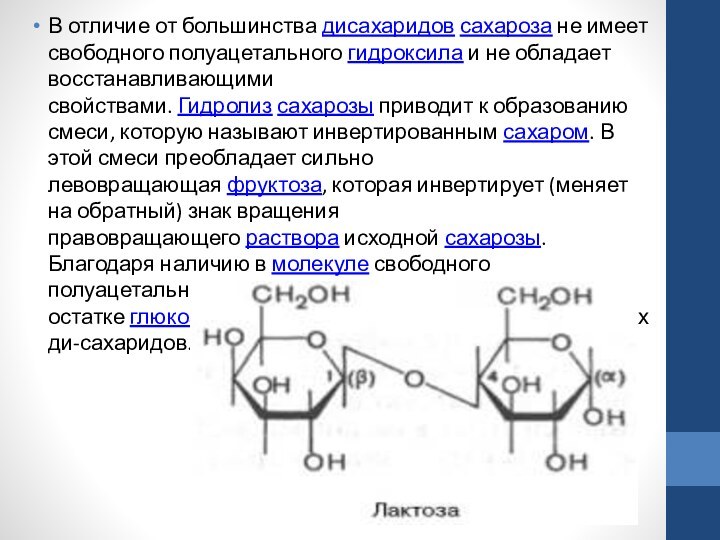
Слайд 37 В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и не
обладает восстанавливающими свойствами. Гидролиз сахарозы приводит к образованию смеси, которую называют инвертированным сахаром.
В этой смеси преобладает сильно левовращающая фруктоза, которая инвертирует (меняет на обратный) знак вращения правовращающего раствора исходной сахарозы. Благодаря наличию в молекуле свободного полуацетального гидрокси-ла (в остатке глюкозы) лактоза относится к числу редуцирующих ди-сахаридов.Слайд 38 Среди природных трисахаридов наиболее известна рафиноза, содержащая остатки фруктозы, глюкозы и галактозы.
Рафиноза в больших количествах содержится в сахарной свекле и во многих
других растениях. В целом олигосахариды, присутствующие в растительных тканях, разнообразнее по своему составу, чем олигосахариды животных тканей.
Слайд 39
Полисахариды
Полисахариды широко распространены в природе. По функциональным свойствам они
подразделяются на три группы. Структурные полисахаридыпридают клеткам, oрганам и целым организмам механическую прочность. Водорастворимые полисахариды высоко гидратированы и
предохраняют от высыхания клетки и ткани. Наконец, резервные полисахариды служат энергетическим ресурсом, из которого номере необходимости в организм поступают моносахариды, являющиеся клеточным "топливом". Благодаря полимерной природе резервные полисахаридыосмотически неактивны и поэтому могут накапливаться в клетках в больших количествах.
Слайд 41
А. Структура полисахаридов
Полисахариды, построенные из моносахаридных звеньев одного типа,
называются гомогликаны, а построенные из различных моносахаридных звеньев — гетерогликаны, а
построенные из различных моносахаридных звеньев — гетерогликаны. Оба полимера могут быть линейными или разветвленными. В качестве примера разветвленного гомогликана здесь представлен фрагмент молекулы гликогена. Похожее строение имеет амилопектин, разветвленный компонент растительного крахмала. Оба полимера построены в основном из остатков глюкозы, связанных в положении α(1→4). B гликогене точки ветвления располагаются в среднем через каждые 8-10 остатков глюкозы. Связи в точках ветвления находятся в положении α(1→8), остальные остатки боковой цепи связаны в положении α(1→4). За счет этого образуется разветвленная, древовидная структура, в которой имеется только одна аномерная ОН-группа, т.е. только один восстанавливающий конец.Слайд 42 Сложную структуру имеет линейный гетерогликан муреин, который в качестве
структурного полисахарида придает прочность клеточным стенкам бактерий. На схеме приведен только один сегмент
этой нитевидной молекулы. В муреине чередуются остатки двух различных моносахаридов, связанных в положении β(1→4): N-ацетилглюкозамина (GlcNAc) и характерной для муреина N-ацетилмурамовой кислоты (MurNAc). Последняя является простым эфиром молочной кислоты с N-ацетилглюкозамином. В клеточной стенке карбоксильная группа молочной кислоты связана амидной связью с пептидом (на схеме показан условно), который соединяет отдельные цепи муреина в трехмерную сетчатую структуру (на схеме не приведена).
Слайд 43
Б. Важнейшие представители полисахаридов
Данные таблицы дают представление о взаимосвязи
и сходстве ранее упомянутых гликанов с теми, которые обсуждаются в настоящем
разделе. Наряду с муреином к бактериальным полисахаридам принадлежит декстран, полимер глюкозы, связанной преимущественно в положении α(1→6), а в точках ветвления в положении α(1→3). В воде декстран образует вязкие слизи или гели, из которых путем введения поперечных связей получают гидрофильные сорбенты для разделения макромолекул методом молекулярно-ситовой хроматографии. Растворимый декстран находит применение в качестве заменителя плазмы при переливании крови, а также используется как пищевой продукт. Полисахариды из водорослей (например, агарозы и каррагенаны) находят широкое применение как желирующие вещества. Агарозы более 100 лет используются в микробиологии как гелевая основа питательных сред (агар-агар).Слайд 44 Крахмал, важнейший резервный полисахарид растений и компонент клеточных стенок. Инулин,полимер фруктозы,
используется как заменитель крахмала в питании диабетиков. Кроме того, он служит
контрольным веществом при определении почечного клиренса. Хитин, гомополимер из N-ацетилглюкозамина, связанного в положении β(1→4), — основной компонент наружного скелета насекомых и панцыря ракообразных. Кроме того, хитин входит в состав клеточных стенок мицелия грибов. Гликоген, важнейший резервный полисахарид животного мира, содержится в печени и мышцах. Синтез и расщепление гликогена контролируется гормонами.
Слайд 45
Гликозаминогликаны и гликопротеины
А.Гиалуроновая кислота
Гликозаминогликаны, группа кислых гетерополисахаридов, в качестве структурных элементов протеогликанов являются важным компонентом
межклеточного матрикса. В качестве типовых структурных блоков гликозаминогликаны содержат аминосахара, такие, как
глюкуроновая или идуроновая кислоты. Большинство полисахаридов этой группы в различной степени этерифицировано остатками серной кислоты, которые усиливают их кислотные свойства. Гликозаминогликаны присутствуют в организме позвоночных как в свободном виде, так и в составе протеогликанов.Слайд 47 Гиалуроновая кислота, относительно простой неэтерифицированный гликозаминогликан, построена из дисахаридных звеньев,
состоящих из N-ацетилглюкозамина и глюкуроновой кислоты, соединенных в положении β(1→3).
Повторяющиеся звенья связаны в положении β(1→4). Благодаря присутствию β(1→3)-cвязeй молекула гиалуроновой кислоты, насчитывающая несколько тысяч моносахаридных остатков, принимает конформациюспирали. На один виток спирали приходится три дисахаридных блока. Локализованные на внешней стороне спирали гидрофильные карбоксильные группы остатков глюкуроновой кислоты могут связывать ионы Ca2+. За счет сильной гидратация этих групп гиалуроновая кислота и другиеГликозаминогликаны при образовании гелей связывают 10 000-кратный объем воды. Гиалуроновая кислота выполняет функцию стабилизатора геляв стекловидном теле глаза, которое содержит всего 1% гиалуроновой кислоты и на 98% состоит из воды.
Слайд 48
Б. Олигосахарид из иммуноглобулина IgG
Многие белки внешней стороны плазматических мембран и большинство секретируемых белков содержат олигосахаридные цепи, которые
синтезируются в процессе посттрансляционной модификации в эндоплазматическом ретикулуме и
в аппарате Гольджи. Цитоплазматические белки, напротив, редко бывают гликозилированы. Гликопротеины могут содержать до 50% углеводов, но, как правило, вмолекуле преобладает белковая часть.В качестве примера на схеме представлена структура олигосахарида иммуноглобулина IgG. Олигосахарид связан Ν-гликозидной связью с амидной группой остатка аспарагина в Fс-области тяжелой цепи белка. Функция олигосахарида не установлена.