Слайд 2
Электрофорез в гелях
метод, который служит для разделения макромолекул
на основе их размера, электрического заряда и других физических
свойств.
«электро» + «форез» (греч. Phoros - «переносить»)
метод, в котором молекулы вынуждены перемещаться через пространство геля под воздействием электрического тока
Слайд 3
Основные принципы метода
В составе нуклеиновых кислот и белков
присутствуют химические группы, обладающие в водном растворе электрическим зарядом.
Величина общего заряда молекулы определятся количеством заряженных групп, их природой, а также pH раствора.
в нуклеиновых кислотах в широком диапазоне pH на каждую фосфатную группу приходится заряд -1.
Под действием внешнего электрического поля заряженные молекулы могут перемещаться к катоду или аноду, в зависимости от их суммарного заряда.
Слайд 4
Электрофоретическая
подвижность
скорость движения молекулы в поле единичной напряжённости
Именно различия в электрофоретической подвижности различных биологических молекул
часто используются для разделения их смесей.
где
U – электрофоретическая подвижность ;
d – расстояние (см), пройденное образцом в геле;
E – напряжённость электрического поля (В/см) в межэлектродном пространстве;
t – время миграции (сек).
d/t
E
Слайд 5
Типы гелей, используемых для электрофореза ДНК
Агарозный гель
Полиакриламидный гель
Смешанные
гели
Слайд 6
Агарозный гель
Агароза – линейный полисахарид (~12 000 Да),
Образование
геля идёт путём связывания в пространственную сетку пучков нитей,
за счёт образования водородных связей между ними.
Агарозные гели имеют «поры» большого размера и используются для разделения больших молекул
(>200 кДа).
Разделение происходит быстро, но с ограниченным разрешением, т.к. полосы имеют тенденцию размываться (результат большого размера пор).
Агарозные гели менее, чем полиакриламидные среды, чувствительны к случайным флуктуациям в макроструктуре молекул ДНК.
Агаробиоза
(галактоза + 3,6–ангидрогалактоза)
Слайд 7
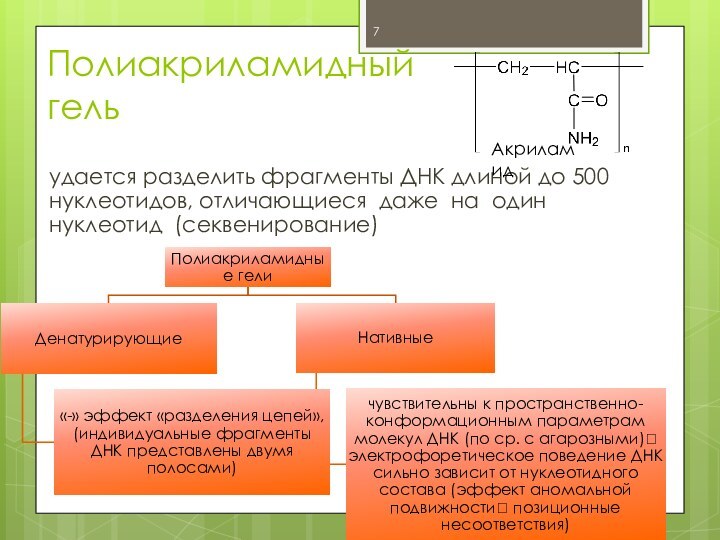
Полиакриламидный
гель
удается разделить фрагменты ДНК длиной до 500
нуклеотидов, отличающиеся даже на один нуклеотид (секвенирование)
Акриламид
Слайд 8
Смешанные гели
При разделении крупных нуклеопротеиновых комплексов или
частиц используют смешанные гели, состоящие из агарозы (ок. 0.5%)
и полиакриламида (1.5% - 2.5%)
Агароза выполняет лишь функцию механического каркаса, который не нарушает эффект молекулярного сита, создаваемого сеткой ПААГ.
Для образования такой структуры надо обеспечить условия, при которых агароза затвердевает раньше, чем полимеризуется ПААГ.
Слайд 9
Факторы, определяющие скорость миграции ДНК через агарозный гель
Размер молекул ДНК
Концентрация агарозы
Конформация ДНК
Напряженность
электрического поля
Состав оснований и температура
Концентрация ДНК в пробе
Характер растворителя
Слайд 10
Размер молекул ДНК
Молекулы линейной двухцепочечной ДНК перемещаются в
геле со скоростями, обратно пропорциональными десятичному логарифму их молекулярных
масс, а следовательно, и размеру.
НО: молекулы ДНК должны достаточно свободно мигрировать в геле, лишь изредка сталкиваясь с его волокнами.
Слайд 11
Концентрация агарозы
соотношение Фергюсона устанавливает линейную зависимость между логарифмом
электрофоретической подвижности (U) и концентрацией геля (Т):
logU =logU0
–KRT, где
U0 – электрофоретическая подвижность частицы в отсутствие геля;
KR – коэффициент ретардации, зависящий от свойств геля, а также размеров и формы молекулы.
В горизонтальных гелях агароза обычно используется в концентрации от 0.7% до 3%
Слайд 12
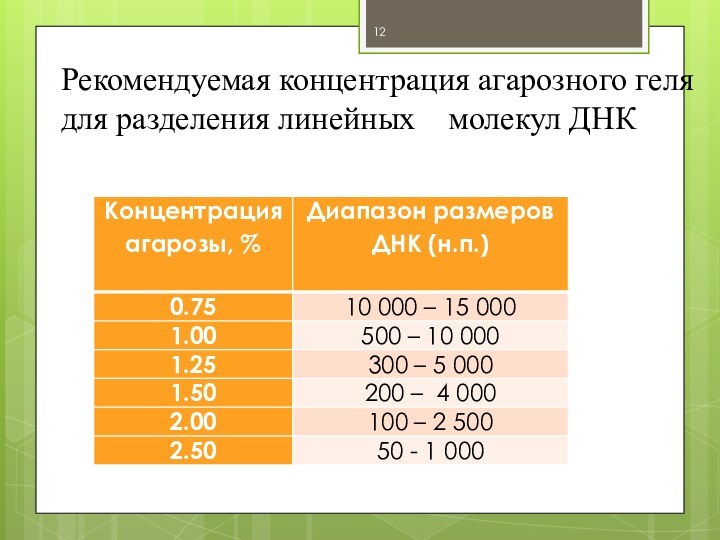
Рекомендуемая концентрация агарозного геля для разделения линейных
молекул ДНК
Слайд 13
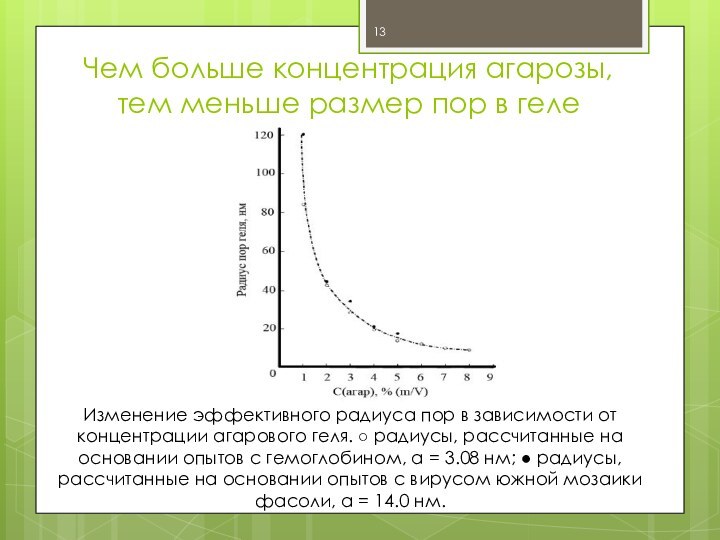
Чем больше концентрация агарозы, тем меньше размер пор
в геле
Изменение эффективного радиуса пор в зависимости от
концентрации агарового геля. ○ радиусы, рассчитанные на основании опытов с гемоглобином, а = 3.08 нм; ● радиусы, рассчитанные на основании опытов с вирусом южной мозаики фасоли, а = 14.0 нм.
Слайд 14
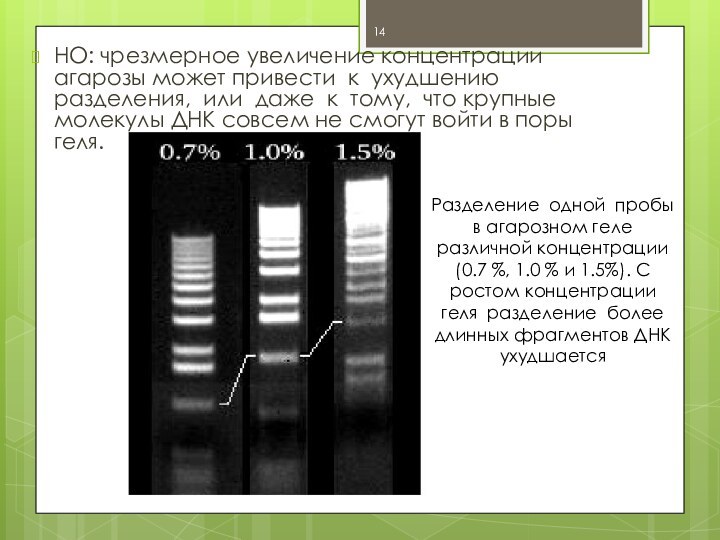
НО: чрезмерное увеличение концентрации агарозы может привести к
ухудшению разделения, или даже к тому, что крупные молекулы
ДНК совсем не смогут войти в поры геля.
Разделение одной пробы в агарозном геле различной концентрации (0.7 %, 1.0 % и 1.5%). С ростом концентрации геля разделение более длинных фрагментов ДНК ухудшается
Слайд 15
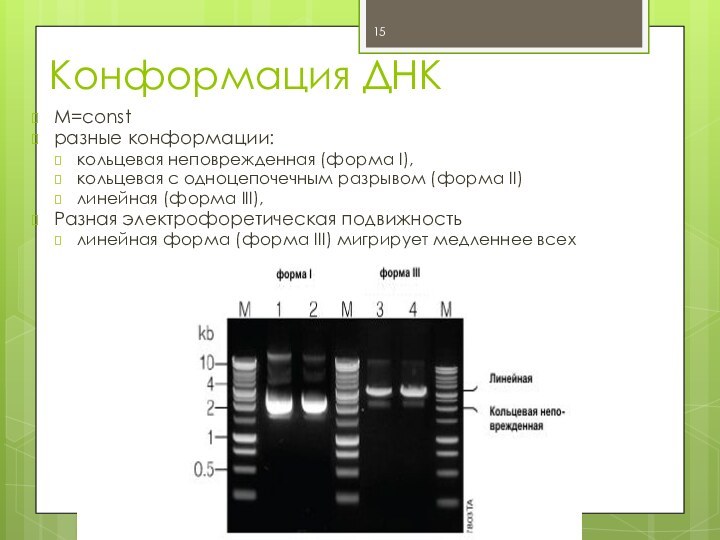
Конформация ДНК
M=const
разные конформации:
кольцевая неповрежденная (форма I),
кольцевая с
одноцепочечным разрывом (форма II)
линейная (форма III),
Разная электрофоретическая
подвижность
линейная форма (форма III) мигрирует медленнее всех
Слайд 16
Напряженность электрического поля
При низких напряженностях скорость перемещения
фрагментов линейной ДНК пропорциональна приложенному напряжению.
НО: увеличение напряженности
поля приводит к тому, что более длинные молекулы начинают догонять более короткие ухудшение разделения .
Opt: 5 В/см.
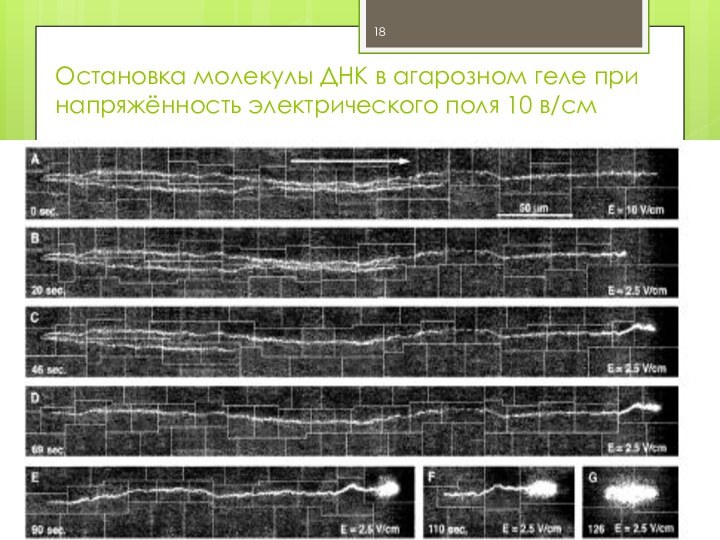
При 10 в/см :
полная остановка больших молекул ДНК.
Слайд 17
Различные стадии миграции молекулы ДНК в агарозном геле.
Напряжённость электрического поля 5 в/см
Слайд 18
Остановка молекулы ДНК в агарозном геле при напряжённость
электрического поля 10 в/см
Слайд 19
Состав оснований и температура
Слабая зависимость
В агарозных гелях
при 4 – 30оС изменения относительной электрофоретической подвижности ДНК
не наблюдается.
Обычно электрофорез в агарозных гелях ведут при комнатной температуре.
НО: гели, содержащие менее 0,5% агарозы, очень мягкие, поэтому с ними работают при 4оС (они становятся более плотными).
Слайд 20
Концентрация ДНК в пробе
Недостаточная концентрация не визуализируем ДНК.
Избыточное
количество ДНК
бόльшая электрофоретическая подвижность
искажается (размывается) форма
полосы, а после окрашивания интенсивность её свечения перестаёт напрямую соответствовать количеству окрашенной ДНК.
2-500 нг в полосе шириной 0.5 см
Слайд 21
Характер растворителя
облако противоионов частично экранирует заряд самόй молекулы
и ослабляет действие на неё электрического поля.
само облако
противоионов, обладая противоположным по отношению к молекуле зарядом, будет взаимодействовать с электрическим полем и смещаться в противоположную сторону, тормозя движение молекулы (явление электрофоретического трения).
при движении молекулы отдельные ионы вокруг неё тоже непрерывно перемещаются в ионной атмосфере происходит непрерывное замещение ионов. Для вновь входящих ионов требуется время, чтобы найти своё место в поле макромолекулы и прийти в равновесие с её окружением, что приводит к нарушению сферически симметричной формы ионной атмосферы. В результате, двойной электрический слой позади частицы растягивается и тормозит её движение (явление релаксационного эффекта)
Слайд 22
Сдвиг полос
в процессе электрофореза фрагменты ДНК в одной
дорожке геля движутся быстрее или медленнее, чем идентичные фрагменты
в соседней дорожке.
Причины:
— неодинаковое количество ДНК в разных дорожках;
— неодинаковые ионные условия в препаратах, внесенных в разные дорожки (присутствие примесей, влияющих электрофоретическую подвижность ДНК — солей, спирта, фенола, этидиумбромида и др.);
— избыточная напряженность электрического поля;
— перегрев и нарушение структуры геля (избыточный ток);
— истощение электрофорезного буфера;
— микрогетерогенность геля.
—локальные искривления молекул ДНК (А 3-6 п.н., повторяющиеся каждые 10-11 пар; ПААГ)
В некоторых случаях сдвиг полос носит не ступенчатый, а сглаженный характер (эффект "улыбки").
искажения электрофоретической картины поддаются математическому анализу (маркер в каждую 3-4 дорожку).
Слайд 23
Измерение электрофоретической подвижности фрагментов ДНК
«На глазок» – нельзя!
Методы:
измерение
обычной линейкой (малая точность, неприменим для коротких гелей)
Дигитайзер (графический
планшет) (анг. — digitizer), представляющий собой электронный модуль, включающий курсор-измеритель и цифровое координатное устройство.
компьютеризованные регистрирующие системы, снабженные соответствующими программными средствами.